荷斯坦牛及其杂种公牛养分表观消化率、小肠组织形态及消化酶活性差异研究
2022-05-12兰丽娟石斌刚祁有鹏张雪萍王向彦赵芳芳
兰丽娟 石斌刚 祁有鹏 左 志 张雪萍 王向彦 时 钰 张 伟 赵芳芳 马 金 胡 江*
(1.甘肃农业大学动物科学技术学院,甘肃省草食动物生物技术重点实验室,兰州 730070;2.甘肃前进牧业科技有限责任公司,张掖 734000)
随着经济快速发展,饮食结构不断改善,人民生活对牛肉产量与质量有了更高要求,但牛肉供应能力有限,导致牛肉供需差距不断加大。2020年我国牛肉产量672万t,位居世界第4位,而牛肉消费量951.5万t,其中进口牛肉约280万t[1-2]。我国肉牛业仍处于产业发展的初级阶段,在品种选育改良、营养与饲养、屠宰加工等方面仍存在许多不足,限制了我国现有品种种质优势的发挥[3]。奶公牛作为肉牛育肥的重要资源,由于饲粮配制及精准化饲养技术应用推广欠缺,其肉用性能尚未充分发挥。
探索肉牛营养物质消化吸收特点,是合理配制育肥饲粮、开展精准饲养的关键。消化率反映动物对饲料营养物质利用能力,是衡量饲料可消化性和动物消化能力的统一指标,在实际测定过程中因粪中所含养分包括动物内源性产物,常用表观消化率表示,且受动物品种、饲粮结构等因素影响[4-7]。肠道是营养物质消化吸收的主要场所,与动物生长发育及健康息息相关。小肠组织结构是消化吸收的基本保证,其绒毛长度(villus length,VL)、隐窝深度(crypt depth,CD)、绒毛长度/隐窝深度(villus length/crypt depth,V/C)值、肌层厚度(myometrial thickness,MT)是衡量反刍动物小肠消化吸收功能的重要指标[8],与动物品种、年龄、营养水平等密切相关[9-11]。反刍动物营养物质经过瘤胃发酵后流入小肠通过各种消化酶进行化学性消化,消化酶活性可反映肠道发育情况和养分表观消化率,受品种、年龄、饲粮、分泌部位等因素影响[12-13]。奶公牛作为重要育肥牛源,其小肠组织形态、消化酶活性等方面研究报道较少。
鉴于此,本试验测定各育肥阶段荷斯坦牛及其杂种公牛养分表观消化率、胃肠道结构和消化酶活性,旨在揭示不同类型肉牛消化特性及小肠形态结构差异,为肉牛精准化饲养提供理论依据。
1 材料与方法
1.1 试验设计及试验动物

1.2 试验饲粮
采用单因素试验设计,3组试验肉牛饲粮组成一致,复合秸秆颗粒饲料(玉米秸秆60%、燕麦草40%混合制粒)替代40%粗饲料(风干基础)。按张丽英[14]的方法测定秸秆颗粒营养成分。试验牛饲粮配制参照《肉牛饲养标准》(NY/T 815—2004)[15],不同育肥阶段饲粮组成及营养水平见表1。

表1 饲粮组成及营养水平(风干基础)
1.3 饲养管理
试验肉牛编号入舍,预试期用伊维菌素驱虫,小苏打健胃;分组散栏式饲养,饲粮经全混合日粮(TMR)搅拌机搅拌后,每日07:00、18:00称重后各饲喂1次,饲粮喂量以剩余5%~10%为宜,采食后自由饮水。在饲喂过程中仔细观察试验牛采食和反刍情况,次日早、晚饲喂前清槽,收集剩料并称重记录。
1.4 样品采集及测定
1.4.1 养分表观消化率测定
试验肉牛(每组各6头)均测定育肥前、中、后期的养分表观消化率。
饲料样品采集:采用四分法,分别在育肥前、中和后期开始后的1个月,连续采集6 d混合饲粮,每天采集200 g左右,并收集剩料,计算采食量,并将其中一部分混合均匀,用于测定养分含量。
粪样采集:在采集饲粮样品的同时,连续6 d采集试验牛粪样并混合。取一部分粪样加10%硫酸固氮,4 ℃条件下保存;另一部分65 ℃烘箱中烘干测定初水分,粉碎过0.425 mm筛,实验室测定养分含量。
饲粮及粪样养分测定参考杨胜[16]方法;酸不溶灰分(AIA)含量测定参照GB/T 23742—2009[17]方法。养分表观消化率按照内源指示剂法计算(每个组测定9个重复),计算公式如下:
某养分消化率(%)=100-100×(A1/A2)×(F2/F1)。
式中:A1为饲粮中的AIA含量;A2为粪中AIA含量;F1为饲粮中该养分含量;F2为粪中该养分含量。
1.4.2 小肠组织形态学及消化酶活性测定
育肥期结束后每组随机选择3头肉牛屠宰,采集十二指肠、空肠、回肠和结肠各段5 cm左右,清除内容物并用生理盐水冲洗干净,置于4%多聚甲醛中固定带回实验室测定。取出固定的小肠样品,经梯度酒精脱水,使用二甲苯透明处理,再经石蜡包埋后用切片机将组织块切成薄片,最后用苏木精-伊红(HE)染色。利用光学显微镜(日本尼康nikon eclipse E100,成像系统为日本尼康NIKON DS-U3)观察,利用扫描仪(Pannoramic 250, Pannoramic MIDI)进行图像采集分析,使用Case Viewer 软件测量切片的VL、CD及MT,并计算V/C值。
屠宰肉牛采集空肠、回肠和十二指肠食糜,分装到10 mL离心管中,立即投入液氮中带回实验室在-80 ℃冰箱保存。解冻后的食糜用冷冻离心机在4 ℃条件下10 000 r/min离心10 min,取上清液并分装,测定α-淀粉酶(微量法)、脂肪酶(微板法)和胰蛋白酶(紫外比色法)活性(北京索莱宝科技有限公司试剂盒)。
1.5 数据统计分析
采用SPSS 26.0的one-way ANOVA对养分表观消化率、肠道酶活性及组织形态学等数据进行方差分析,S-N-K法进行多重比较。分析结果用“平均值±标准差”表示,以P<0.05作为差异显著判断标准,P<0.01作为差异极显著判断标准。
2 结果与分析
2.1 荷斯坦牛及其杂种牛养分表观消化率比较
由表2可知,3类型育肥牛在各个育肥阶段干物质(DM)、有机物(OM)、粗蛋白质(CP)及中性洗涤纤维(NDF)的表观消化率有显著差异(P<0.05)。荷斯坦牛各育肥阶段DM、OM、CP和NDF表观消化率均显著高于夏杂牛和阿杂牛(P<0.05),而夏杂牛和阿杂牛各阶段养分表观消化率无显著差异(P>0.05)。多重比较表明,荷斯坦牛除育肥后期除NDF表观消化率外,DM、OM、CP和NDF表观消化率在各育肥阶段均显著或极显著高于夏杂牛(P<0.01或P<0.05);荷斯坦牛除育肥前期OM、育肥中期DM和NDF表观消化率外,DM、OM、CP和NDF表观消化率在各育肥阶段均显著或极显著高于阿杂牛(P<0.01或P<0.05)。
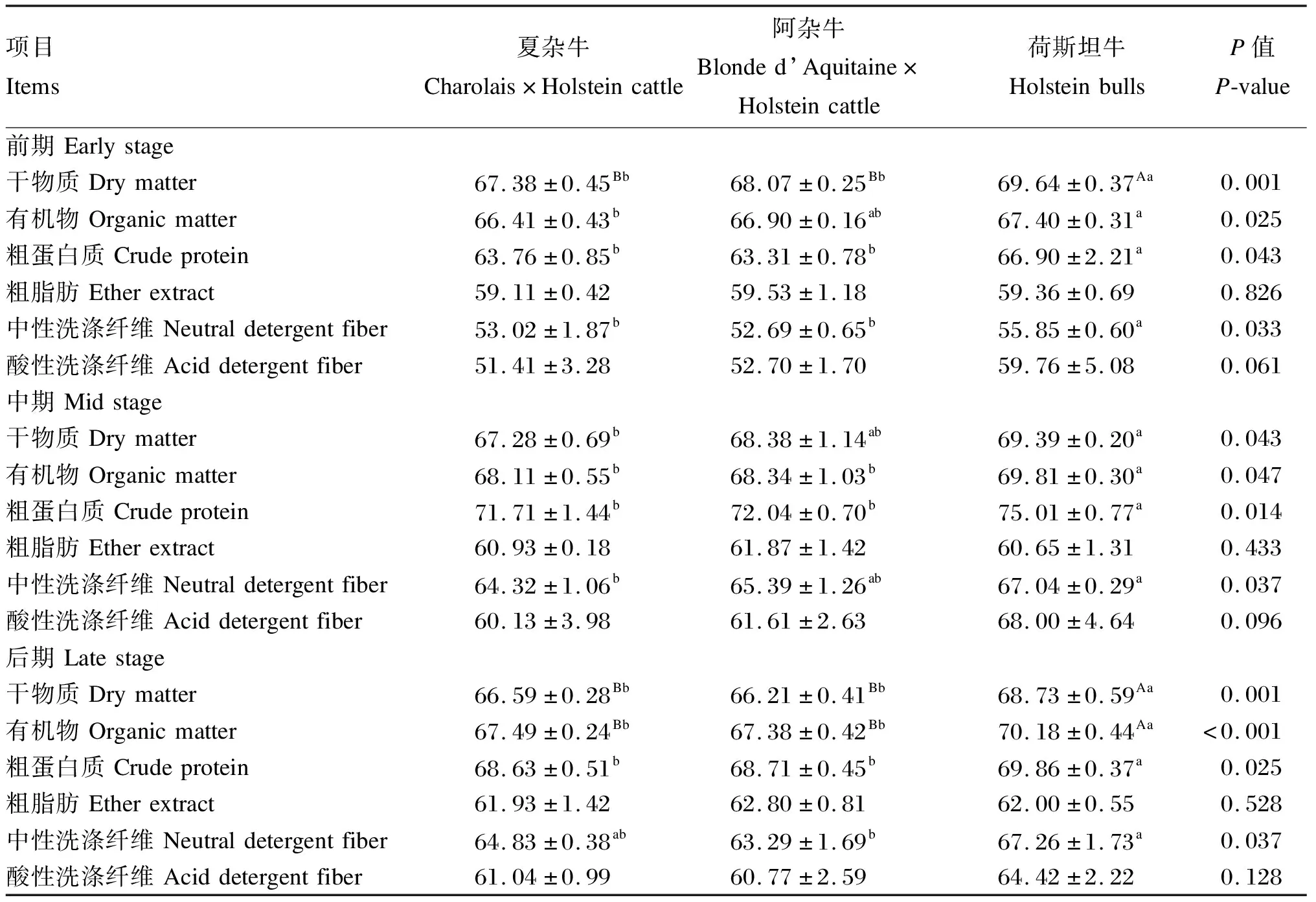
表2 荷斯坦牛及其杂种牛养分表观消化率差异分析
2.2 荷斯坦牛及其杂种牛小肠酶活性差异分析
由表3可知,荷斯坦牛小肠胰蛋白酶、脂肪酶、α-淀粉酶活性均高于夏杂牛和阿杂牛。其中荷斯坦牛和阿杂牛空肠胰蛋白酶活性极显著高于夏杂牛(P<0.01),十二指肠、空肠脂肪酶活性显著高于夏杂牛(P<0.05),空肠脂肪酶活性显著高于阿杂牛(P<0.05)。
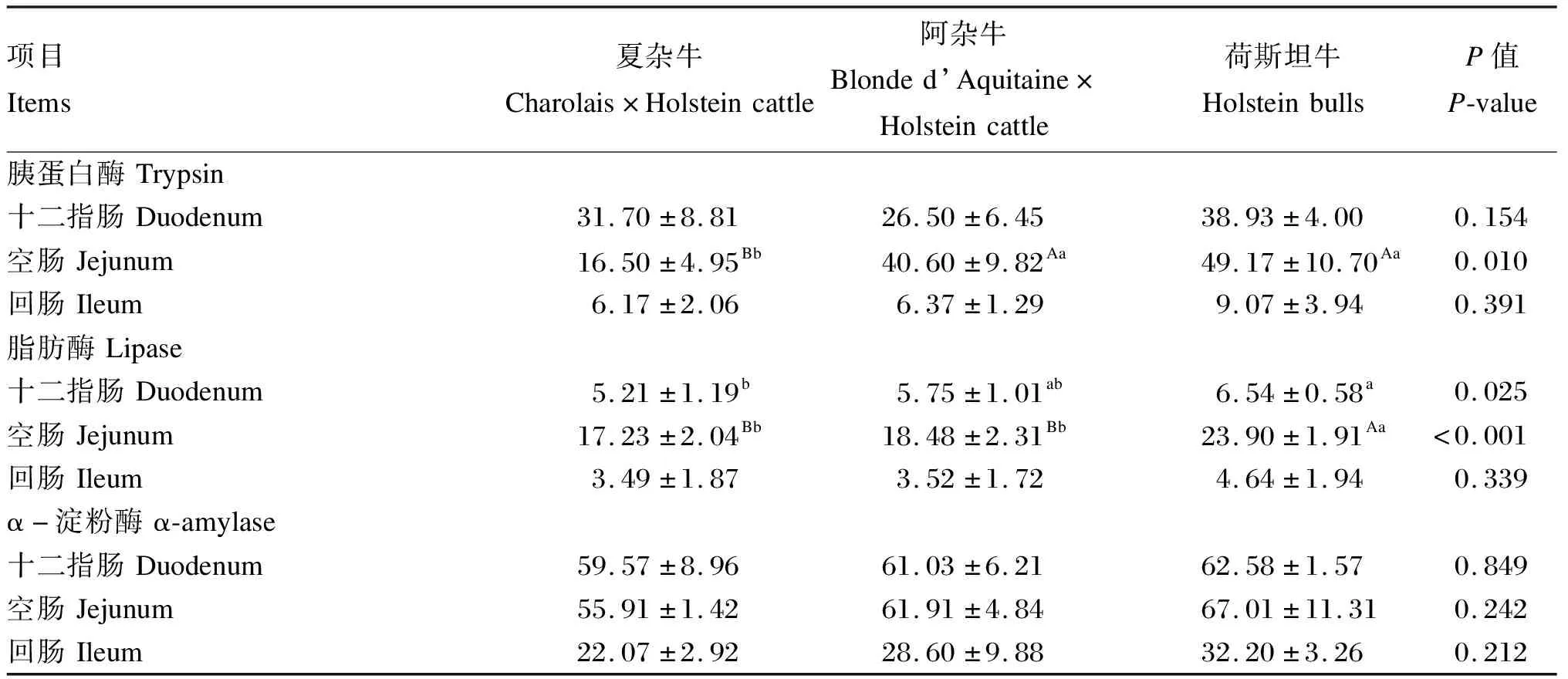
表3 荷斯坦牛及其杂种牛小肠酶活性差异分析
2.3 荷斯坦牛及其杂种牛肠道形态学差异分析
由表4可知,荷斯坦牛十二指肠、空肠和回肠VL、CD及MT最高,其中十二指肠、空肠VL极显著高于夏杂牛和阿杂牛(P<0.01),CD显著高于阿杂牛(P<0.05);荷斯坦牛3部位MT极显著高于夏杂牛和阿杂牛(P<0.01)。

表4 荷斯坦牛及其杂种牛肠道形态学差异分析
3 讨 论
3.1 荷斯坦牛及其杂种牛养分表观消化率比较
养分表观消化率是评价饲料消化特性的重要指标之一。DM表观消化率可以直接衡量机体对饲粮的利用程度,也间接反映胃肠道结构和机能发育情况[18]。NDF和ADF表观消化率反映了反刍家畜对饲粮中纤维素利用情况,如果动物对NDF水平高的饲粮表现出较高的NDF表观消化率,那么其他营养成分也会有很高消化能力[19-20]。本试验表明,荷斯坦公牛各育肥阶段DM、OM、CP和NDF的表观消化率均高于夏杂牛和阿杂牛。不同类型、性别动物的体重增长规律及体组织生长规律不尽相同,对养分吸收利用率也不同[21-22];即使动物类型、生理状态一致,其饲粮采食量、饲草料在瘤胃内停留时间、食糜流通和消化速度以及瘤胃微生物活性等因素均可影响消化率。Silva等[23]研究表明,不同品种羔羊DM、OM、NDF和ADF表观消化率不同;朱寿谦等[24]报道,高产奶牛DM、EE和NDF表观消化率显著高于低产奶牛;卢广林等[25]研究表明,利木赞、西门塔尔、夏洛莱与本地黄牛杂交的后代在相同营养水平下,养分表观消化率差异不显著;李陇平等[26]发现舍饲母牦牛OM表观消化率显著高于公牦牛,其他养分表观消化率无显著差异。养分表观消化率的高低直接影响着动物的生长性能[27],荷斯坦牛总体养分表观消化率高于夏杂牛和阿杂牛,这可能与其遗传基础有关,不同品种牛的瘤胃内环境不同,对饲料养分的消化利用不尽一致。
3.2 荷斯坦牛及其杂种牛小肠消化酶活性差异比较
与单胃动物相比,反刍动物消化生理更加复杂,营养物质先经过瘤胃发酵,后流入小肠进行化学性消化,在小肠中起消化作用的主要为各种消化酶。消化酶在机体内催化糖、脂肪和蛋白质水解,可衡量反刍动物小肠发育情况以及养分消化吸收能力[28]。小肠中消化碳水化合物的主要酶是淀粉酶,而胰蛋白酶在饲粮蛋白质消化中起重要作用。研究表明,消化酶的分泌和活性与反刍动物品种、饲料类型等有关,不同品种之间基因型的差异导致品种特质不同,因此消化酶活性也存在差异,且不同品种之间胰腺和小肠发育及小肠内环境不同,也会对消化酶活性产生影响;饲粮类型及营养成分对动物消化酶的分泌影响显著[29-31]。本试验表明,荷斯坦牛小肠胰蛋白酶、脂肪酶、α-淀粉酶活性均高于夏杂牛和阿杂牛,其中空肠胰蛋白酶,以及十二指肠、空肠的脂肪酶活性存在显著差异。刘明等[32]报道,3个绵羊品种的羔羊小肠消化酶活性存在显著差异,湖羊十二指肠脂肪酶活性显著高于滩羊,杜泊羊和湖羊空肠淀粉酶活性显著高于滩羊,湖羊回肠胰蛋白酶活性显著高于杜泊羊;陈鼎[33]研究表明,在相同饲养条件下,小尾寒羊和滩羊十二指肠脂肪酶、淀粉酶、胰蛋白酶活性没有表现出品种间的差异,但各消化酶活性在数值上各有不同;曲星梅等[34]发现,山羊消化酶分泌与饲粮营养水平有关,提高营养水平可提高消化酶活性;孙洪新[35]报道,羔羊小肠不同部位内容物中胰蛋白酶和脂肪酶活性不同,且与月龄呈正相关;张英杰等[36]研究表明,羔羊空肠内容物的α-淀粉酶活性高于十二指肠和回肠,十二指肠最低。本试验中各类型肉牛饲养条件一致,小肠消化酶活性差异主要与品种和肠道部位不同有关,荷斯坦公牛小肠胰蛋白酶、脂肪酶、α-淀粉酶活性较高,可能与其选育程度和生产方向有关;对荷斯坦牛高产奶量性状的选育,使得其代谢能力较强,因而维持能量需要比肉牛高[37],所以荷斯坦牛养分吸收优于其他肉牛。

图1 荷斯坦牛及其杂种公牛小肠形态结构差异
3.3 荷斯坦牛及其杂种牛小肠组织形态学差异比较
反刍动物进食后,饲粮首先在瘤胃内进行微生物发酵,再进入其他胃室进行消化[38],食糜经过胃的初步消化后到达小肠进一步将营养物质消化成小分子物质[39],因而小肠正常结构功能是养分充分消化与吸收的基本保证,特别是小肠VL、V/C值,是衡量小肠消化吸收功能的重要指标[40]。VL与养分吸收能力有关,VL越大表明肠上皮细胞越好[41];CD反映了绒毛细胞生成速率,隐窝变浅表明细胞成熟率上升,分泌功能增强[42];V/C值增大表明小肠消化吸收能力增强,比值减小说明肠黏膜受损,影响营养物质的消化吸收[43];小肠MT体现了小肠的收缩力强弱[44-46]。本试验中,荷斯坦牛十二指肠MT均极显著高于夏杂牛和阿杂牛,这使得荷斯坦牛小肠蠕动能力高于夏杂牛和阿杂牛,使小肠食糜与消化酶接触充分,食糜排出速度提高,消化能力也相应增强。荷斯坦牛十二指肠、空肠和回肠的VL、CD和V/C值均高于夏杂牛和阿杂牛。孙青松等[47]研究表明,不同品种肉牛小肠绒毛结构差异显著,且与其消化、吸收、生长速度、体型等指标相对应;王利民等[48]研究表明,不同品种肉牛小肠组织结构存在显著差异;宋恩亮等[49]报道,不同月龄犊牛十二指肠、空肠、回肠的黏膜厚度、MT等指标有不同程度的增加且差异极显著。综上所述,本试验饲喂条件相同,小肠组织形态学差异与品种本身种质特性有关,荷斯坦牛及其杂种牛肠道消化吸收能力不同,进而影响饲粮利用率和生长速度。
4 结 论
在相同育肥条件下,荷斯坦公牛养分表观消化率、小肠消化酶活性,以及小肠各部位VL、CD及MT均高于杂种牛,表明荷斯坦牛对养分消化吸收及代谢能力优于杂种牛。
