鸡胰岛素耐受性及血液葡萄糖稳态调节研究进展
2022-05-12王子阳
王子阳 陈 文
(河南农业大学动物科技学院,郑州 450046)
在正常情况下,人类的胰腺可根据血液葡萄糖浓度的高低分泌胰岛素来维持机体血液葡萄糖的平衡,使其空腹血液葡萄糖浓度维持在3.9~6.1 mmol/L的正常值。长期的慢性高血糖会对人体产生严重的损害。糖尿病就是一组以慢性高血糖为特征的终生代谢性疾病[1]。人类等哺乳动物存在胰岛素耐受,将导致机体出现诸如高血糖、高胰岛素血症、高血脂等异常症状[2]。鸡具有普遍的胰岛素耐受性,而且其空腹血液葡萄糖浓度长年高达8~13 mmol/L(为人类的2倍),却不像人类一样表现慢性高血糖的任何有害效应[3-4];甚至有研究显示糖尿病患者食用鸡肉可有效降低高血糖对机体的损害[5-6]。胰腺分泌的胰岛素是维持血液葡萄糖稳态的核心,鸡的慢性高血糖和胰岛素耐受特性使其成为一个研究糖尿病及其新防治法的理想模型[7-8]。因此,对鸡胰岛素耐受性及其血液葡萄糖稳态调节方式的研究,有助于解析鸡高血糖及其糖代谢机制,也可为人类糖尿病预防与治疗提供思路。
1 胰岛素抵抗
1916年Sharpey-Schaffer深入描述了胰岛可以分泌一种能够控制葡萄糖代谢的物质,并命名为胰岛素[9]。1921年Banting和Best首次分离出牛胰岛素后,人们普遍认为糖尿病完全是由于胰岛素分泌不足导致。然而,Himsworth[10]在1932年注意到糖尿病患者对胰岛素反应的变化,并认为许多糖尿病患者的决定性生化缺陷是对胰岛素不敏感,而不是胰岛素缺乏。直到1960年Yalow等[11]发现放射免疫分析法后,观察到Ⅱ型糖尿病患者的循环胰岛素水平往往高于平均水平,人们才开始重视这一结果。胰岛素耐受性亦称胰岛素抵抗,是指正常剂量的胰岛素产生低于正常生物学效应的一种状态[12-13],即组织对胰岛素的敏感性下降,代偿性引起胰岛β细胞分泌胰岛素增加,从而产生高胰岛素血症,其实质为胰岛素介导的细胞糖代谢能力的降低[14]。
2 鸡高血糖与胰岛素耐受特性
一般情况下,哺乳动物的胰岛素作用受损会增加其肝脏葡萄糖生成,降低肌肉葡萄糖摄取,并促进胰岛素敏感器官如肌肉、肝脏和脂肪中的脂质积累[15]。胰岛素在哺乳动物胰岛素敏感器官中起着重要的作用[2]。胰岛素敏感靶器官存在胰岛素抵抗,是人类糖尿病发病的关键因素,将导致人类出现如高血糖、高胰岛素血症、高血脂等异常表征,这些表征是人类Ⅱ型糖尿病和代谢综合征的共有特性[16]。
鸡与哺乳动物一样,葡萄糖能通过血流在机体的不同组织间转运,是机体的一种重要能量来源形式,但鸡似乎具有较哺乳动物更为特殊的葡萄糖代谢特性;鸡的胰岛素循环浓度与人类、大鼠等哺乳动物相似,但其血液葡萄糖浓度比哺乳动物高2倍,而且对外源胰岛素敏感性也低[17]。在鸡的胰岛素相关敏感组织,大剂量的胰岛素才能刺激葡萄糖的吸收;而如此大剂量的胰岛素对哺乳动物具致死性,因此鸡被认为具有胰岛素耐受性[18-19]。由此可见,鸡的血液葡萄糖调控方式明显不同于哺乳动物,目前尚未能很好地解析鸡的葡萄糖调控机制。
3 鸡血液葡萄糖稳态调节特性
3.1 鸡血液葡萄糖稳态调节的胰岛素信号传导通路
哺乳动物包含复杂的胰岛素信号传导通路,胰岛素磷脂酰肌醇3-激酶(phosphatidylin-ositol-3-kinase,PI3K)/丝氨酸/苏氨酸激酶(serine/threonine kinase,Akt)信号通路(图1)是其主要的胰岛素信号级联传导通路[20]。一些研究显示,鸡具有不同于哺乳动物的胰岛素信号传导通路。目前,仅胰岛素PI3K/Akt通路上的部分胰岛素信号传导分子(图1,深色标示)在鸡上得以鉴定[20-22]。鸡胰岛素的调控通路也似乎具有明显的组织特异性。鸡的肝脏组织似乎具有与哺乳动物相似的胰岛素信号传导通路,其上游胰岛素受体β(insulin receptor,IR-β)、胰岛素受体底物-1、Src同源与胶原蛋白家族(Src homology and collagen family,Shc)、PI3K的基因和下游Akt、丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)、细胞外信号调节激酶-2(extracellular signal-regulated kinase-2,ERK-2)、糖原合酶激酶-3(glycogen synthase kinase-3,GSK-3)、p70核糖体蛋白S6激酶(ribosomal protein S6 kinase,70 ku,P70S6K)以及p90核糖体蛋白S6激酶(ribosomal protein S6 kinase, 90 ku,p90S6K)的基因的调控都依次依赖于血液胰岛素浓度的改变[20]。相反,在鸡的肌肉组织,胰岛素信号级联通路中的上游基因似乎对胰岛素不敏感,呈现明显的胰岛素抵抗性,但其下游基因对胰岛素浓度十分敏感[21]。目前,关于鸡肌肉组织在机体缺乏胰岛素受体水平和上游基因表达水平变化的情况下,如何调控胰岛素信号级联通路下游基因的机制尚未知。胰岛素信号传导特性在鸡脂肪组织更为特殊,胰岛素信号通路上的所有步骤都对胰岛素不敏感,呈现明显的胰岛素抵抗[22]。Shimamoto等[23]近期的研究发现,高胰岛素浓度(1 μmol/L)刺激20 min促进了鸡脂肪细胞对葡萄糖的吸收,增加了Akt蛋白磷酸化。由此可见,胰岛素在鸡的脂肪组织和肌肉组织的信号传导方式明显不同于哺乳动物,这也使鸡成为胰岛素耐受性研究的理想模型[22]。
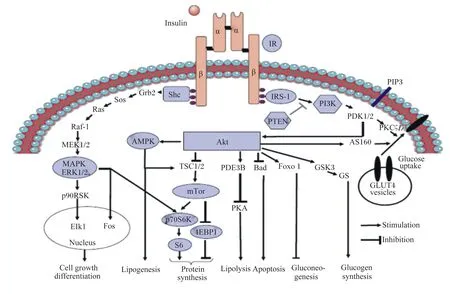
Insulin:胰岛素;IR:胰岛素受体 insulin receptor;Grb2:生长激素受体连接蛋白2 growth factor receptor binding protein-2;Sos:鸟嘌呤核苷酸交换因子 son of sevenless;Ras:Ras原癌基因 Ras proto-oncogene;Raf-1:丝苏氨酸蛋白激酶 Raf-1 proto-oncogene, serine/threonine kinase;MEK1/2:丝裂原活化蛋白激酶激酶1/2 mitogen-activated protein kinases kinase 1/2;ERK1/2:细胞外信号调节激酶1/2 extracellular signal-regulated kinase 1/2;Elk1:转录激活因子ETS样蛋白1 ETS-like 1 transcription factor;Fos:Fos原癌基因 Fos proto-oncogene;AMPK:腺苷酸活化蛋白激酶 AMP-activated protein kinase;PTEN:人第10号染色体缺失的磷酸酶 phosphatase and tensin homolog deleted on chromosome ten;PDK1/2:磷酸肌醇依赖性激酶1/2 phosphoinositide dependent kinase-1/2;PIP3:质膜固有蛋白3 plasma membrane intrinsic protein 3;PKC:蛋白激酶C protein kinase C;AS160:160 ku的丝氨酸/苏氨酸激酶底物 a 160 ku substrate of the serine/threonine kinase;TSC1/2:TSC复合体亚基1/2 TSC complex subunit 1/2;mTor:哺乳动物雷帕霉素靶蛋白 mammalian target of rapamycin;S6:蛋白质S6 protein S6;4EBP1:4E结合蛋白1 4E-binding protein 1;PDE3B:磷酸二酯酶3B phosphodiesterase 3B;PKA:环磷酸腺苷依赖性蛋白激酶 cAMP dependent protein kinase;Bad:细胞死亡的BCL2相关激动剂 BCL2 associated agonist of cell death;Foxo1:叉头盒转录因子O1 forkhead box O1;GS:糖原合酶激酶 glycogen synthase kinase;Nucleus:细胞核;Cell growth differentiation:细胞增殖分化;Lipogenesis 脂肪生成;Protein synthesis:蛋白质合成;Lipolysis:脂肪分解;Apoptosis:细胞凋亡;Gluconeogenesis:糖异生;Glucogen synthesis:葡萄糖合成;Stimulation:刺激作用;Inhibition:抑制作用;GLUT4 vesicles:GLUT4囊泡;Glucose uptake:葡萄糖摄取。
3.2 维持机体血液葡萄糖稳态的鸡葡萄糖转运体(GLUT)
骨骼肌是哺乳动物最大的胰岛素敏感器官,是从血流中摄取和利用葡萄糖的主要部位,在维持全身葡萄糖稳态中起着至关重要的作用[25-26]。关于哺乳动物食后葡萄糖的吸收调控机制已经得到了很好的鉴定。摄取血流中的葡萄糖是全身葡萄糖利用中的限速步骤,这一过程由GLUT家族调节,GLUT由溶质载体家族2亚族A(solute linked carrier family 2 subfamily A,SLC2A)基因编码[27]。至今为止,已经从哺乳动物中鉴定了14种GLUT,它们以易化扩散方式转运葡萄糖(其转运过程不消耗能量),在维持机体葡萄糖稳态上发挥着重要作用[28]。GLUT在底物特异性、分布和调节机制方面有所不同[29],根据氨基酸序列相似性可分为3类,第1类有GLUT1、GLUT2、GLUT3、GLUT4和GLUT14;第2类有GLUT5、GLUT7、GLUT9和GLUT11;第3类有GLUT6、GLUT8、GLUT10、GLUT12和GLUT13[30-32]。GLUT的表达水平和蛋白质活性对维持机体葡萄糖稳态和提供营养底物具有重要的意义[33]。而其中GLUT2和GLUT4在通过胰岛素信号通路维持哺乳动物的葡萄糖稳态上发挥着关键作用,GLUT2在胰岛β细胞中发挥着传递葡萄糖信号的作用[34];葡萄糖氧化会通过GLUT2引起胰岛分泌胰岛素[35];在肾脏,GLUT2与钠-葡萄糖协同转运蛋白2(SGLT2)参与完成了肾脏90%葡萄糖的重吸收[35]。GLUT4是哺乳动物主要的胰岛素依赖型的GLUT,优势表达于哺乳动物的骨骼肌和脂肪细胞,在胰岛素刺激下GLUT4从胞内转移到浆膜,进行葡萄糖的转运[36]。干扰GLUT4的功能可导致肥胖和糖尿病[37-38]。GLUT9是尿酸和葡萄糖的双重转运蛋白[39-40]。GLUT12可能影响生理和肥胖等病理状态下小鼠脂肪组织对葡萄糖的吸收[41]。
鸡的骨骼肌葡萄糖摄取和利用机制仍不清楚。Sweazea等[42]用GLUT抑制剂phloretin处理英国麻雀的趾总伸肌后,显著减少了其对葡萄糖的吸收,支持了“禽类肌肉组织存在功能性的GLUT”这一设想。目前人类对鸡GLUT的了解还比较碎片化。在鸡的基因组计划实施过程中,鸡的GLUT1、GLUT2、GLUT3、GLUT5、GLUT8、GLUT9得以鉴定[43]。鸡GLUT9被认为介导尿酸吸收,但其特异性的底物尚未被鉴定[44]。Coudert等[45]从鸡的骨骼肌和心肌组织中鉴定了鸡GLUT12,并发现空腹和胰岛素免疫中和均可降低鸡胸肌GLUT1、GLUT8和GLUT12基因的表达,而腿肌中只有GLUT12基因的表达受到胰岛素免疫中和的影响[46]。强胰岛素刺激增加了鸡脂肪细胞质膜上GLUT1的蛋白水平,但不影响鸡脂肪细胞质膜上GLUT12的蛋白水平[23]。目前一些鸡GLUT的精确生理功能尚未知,甚至一些GLUT的组织表达特性也还不清楚。近期有研究成功克隆了鸡GLUT13基因,并发现其在大脑和肾脏优势表达[47],并初步进行了GLUT2和GLUT12基因的表达研究[48],发现不同的GLUT基因有不同的优势表达部位,推测与其功能有关。Coudert等[45]发现鸡GLUT12基因在鸡骨骼肌中优势表达,且GLUT12基因在鸡骨骼肌中的表达受胰岛素的调节[44-45]。
4 鸡胰岛素耐受性具有品种间差异
肥胖是Ⅱ型糖尿病的主要危险因素,Ⅱ型糖尿病患病率与肥胖率呈正相关[49]。虽然肥胖导致胰岛素抵抗的机制尚不清楚,但炎症与局部和全身胰岛素抵抗的发展有关,特别是当炎症发生在白色脂肪组织时[50-51]。Sumners等[52]采用大体重肉鸡和小体重肉鸡进行胰岛素耐受性试验,发现大体重肉鸡的胰岛素敏感性受损更严重;胰腺结构特性分析表明,大体重肉鸡比小体重肉鸡的胰岛更大,但相对胰岛重更小;荧光定量PCR进行4个葡萄糖调控相关基因在胰腺组织的表达研究表明,小体重肉鸡比大体重肉鸡的表达量更高。
乌鸡较肉鸡有更强的葡萄糖耐受性和血液葡萄糖稳态调节能力[53]。多次独立的胰岛素敏感性试验均发现乌鸡具有比肉鸡更强的胰岛素耐受性和更好的血液葡萄糖恢复能力[53-55]。进一步的研究发现外源胰岛素对鸡只血清胰岛素含量的影响具有显著的品种和时间的互作效应,乌鸡展示了更强的维持血清胰岛素稳态的能力[54]。胰岛素注射使GLUT2和GLUT12基因的表达呈现明显的组织和品种依赖性变化[54],但乌鸡强胰岛素耐受性和血液葡萄糖稳态调节能力的机制尚未明确,2个品种之间血液葡萄糖稳态调节的差异可能与其基础状态下的胰腺胰岛素抵抗和空腹胰岛素浓度以及对外源性胰岛素的不同动态反应有关[48]。
5 小结与展望
随着人类科技的进步与发展以及人们对糖尿病研究的深入,糖尿病得到了较为系统的认识。然而,预防与治疗糖尿病依然存在困难。目前,鸡作为研究糖尿病及其防治新方法的理想模型,人们主要从鸡的葡萄糖调控机制来研究其血液葡萄糖稳态调节,但对鸡胰岛素信号传导通径的研究还不够深入。GLUT在哺乳动物上研究较为普遍,对其维持机体葡萄糖稳态和提供营养底物具有重要的作用,而在鸡上的精确生理功能尚不明晰。此外,乌鸡比肉鸡具有更强的胰岛素耐受性和血液葡萄糖稳态调节能力,其发生机制尚不清楚,值得进一步研究。对鸡胰岛素耐受性以及血液葡萄糖稳态调节的研究,可为进一步进行禽类葡萄糖利用的精准调控打下基础,同时也为人类糖尿病的预防和治疗提供新的视野。
