HIF-1α作用下宰后成熟初期牛肉糖酵解能力研究
2022-05-12郭雨轩师希雄郭兆斌马国源余群力
陈 骋 郭雨轩 师希雄 郭兆斌 马国源 余群力
(甘肃农业大学食品科学与工程学院,兰州 730070)
0 引言
宰后牛肉的细胞血氧供给功能中断,引起缺氧应激并迫使肌肉代谢方式从氧化转变为糖酵解,后者是宰后成熟初期影响牛肉品质变化的核心生化反应,能够在短期内为肌肉细胞供能[1]。糖酵解反应消耗肌肉中糖原产生乳酸,后者引起肌肉pH值降低进而直接影响肌肉的嫩度、色泽、保水性、风味等品质[2]。宰后成熟过程中糖酵解通量的轻微改变足以引起肌肉关键品质的变化,典型的两种异质肉(PSE肉和DFD肉)也与宰后糖酵解水平存在密切关系[3-4]。因此,揭示宰后肌肉糖酵解反应的变化机制及其调控机理,对肌肉最终品质的预测及调控具有重要意义。
糖酵解反应直接受到肌肉细胞膜糖原运载体-1(GLUT-1)、己糖激酶(HK)、磷酸果糖激酶(PFK)和丙酮酸激酶(PK)等关键因子的调控[5]。因此,上述关键调控因子的影响因素及其对宰后肌肉糖酵解的调控机制是近年来肉品科学领域的研究热点。目前,已经证实腺苷酸活化蛋白激酶(AMPK)稳定表达并通过磷酸化作用激活PFK是启动糖酵解反应的重要途径[6-7]。缺氧诱导因子-1α(HIF-1α)作为上游信号分子,在细胞缺氧应激条件下通过调节关键蛋白质表达进而启动糖酵解反应,为细胞维持正常功能提供能量[8-10]。但是,目前尚未证实宰后成熟过程中肌肉糖酵解的启动依赖于HIF-1α信号传导途径。
宰后牛肉能量代谢能力主要取决于两方面:一是宰前应激水平、宰后糖原物质含量以及肌肉内环境[4,11];二是决定糖酵解反应的关键蛋白质(GLUT-1、糖酵解酶)[5-7]。上述关键蛋白质表达受到HIF-1α调控,HIF-1α在缺氧应激时稳定表达,并且由细胞质向细胞核转移,与细胞核中缺氧诱导元件(HRE)结合,进而诱导GLUT-1和糖酵解酶的基因表达[10]。但是,宰后牛肉细胞中是否存在上述调控机制及其对牛肉糖酵解水平的影响程度尚有待研究。因此,本文以牛肉作为研究对象,通过分析对照组和抑制剂处理中HIF-1α细胞分布和表达水平,解析HIF-1α信号通路对宰后成熟初期牛肉糖酵解水平的影响机理。
1 材料与方法
1.1 材料与试剂
试验材料:饲喂条件相同、健康无病、发育正常的安格斯杂交公牛6头(36月龄、体质量(550±30)kg),甘肃康美现代农牧产业集团有限公司提供。
试验试剂:3-(5′-羟甲基-2′-呋喃基)-1-苯甲基唑(YC-1)、糖原和乳酸检测试剂盒、二喹啉甲酸(BCA)蛋白定量试剂盒,HK、PFK、PK酶活力检测试剂盒,Sigma-Aldrich公司;兔抗HIF-1α多克隆抗体、兔抗GLUT-1多克隆抗体、肌动蛋白(Actin)多克隆抗体、辣根过氧化物酶标记山羊抗兔IgG(H+L)二抗、聚偏二氟乙烯(PVDF)膜,赛默飞世尔科技(中国)有限公司;Cy3标记山羊抗兔IgG (H+L)英光二抗、牛血清白蛋白(BSA)、4′,6-二脒基-2-苯基吲哚(DAPI)荧光染色液、乙二胺四乙酸(EDTA)抗原修复液,4%多聚甲醛、自发荧光猝灭剂、抗荧光猝灭封片剂、磷酸盐平衡生理盐水(PBS),武汉塞维尔生物科技有限公司;其他化学试剂购于天津光复科技发展有限公司,均为分析纯。
1.2 仪器与设备
Nikon Eclipse C1型正置荧光显微镜,日本尼康公司;GelDoc-It310型凝胶成像系统,美国耶拿分析有限公司;170-8280型ChemiDoc MP化学发光成像系统,美国伯乐公司;RM2016型病理切片机,上海徕卡仪器有限公司;JB-P5型包埋机,武汉俊杰电子有限公司;KD-P型组织摊片机,浙江省金华市科迪仪器设备有限公司;BG-subMIDI型电泳仪,北京百晶生物技术有限公司;UV-1601型酶标仪,日本岛津公司;TGL-16M型离心机,长沙湘仪离心机仪器有限公司;UV765PC型紫外分光光度计,上海光谱仪器有限公司;FA2004B型电子天平,上海佑科仪器有限公司;XHF-D型高速分散器,宁波新芝生物科技股份有限公司;PHS-3C型pH计,上海雷磁仪器厂;微量加样器,法国吉尔森公司;JJ-2型组织捣碎匀浆机,江苏国华电器有限公司;TS-100型脱色摇床,海门其林贝尔仪器制造公司;XW-80A型旋涡混匀器,海门麒麟医用仪器厂。
1.3 试验方法
1.3.1样品采集与处理
安格斯杂交牛击晕后采用三管齐断法屠宰,以避免屠宰应激引起的糖原过度消耗。胴体进行热蒸汽减菌,并于45 min内取背最长肌,除去表面筋膜和脂肪组织并切分成200 g、厚度3 cm的肉块,将肉块随机分为对照组和HIF-1α抑制剂YC-1处理组,每组3份平行。YC-1处理组按照料液比5 g/mL注射200 μmol/L的YC-1溶液,注射时针头每隔1 cm插入肉样中心(约1.5 cm深);对照组按照相同方法注射0.9%的生理盐水。将两组样品在模拟宰后成熟条件(温度4℃、风速1.5 m/s、相对湿度85%)下,经0、6、12、24、48 h成熟,采用液氮快速冷冻后放入-80℃超低温冰箱中备用。
1.3.2HIF-1α细胞聚集和核转位检测
参考文献[12]的方法,采用单标免疫荧光法检测HIF-1α细胞聚集和核转位情况。取适量样品,采用4%多聚甲醛固定后石蜡包埋,用病理切片机进行厚度4 μm的切片,置于二甲苯浸泡30 min后依次采用无水乙醇、85%乙醇、75%乙醇和蒸馏水洗涤,采用EDTA抗原修复缓冲液(pH值8.0)在95℃条件下进行抗原修复,随后用PBS(pH值7.4)洗涤3次(每次5 min)并以3%的BSA封闭,在切片上滴加兔抗HIF-1α多克隆抗体(抗体与一抗稀释液体积比为1∶300),至于湿盒内4℃孵育12 h,用PBS(pH值7.4)洗涤3次,滴加Cy3标记山羊抗兔IgG (H+L)英光二抗(抗体与二抗稀释液体积比为1∶100),避光室温(20℃)孵育60 min,用PBS(pH值7.4)洗涤3次,滴加DAPI染色液,室温孵育10 min,再次用PBS(pH值7.4)洗涤3次,滴加自发荧光猝灭剂,静置5 min后蒸馏水冲洗,切片缓慢甩干并用抗荧光猝灭封片剂封片。采用全景切片扫描仪进行镜检拍照,细胞核经DAPI染色,在紫外激发波长330~380 nm、发射波长420 nm下呈蓝光;HIF-1α经Cy3染色,在激发波长510~560 nm、发射波长590 nm下呈红光。HIF-1α细胞聚集水平采用阳性细胞强度表示。
1.3.3HIF-1α和GLUT-1表达水平测定
采用Western blot法测定HIF-1α和GLUT-1表达水平。参考文献[2]的方法提取蛋白质,采用BCA蛋白定量试剂盒测定蛋白质浓度,采用PBS(pH值7.4)缓冲液调节蛋白质量浓度至5 mg/mL,采用SDS-PAGE(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)(5%分离胶、10%浓缩胶)分离蛋白并电泳转至PVDF膜,用5%脱脂乳粉封闭1 h,分别加入兔抗HIF-1α多克隆抗体(抗体与一抗稀释液体积比为1∶1 000)、兔抗GLUT-1多克隆抗体(抗体与一抗稀释液体积比为1∶1 000)、肌动蛋白(Actin)多克隆抗体(抗体与一抗稀释液体积比为1∶1 000),4℃摇床孵育12 h,洗涤3次后加入辣根过氧化物酶标记山羊抗兔IgG(H+L)二抗(抗体与二抗稀释液体积比为1∶500),室温避光孵育1 h并洗涤3次,ECL(增强型化学发光试剂)试剂盒化学发光。采用凝胶成像系统和化学发光系统拍照和定量,蛋白表达水平分别以目标蛋白光密度与内参蛋白光密度的比值表示。
1.3.4糖酵解限速酶活力测定
参考文献[13]的方法制备样品。取1.0 g切碎的肉样,加入9 mL浓度为10 mmol/L的提取液(80 mmol/L K2HPO4,15 mmol/L KH2PO4,25 mmol/L KCl,1.2 mol/L NaCl,pH值7.4,4℃),冰浴条件下12 000 r/min匀浆30 s,然后4℃、13 000g条件下离心15 min,取上清液。分别采用酶活力检测试剂盒测定HK、PFK和PK的酶活力。采用BCA蛋白定量试剂盒测定蛋白质浓度,酶活力单位定义:1 g组织蛋白与基质作用1 min后将1 μmol底物转化为产物,则酶活力为1 U/g。
1.3.5糖酵解水平测定
糖原含量测定:参考文献[2]的方法制备样品。取0.5 g切碎的肉样,加入1.5 mL浓度为2 mol/L的NaOH溶液,煮沸20 min后冷却,加入8 mL超纯水,在5 000g条件下离心10 min,取上清液。采用糖原检测试剂盒测定上清液中糖原含量(质量摩尔浓度),单位为μmol/g。
乳酸含量测定:参考文献[14]的方法制备样品。称取0.5 g切碎的肉样,加入4.5 mL生理盐水(4℃),冰浴条件下12 000 r/min匀浆30 s,然后在4℃、3 000g条件下离心15 min,取上清液。采用乳酸检测试剂盒测定上清液中乳酸含量(质量摩尔浓度),单位为μmol/g。
糖酵解潜力计算:参考文献[14]的方法,根据糖原和乳酸含量计算肉样糖酵解潜力,计算公式为
G=2A+B
式中G——糖酵解潜力,μmol/g
A——糖原含量,μmol/g
B——乳酸含量,μmol/g
1.3.6pH值测定
参考文献[7]的方法,采用便携式pH计测定,将探针插入肉样约2 cm处,待pH计数值信号稳定后读取数值,连续测定5次后取平均值。
1.4 数据统计与分析
试验中所有指标测定至少作3次重复,结果表示为平均值±标准偏差。采用SPSS 22.0统计软件进行单因素方差分析(ANOVA)和指标间的相关性分析,采用Duncan多重比较法进行均值间差异显著性分析(P<0.05)。采用Origin Pro 2018软件进行绘图。
2 结果与分析
2.1 HIF-1α细胞聚集和核转位
HIF-1α作为动物细胞能量代谢调节转录因子,在缺氧应激时稳定表达并直接调控GLUT-1和90%以上糖酵解酶的基因表达,进而促进细胞以糖酵解途径产生ATP以适应低氧环境[9,15]。但是,上述机制建立在HIF-1α稳定表达并向细胞核转移,与细胞核中HRE中靶基因结合的基础上[10]。采用免疫荧光标记方法测定了宰后成熟初期HIF-1α在牛肉细胞中表达聚集和核转位的情况。由图1(图中*表示差异显著,P<0.05)可以看出,宰后成熟0 h时YC-1处理组与对照组的阳性细胞强度和细胞聚情况相似。随着宰后成熟时间延长,对照组中HIF-1α阳性细胞强度明显升高,在6~48 h分别是YC-1处理组的1.97、2.37、1.44、1.40倍(P<0.05),表明宰后成熟初期HIF-1α在牛肉细胞中表达并稳定聚集,专一性抑制剂YC-1能够显著抑制HIF-1α积累。此外,从图1的免疫荧光图像可以看出,对照组中HIF-1α在细胞质中表达聚集,并且向细胞核发生转移(图中箭头所示),而在YC-1处理组中HIF-1α的核转位现象不明显。HIF-1α稳定表达受到上游信号途径影响,牛肉宰后成熟过程中HIF-1α的稳定积累可能与肌肉中产生的活性氧(ROS)有关,缺氧条件下H2O2为主的ROS信号分子能够迅速激活磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号通路,后者通过激活哺乳动物雷帕霉素(mTOR)表达而促进HIF-1α与HRE结合,激活HRE中GLUT-1、糖酵解限速酶等关键蛋白质基因表达[10]。而文献[16-17]证实牛肉和羊肉宰后成熟过程中产生的大量H2O2具备信号分子功能,可能通过上述途径促进HIF-1α的表达。此外,文献[14]研究发现猪肉HIF-1α表达水平能够引起宰后成熟期间肌肉中糖酵解限速酶活力显著变化,进而直接影响猪肉糖酵解速率。因此,本研究宰后成熟初期检测到HIF-1α在细胞中表达并向细胞核转移聚集,具备了调节下游糖酵解相关蛋白质基因表达的前提条件。
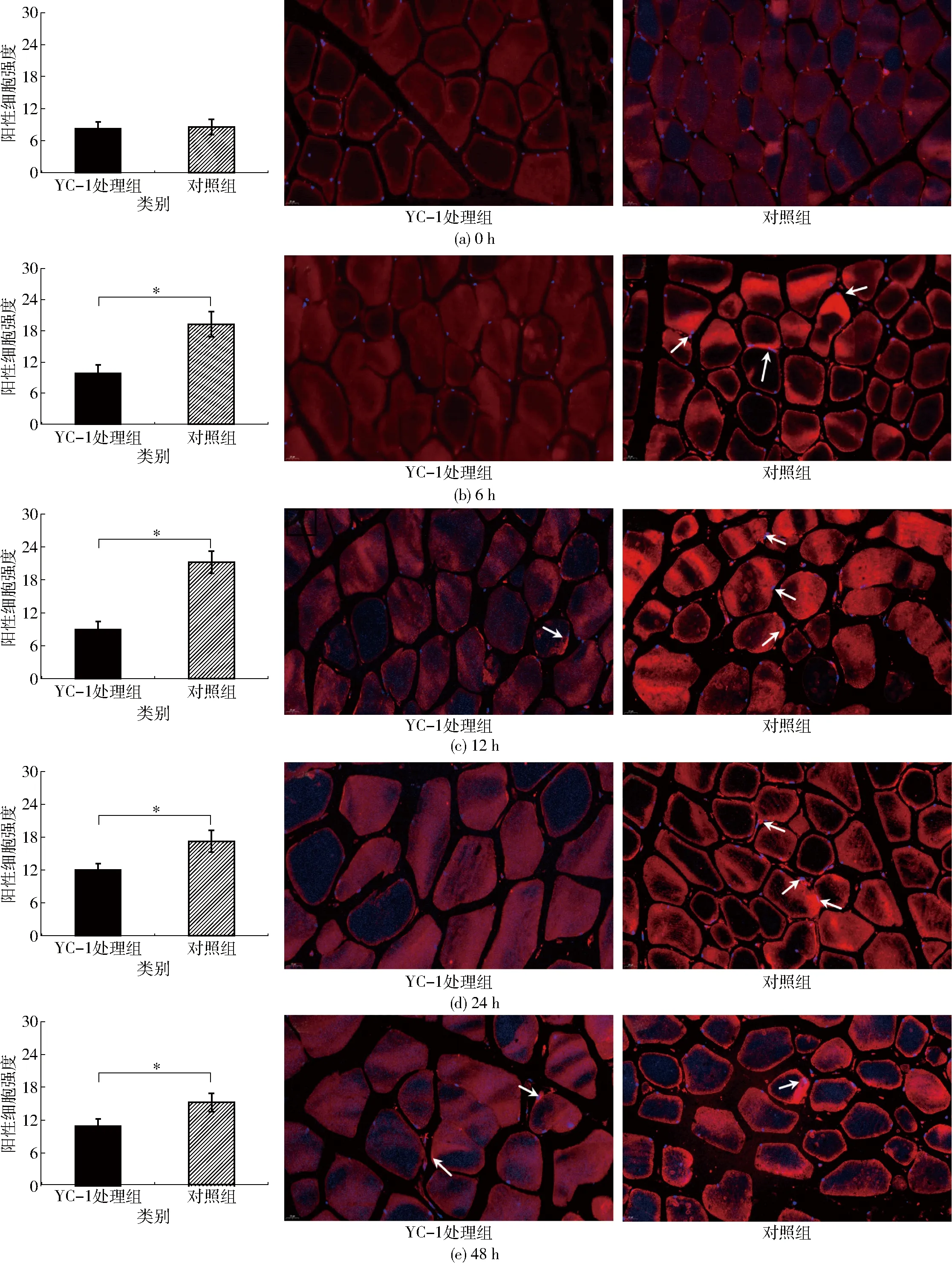
图1 宰后成熟过程中牛肉细胞HIF-1α聚集和核转位情况变化(放大倍数为500倍)Fig.1 Changes of cellular aggregation and nuclear translocation of HIF-1α in bovine muscle during postmortem aging (magnified for 500 times)
2.2 HIF-1α和GLUT-1表达水平
采用蛋白质免疫进一步测定HIF-1α及其对糖酵解关键蛋白质GLUT-1表达水平的影响。由图2(图中不同大小写字母分别表示同一处理组在不同成熟时间点指标差异显著,*表示不同处理组在相同成熟时间点指标差异显著,P<0.05,下同)可以看出,两组样品中HIF-1α蛋白表达水平在0 h无显著性差异,对照组HIF-1α蛋白表达水平在0~48 h内呈现先升高后降低的变化趋势,在6 h达到最大值,表达量相对于0 h显著升高了1.20倍(P<0.05),在24 h开始出现显著降低(P<0.05)。YC-1处理组中HIF-1α蛋白表达水平除6 h外总体未表现出显著差异。对照组HIF-1α蛋白表达水平在6~48 h分别是YC-1处理组的2.89、4.01、1.92、1.40倍(P<0.05)。该研究结果与图1(图中红色标记为HIF-1α,蓝色标记为细胞核)显示的结果一致,进一步证实了宰后成熟初期HIF-1α在牛肉细胞中迅速积累。
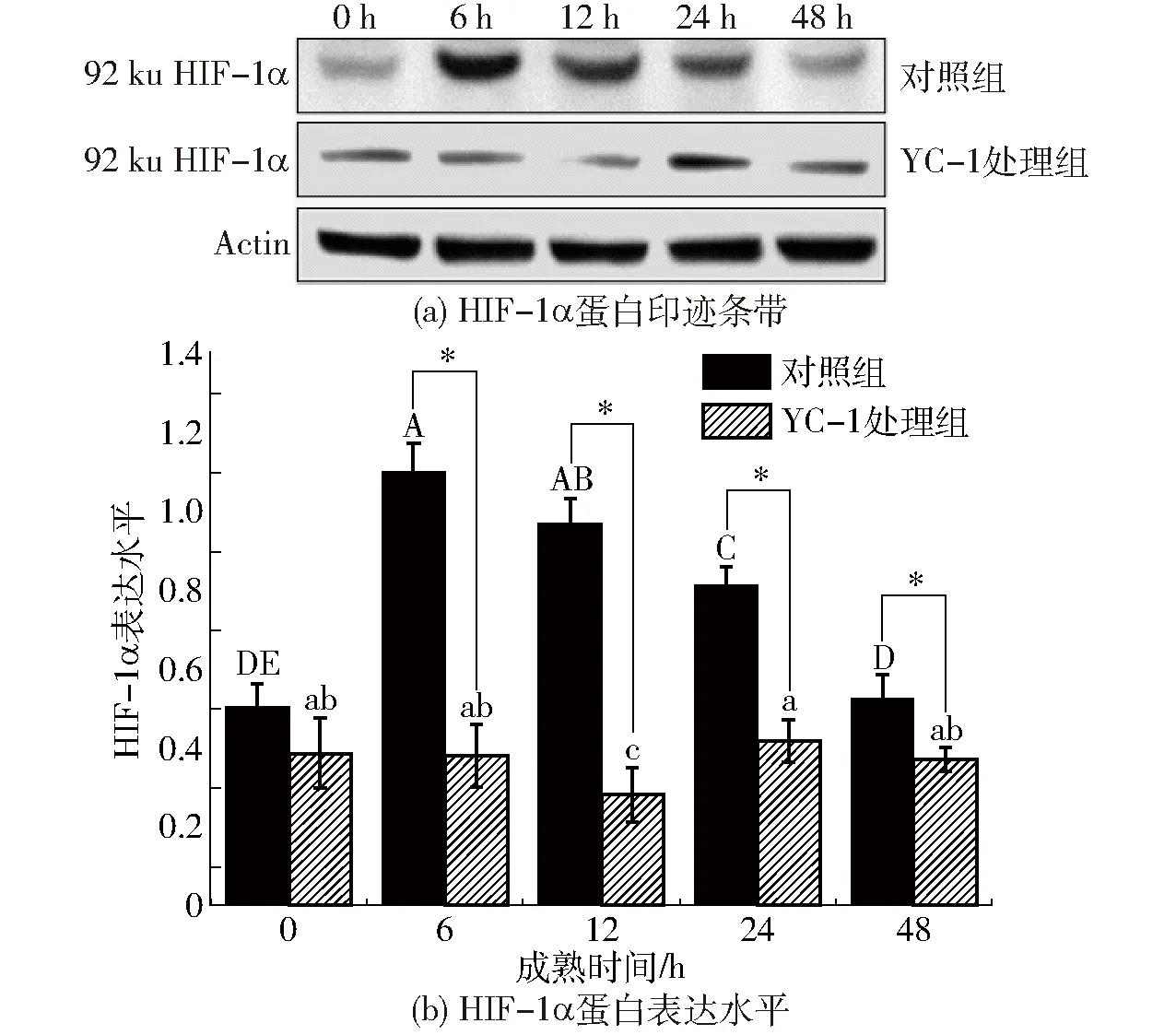
图2 宰后成熟过程中牛肉HIF-1α蛋白表达水平变化Fig.2 Changes of HIF-1α expression levels in bovine muscle during postmortem aging
GLUT-1作为HIF-1α通路中的下游靶蛋白,在糖酵解反应中发挥转运底物糖原的重要作用,是糖酵解酶以外能够直接影响糖酵解能力的关键蛋白质[18]。由图3可以看出,GLUT-1蛋白表达水平与HIF-1α呈现相似的变化趋势。对照组中GLUT-1蛋白表达水平在6 h达到最大水平,表达量相比于0 h显著升高了1.91倍(P<0.05),从12 h开始出现显著降低(P<0.05)。对照组中GLUT-1蛋白表达水平在6~24 h分别是YC-1处理组的3.78、1.71、1.5倍(P<0.05)。此外,YC-1处理组中GLUT-1蛋白表达水平在12~48 h出现显著升高趋势(P<0.05),这可能是由YC-1组中少量表达的HIF-1α对其的激活作用所致。由此可见,宰后成熟初期牛肉中HIF-1α积累能够激活糖酵解关键蛋白质GLUT-1的表达。在细胞缺氧应激状态下,GLUT-1表达上调能够显著增加细胞对葡萄糖的摄取,通过增加糖酵解通量来维持细胞能量供给,提升细胞的低氧适应性[9]。文献[18]发现缺氧条件下HIF-1α激活位于细胞核HRE中的GLUT-1基因序列,后者稳定表达并转移至细胞膜中将葡萄糖跨膜转运至细胞内,保障了糖酵解反应的底物供应。
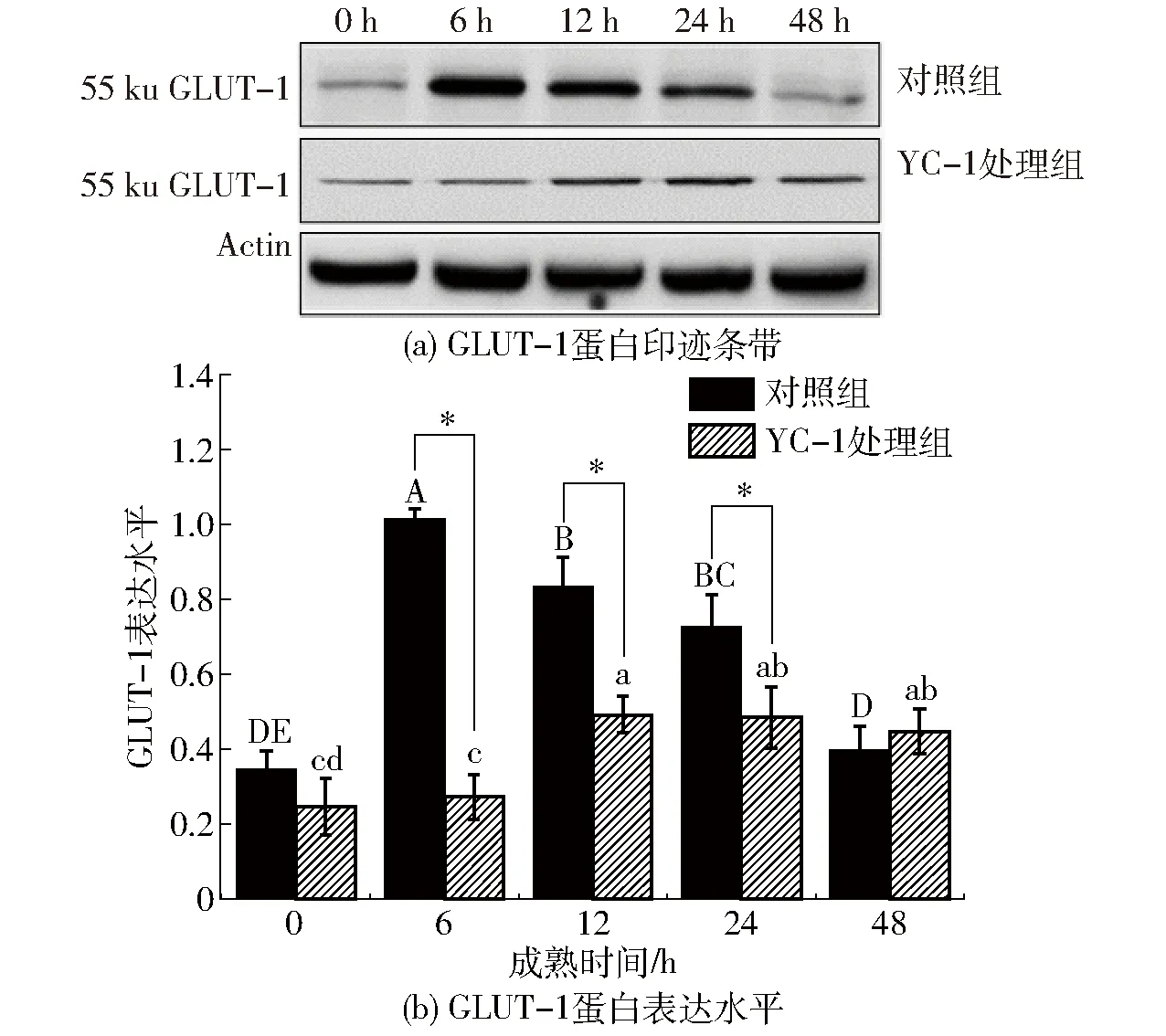
图3 宰后成熟过程中牛肉GLUT-1蛋白表达水平变化Fig.3 Changes of GLUT-1 expression levels in bovine muscle during postmortem aging
2.3 糖酵解限速酶活力
宰后成熟过程中肌肉糖酵解能力受多种因素的影响,其中HK、PFK和PK这3种限速酶是影响宰后动物肌肉糖酵解能力的关键因素[5-7]。由图4可以看出,宰后成熟初期对照组中HK酶活力在0~12 h出现显著升高的趋势(P<0.05),YC-1处理组中HK酶活力在相同时间段内差异不显著,两组样品HK酶活力在12 h后均显著降低(P<0.05)。对照组中HK酶活力在成熟6 h和12 h时升高到197.43 U/g和195.87 U/g(P<0.05),分别是YC-1组的1.14倍和1.08倍(P<0.05)。PFK酶活力变化与HK相似,对照组中PFK酶活力同样在0~12 h出现显著升高(P<0.05),而相同时间段内YC-1处理组中PFK的酶活力变化不显著,两组中PFK酶活力在12 h后均出现显著降低(P<0.05)。对照组中PFK酶活力在6 h和12 h时分别升高到25.77 U/g和27.33 U/g(P<0.05),且在6~24 h内分别是YC-1处理组的1.29、1.33、1.22倍(P<0.05)。两组样品PK酶活力未表现出明显差异,但随着成熟时间延长呈现显著降低的趋势(P<0.05)。由相关性分析结果(表1)可以看出,对照组中HIF-1α在正常表达的情况下表达水平与HK和PFK酶活力呈显著正相关(P<0.05),且相关系数分别达到0.838和0.929,而采用YC-1抑制宰后成熟初期HIF-1α的表达后,HIF-1α表达水平与糖酵解限速酶活力未呈现显著的相关性。上述结果进一步证实宰后成熟初期HIF-1α积累能够提升HK和PFK酶活力。
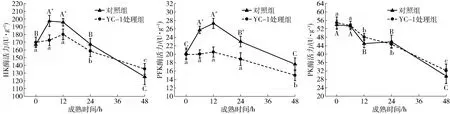
图4 宰后成熟过程中牛肉糖酵解限速酶活力变化曲线Fig.4 Changes of glycolysis rate-limiting enzyme activity in bovine muscle during postmortem aging
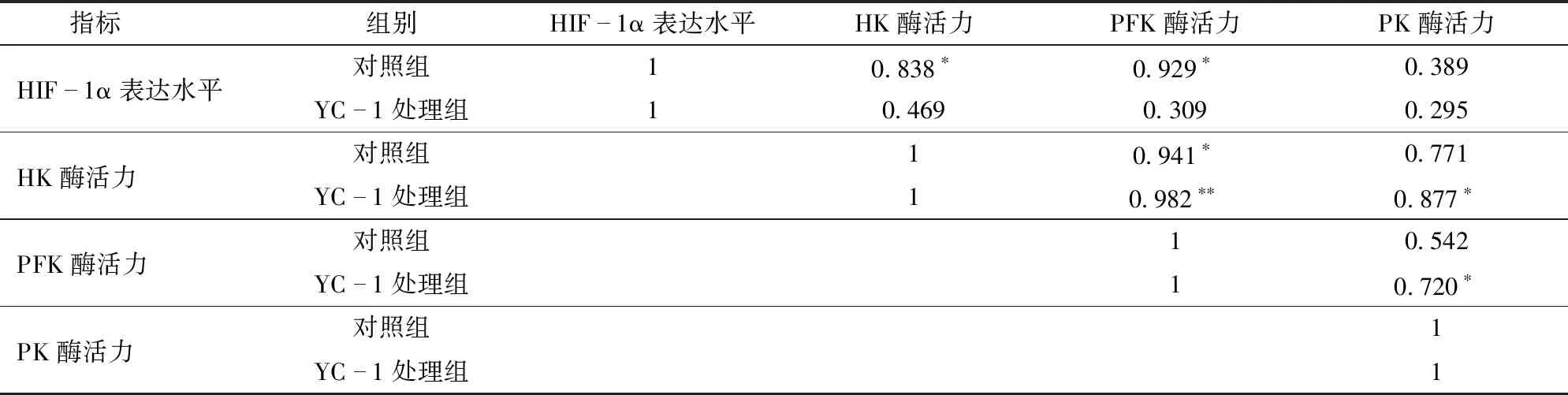
表1 宰后成熟过程中牛肉HIF-1α表达水平与糖酵解限速酶活力的相关性分析Tab.1 Correlation analysis of HIF-1α expression levels and glycolysis rate-limiting enzyme activity in bovine muscle during postmortem aging
文献[19]发现猪肉宰后在不同条件下贮藏时表现出较高的糖酵解水平,其HK酶活力在冷藏(4℃)和冰温贮藏(-1℃)初期(0.5~6 h)均显著升高,并且与猪肉乳酸含量相关系数达到了0.806(P<0.05),而PFK和PK酶活力在贮藏初期也均处于相对较高水平。近期相关研究也发现应激条件能够上调鸡肉中HK、PFK、乳酸脱氢酶(LDH)等糖酵解酶的基因表达途径,从而提升酶活力和糖酵解能力[20-22]。缺氧应激状态下,细胞中HIF-1α信号通路能够激活90%以上的糖酵解酶[9],本研究发现对照组中HIF-1α表达水平与HK和PFK酶活力显著正相关(P<0.05),而当HIF-1α表达受到抑制后与糖酵解酶活力未呈现显著相关性,一方面证实宰后成熟初期牛肉中HK和PFK酶活力升高可能是HIF-1α在缺氧应激条件下大量积累的结果,另一方面也说明HIF-1α对糖酵解限速酶活力的调控作用主要表现在宰后成熟的初期,随着成熟时间延长,酶活力可能受到其他内环境因素的影响。此外,文献[23]发现细胞糖酵解代谢途径中,GLUT-1表达上调与HK酶活力升高伴随出现,在提升细胞葡萄糖转运和代谢过程中发挥着重要作用,本研究也发现在相同时间段内GLUT-1蛋白表达水平与HK酶活力存在相同的变化趋势。由此可见,牛肉宰后成熟初期HIF-1α通路在GLUT-1表达和HK、PFK激活中发挥重要作用。
2.4 糖酵解水平
为进一步探究HIF-1α对牛肉成熟期间糖酵解水平的影响,对样品糖原和乳酸含量进行测定。由图5可以看出,两组样品糖原含量随着成熟时间延长均呈现显著降低的趋势,成熟48 h内对照组和YC-1处理组糖原含量分别降低至0 h的19%和43%(P<0.05),并且对照组糖原含量在6~48 h始终显著低于YC-1处理组(P<0.05)。样品乳酸含量变化与糖原含量变化呈对应关系,两组样品乳酸含量随着成熟时间延长均显著升高,对照组和YC-1处理组分别在成熟24 h和48 h达到最高水平,相对于0 h时分别升高2.44倍和1.89倍(P<0.05),并且对照组乳酸含量在6~48 h显著高于YC-1处理组(P<0.05)。以上结果表明,相对较高的HIF-1α表达水平下,牛肉成熟期间相应表现出显著较高的糖原分解和乳酸积累速率。采用糖酵解潜力指标进行总体评价(如图6所示),两组样品糖酵解潜力表现出不同的变化趋势,对照组糖酵解潜力呈现先升高后降低的变化趋势,在成熟0~12 h显著升高1.10倍(P<0.05),在12 h后糖酵解潜力显著降低(P<0.05)。YC-1处理组在成熟0~24 h内变化不显著,24~48 h内出现显著降低(P<0.05)。对照组糖酵解潜力在成熟6~24 h内始终保持显著较高的水平(P<0.05)。对照组在成熟6~24 h内HIF-1α、GLUT-1表达水平和HK、PFK酶活力均处于显著较高的水平,这些因素可能是导致牛肉糖酵解潜力显著提升的主要原因。

图5 宰后成熟过程中牛肉糖原和乳酸含量变化曲线Fig.5 Changes of glycogen and lactate contents in bovine muscle during postmortem aging
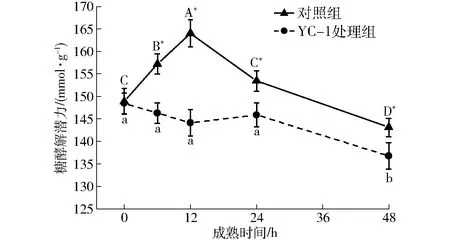
图6 宰后成熟过程中牛肉糖酵解潜力变化曲线Fig.6 Changes of glycolytic potential in bovine muscle during postmortem aging
目前,肉类科学领域的研究尚未明确解释宰后成熟过程中动物肌肉中HIF-1α调控糖酵解反应的具体机制,但医学领域的研究已经证实HIF-1α在低氧状态下通过激活GLUT-1和糖酵解酶基因表达的通路激活糖酵解为细胞供能[9]。文献[10]发现对血管内皮细胞HIF-1α进行基因沉默处理后,细胞糖酵解酶活力和葡萄糖摄取能力出现显著降低,同时检测到糖酵解酶的表达水平下降。而文献[24]研究发现HIF-1α稳定剂二甲氧乙二酰甘氨(DMOG)能够显著提升HIF-1α表达水平并且加快细胞糖酵解速率。此外,文献[25]发现在缺氧状态下细胞中HIF-1α的半衰期从30 min延长至2~4 h,有助于其自身积累并诱导糖酵解酶等关键蛋白质表达,保障细胞在缺氧状态下保持较高的糖酵解能力。本研究中也发现对照组中HIF-1α在成熟0~6 h显著积累且在6~24 h内保持显著较高水平,从而使牛肉糖酵解潜力在0~12 h迅速提升,这与之前GLUT-1蛋白表达水平和HK、PFK酶活力变化规律相吻合。因此,牛肉宰后成熟初期HIF-1α积累并通过调控下游糖酵解关键蛋白质表达,对提升牛肉糖酵解能力起着重要作用。
2.5 pH值
作为评价牛肉品质的重要指标之一,pH值与肌原纤维蛋白质降解、细胞凋亡、高铁肌红蛋白还原系统等一系列生化途径存在密切联系,直接影响肌肉嫩度、保水性、色泽、风味等关键品质的形成[2,26]。宰后成熟过程中糖酵解反应的速率和程度是影响pH值变化的决定因素[27]。由图7可以看出,两组样品pH值在0 h无显著差异,但随着成熟时间延长均显著降低(P<0.05)。对照组和YC-1处理组的pH值分别在0~12 h和2~24 h出现显著降低(P<0.05),且对照组的pH值在6~24 h内显著低于YC-1处理组(P<0.05)。两组样品的极限pH值(pHu值)分别为5.51和5.71,均处于正常水平范围内,但是对照组达到pHu值所用时间比YC-1处理组提前了12 h,这与对照组显著较高的糖酵解能力存在密切联系。糖酵解反应启动后,肌肉中糖原首先分解为葡萄糖,葡萄糖经过酶促反应转变为乳酸,生成的ATP为细胞供能的同时乳酸迅速积累并导致肌肉pH值降低[28],而上述过程中GLUT-1和糖酵解酶的酶活力受到上游HIF-1α的调控[9,15]。本研究中对照组HIF-1α表达水平在宰后初期(0~6 h)显著上调,并在之后的6~24 h分别表现出显著较高的GLUT-1表达水平、HK和PFK酶活力、糖酵解潜力以及显著较快的pH值下降速率,说明在宰后成熟初期HIF-1α作为上游调控因子,通过诱导下游关键蛋白质表达和活化部分限速酶的途径加速糖酵解,从而引起pH值降低快速降低。但是,随着成熟时间延长,肌肉中糖原的大量消耗,且限速酶活力受到pH值的抑制,最终导致糖酵解潜力下降[29-30],这也解释了本研究中两组样品中糖酵解限速酶活力、糖酵解潜力随着成熟时间延长而降低。

图7 宰后成熟过程中牛肉pH值变化曲线Fig.7 Changes of pH values in bovine muscle during postmortem aging
3 结束语
宰后成熟初期HIF-1α在细胞中迅速表达积累并向细胞核转移,一方面调控细胞中葡萄糖转运关键蛋白质GLUT-1表达上调,保障糖酵解底物糖原的供应,另一方面诱导糖酵解限速酶HK和PFK酶活力升高,有利于提升糖酵解反应速率。在上述调控机制作用下,宰后成熟初期牛肉糖酵解潜力显著升高,糖原迅速消耗、乳酸大量积累,促使牛肉pH值在短期内快速下降并达到pHu值。同时,由于pH值降低后对糖酵解酶活力的抑制作用以及糖原的大量消耗,糖酵解潜力随着成熟时间延长而显著降低,使HIF-1α对宰后成熟过程中牛肉糖酵解能力的调控作用表现出局限性。此外,采用YC-1抑制HIF-1α表达后,能够干扰HIF-1α及其下游关键蛋白质对牛肉糖酵解进程的调控作用,进一步证实HIF-1α信号通路是提升牛肉糖酵解能力重要途径。
