寻找“更好”的疫苗
2022-05-12王姗姗
王姗姗
复星医药引进的mRNA新冠疫苗2021年在港澳台地区销售了2200万剂。
当疫苗成为全球各国对抗新冠疫情最重要的保护屏障,mRNA(messenger RNA,信使核糖核酸)这个极其专业的生物医学名词,开始在公众话题中高频出现,尽管普通人并非真的清楚这种疫苗起效的原理。
2020年12月,辉瑞和Moderna各自开发的mRNA新冠疫苗先后获得美国FDA的“紧急使用授权”批准,并于2021年8月获得FDA的全面上市批准。新冠疫情的到来让mRNA技术至少提前5至10年进入市场,并将疫苗从生物制品时代迅速带到化学制品时代。
除去斩获生物医药界最大IPO的Moderna,mRNA疫苗相关概念的创业公司也在飞速发展,争取上市机会。在中国,近两年出现了十余家深入这个领域探索mRNA疫苗的公司。
这些公司的一个显著共性就是“非常年轻”。目前国内自主研发新冠mRNA疫苗并已处于临床试验阶段的企业有3家,其中进展最快的艾博生物和珠海丽凡达公司皆成立于2019年,另一家在老挝进入II期临床试验的斯微生物则创立于2016 年。
一位在医药产业有20年从业经历的制药人感慨,他从未在业内见过成长如此之快的一批公司—无论是研发进展、公司估值,还是产品申请注册的速度。
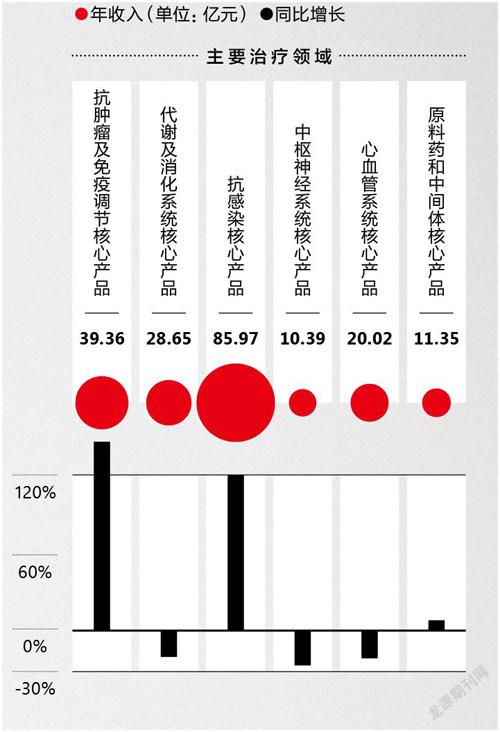
复星医药2021年主要治疗领域核心产品销售收入情况
抗感染核心产品在复星医药制药板块总收入中的占比变比
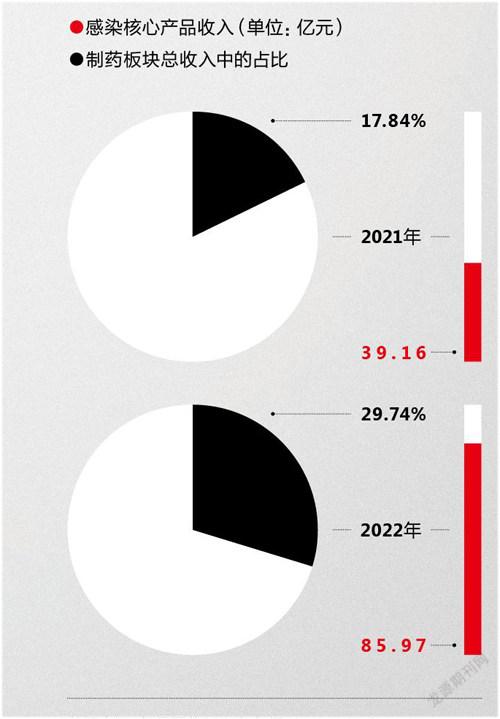
数据来源:复星医药2021年年报
当下,面对传染力更强的奥密克戎毒株,新冠疫苗的接种价值被提升到一个前所未有的高度。特别是以基因技术为载体的核酸疫苗(mRNA疫苗和DNA疫苗)被视为未来走向开放的解药。
在公众认知中,复星医药从BioNTech引进的mRNA疫苗“复必泰”在所有候选者中最为瞩目。外界一度认为,鉴于BioNTech与辉瑞合作的mRNA疫苗在欧美投入使用后已证明了有效性和安全性,复必泰应该会是“最有可能首批在国内上市”的直接引进类型的mRNA疫苗。但事实并没有这么简单,国家相关监管机构没有为复必泰的上市注册申请开绿灯。
最先冲过“获批上市”这道终点线的mR NA疫苗,极有可能是一家经过两年多筹备、依靠自主研发路径一路闯关的中国公司。如果从“新冠核酸疫苗”的范畴来看,艾博生物的mRNA疫苗以及艾棣维欣的DNA疫苗都已经走到了三期临床阶段,是距离上市注册申请最近的两个产品。
“当时不知道新冠会流行多久,也不知道它的市场空间和价值有多大。最直接的动力并不是来自于很明确的市场预期,而是说借助疫情的暴发和对疫苗的需求,去突破一些新的技术。”艾棣维欣执行董事张璐楠对《第一财经》杂志说。在新冠疫情之前,艾棣维欣的疫苗研发项目针对的是会引发肺部和呼吸道感染的呼吸道合胞病毒(RSV),这也是全球在肺炎疫苗领域最关注的品种之一。但彼时国内并没有一套针对DNA疫苗人体临床试验的标准体系可用以考核产品的有效性和安全性,所以企业只能摸着石头过河。有利的条件在于,新冠疫情在武汉最先被发现,因此早期中国对疫苗的研发条件也相对最为充分。
部分中国企业研发及生产mRNA新冠疫苗的进展

过去两年,国家药品监督管理局(NMPA)仅公开批复了3家企业的mRNA新冠疫苗和1家DNA新冠疫苗进入临床试验。但今年4月上旬,国内两家制药上市公司—石药集团和康希诺生物接连发布公告,宣布其新冠mRNA疫苗研发获得NMPA的临床试验批件(IND)。外界很容易将监管机构对新冠疫苗审批的提速,与3月以来全国多地暴发的奥密克戎疫情联系到一 起。
4月中旬,国药北京生物、武汉生物和北京科兴生物的3款国产新冠奥密克戎株灭活疫苗,也各自宣布已在香港获批开展临床试验。由此可见,要应对汹涌袭来的变异株,事关寻找“更好的疫苗”的竞赛仍未结束。
复必泰悬而未决
3月22日,身背“疫苗股”标签已两年有余的复星医药发布2021年全年财报。在当日举行的线上业绩说明会上,与复星发言人一贯的论调相同,复星国际执行董事、联席CEO陈启宇继续表示复必泰的审批工作“一直在积极的沟通反馈交流之 中”。
按照复星医药董事长兼C EO吴以芳的公开说法,早在2020年1月武汉因发现不明肺炎而被迫封城的當天,复星就决定要为这场疫情寻找“最好的疫苗”。同年3月,复星医药公告称,将向BioNTech支付至多8500万美元的许可费,获授权在中国内地及港澳台独家开发、商业化BioNTech的mRNA新冠疫苗。
2020年11月13日,复星公告称其引进的mRNA疫苗获中国国家药品监督管理局临床试验批准。根据复星医药对外发布的一份新闻稿,其mRNA疫苗于中国江苏泰州和涟水开展的是II期临床试验。
根据2020年12月复星医药公告的“合作进展”,复星计划在2021年向BioNTech订购1亿剂mRNA新冠疫苗向中国内地市场投放。根据双方的供货协议,复星在2020年年底向BioNTech支付1.25亿欧元的首付款,该款项为购买首批5000万剂疫苗所需费用的一半。
然而直到公司披露2021年年报,复必泰在中国内地的研发进展仍然为“II期临床”。
复必泰在2021年3月被纳入港澳地区政府接种计划,并于9月在中国台湾地区开展接种。据复星医药2021年年报披露,复必泰在上述三地区实现销售约2200万剂,一举成为复星医药2021年销售收入超过10亿元的三个单品之一,外界由此也窥见新冠疫苗生意蕴含的巨大收益。
涉及mRNA疫苗研发的中国公司融资情况

资料来源:根据公开资料整理 *相关轮次属于常规融资,并非仅针对疫苗项目
2021年复星医药的营收同比增长28.7%,录得390.05亿元,医药制造板块的收入占比高达74.10%。其中,包含复必泰在内的“抗感染核心产品”的收入为85.97亿元,同比增长119.54%,在整个制药板块的收入占比从去年的17.84%跃升至逼近30%。复必泰无疑是这一变化背后最为重要的业绩贡献产品。
疫苗是一门to G 生意—只卖给政府和疾控中心,民众所打的每一针疫苗都在疾控中心的记录和监管之下。所以就市场前景而言,只要渠道稳定,疫苗生意比一般的药品更好做。相较于港澳台地区,内地显然是个更大的市场,因此复星医药也绝不会轻言放 弃。
3月29日,在上海发布《上海市全力抗疫助企业促发展的若干政策措施》中,上海市政府表示将“支持新冠病毒疫苗和治疗药物进口。”此前,辉瑞的新冠口服药已经获批紧急进入中国,并在上海、吉林使用。这一在特殊时期发布的区域政策,再度被解读为放行复必泰的信号,毕竟留待行政审批、迟迟没有定论的进口疫苗,目前就只有复必泰。
摸着石头过河
mR NA的两大关键技术,一个是对mRNA的改造,一个是递送系统。有人曾比喻,拥有mRNA技术平台就像拥有一个咖啡机(mRNA改造)和咖啡杯(递送系统),正如咖啡机可以根据需求制作出不同的咖啡产品并用咖啡杯承载。从理论上来讲,mRNA药企基于上述两项技术,可以通过数据库构建出任何蛋白疗法,针对各种不同的病症—只要注入mR NA,让人体生产相关的细胞抗原,就可以诱导免疫细胞应答,进而将病毒细胞一网打尽。
在新冠疫情出现之前,mRNA作为一种较新的疫苗技术,首先被用于探索对癌症的治疗方案。
BioNTech此前主打针对肿瘤的疫苗研发。2016年,李航文从美国回国成立斯微生物,前三年的业务重心也是肿瘤疫苗的研究,同期,公司从MERS(中东呼吸综合症)和流感疫苗开始,启动针对传染病领域的相关布局。
“新冠疫情暴发后,我们看到这是一个全球范围内的流行病,就把一部分研发人员转向研究新冠疫苗。里面递送系统、免疫的修饰,甚至包括药品的生产质量管理规范,基本上都是相通的。”斯微生物CTO沈海法对《第一财经》杂志说。
“你们采用的delivery是什么?”这是mRNA领域的创业者只要与同行或投资人见面就会被问到的问题,因为大多数想要开发mRNA疫苗的公司都绕不开LNP专利。这里的“delivery”指的是将mRNA递送到合适位置的药物系统,它会决定mRNA的工作效率。目前,LNP的专利源头掌握在加拿大的Arbutus公司手中。事实上,即使是Moderna这样的公司,也只是通过二次授权获得LNP递送技术,冒着或多或少的专利纠纷风险。
去年12月,Moderna在与Arbutus的专利诉讼案中败诉,专利之争仍然围绕最为核心的LNP专利许可。这也意味着,Moderna在之后可能需要向Arbutus支付一部分专利许可费,让渡部分销售收益。
斯微生物在2017年获得了沈海法发明的递送系统专利LPP(Lipopolyplex)的技术授权,从而绕开了LNP,不用担心被相关专利纠纷引发的“断供”卡脖子。
2018年,在上海市长海医院,斯微完成了第一例肿瘤疫苗的人体给药试验,这被创始人李航文视为里程碑式的事件,因为很多年轻人正是在那段时间被斯微的mRNA研发进展所吸引,选择加入公司,甚至他们中有些人的毕业论文写的就是mRNA技术,算是国内较早进入这个领域的一批研发人才。
2020年1月武汉暴发新冠疫情后,包括几大头部疫苗厂商在内的一批有实力的生物技术企业在1月底被紧急召集至北京,参加由科技部主持的一场有关新冠疫苗的交流讨论。在这次会议中,针对疫苗初步定立了5条技术路线,其中就包括mRNA。
李航文对《第一财经》杂志回忆,整个团队在2020年从春节一直忙到国庆才第一次有机会放假休整。2021年第一代疫苗拿到临床批件。过去两年间,新冠毒株先后经历从英国株、南非株到德尔塔和奥密克戎等多代变异。斯微生物随即展开对二代疫苗的研发,目标是要找到面对病毒变异能够“以不变应成萬变”的疫苗方案。因为应对变异株,疫苗的设计一旦出现重大变更,就需要重新申请临床批件。
目前,斯微生物的二代mRNA新冠疫苗还在为获得临床批件努力。两年过去了,这家创业公司的规模已经从2020年年初的六七十人扩充至600多人,并在2021年获得2亿美元的融资。
针对传染性更强的奥密克戎毒株,已经有多家疫苗生产商针对变异株重新设计序列,制造出加强疫苗,单独申请临床批件。
今年4月石药集团和康希诺均宣布,其获得IND的新冠mRNA疫苗带有广谱性,试图用于对抗多种新冠变异株。一位不愿具名的疫苗业内人士向《第一财经》杂志分析指出,这两家企业能迅速获批临床,表明国家对于这一批广谱性的疫苗寄予厚望。但在灭活疫苗以外,从临床试验的进展来看,目前正积极孵化的新疫苗入市仍需时间。
作为目前国内唯一一家临床试验新冠DNA疫苗的公司,艾棣维欣正在全球8个国家同时展开III期临床试验。这也是整个临床试验最关键的环节,它跟I期和II期的区别在于这一轮必须要在疫区—也就是疫情高发地区组织大量未接种疫苗人群—完成相关的试验。
此前,中国靠“动态清零”政策一直稳定控制着疫情蔓延,所以很少能找到符合III期临床条件的地区,这让进展到该阶段的疫苗企业陷入一种尴尬局面。
“这也是企业遇到的一个问题,如果不能在中国做临床试验的话,就只能去海外国家寻找临床机会,但那样就不再具备主场优势了。”一位参与新冠疫苗研发的企业负责人对《第一财经》杂志表示。
竞赛的终点
目前全国的新冠疫苗接种已经超过33亿剂次,覆盖90%以上人群。今年2月,国内已经批准在灭活疫苗的基础上做序贯接种—完成全程接种灭活疫苗的人群,可以选择智飞的重组蛋白疫苗或者康希诺的腺病毒载体疫苗,序贯加强免疫。
从免疫学的角度,同一种疫苗打的次数多了,免疫系統可能会对疫苗钝化,这时候需要别的技术路线的疫苗来加强。“所以很可能会出现第二次序贯、第三次序贯,最终会把各个技术路线的疫苗都轮番加强免疫,起到增强效果的作用。”张璐楠表示,各国批准和推荐序贯接种被新一代疫苗开发者们视为他们最好的机会,“不同的技术路线,可以对人体的免疫系统产生不同角度的激活,是一个必要的补 充。”
正如很多生物制药上市企业会在涉及新药研发或引进进展的公告中反复提到的“风险提示”—“根据目前国内关于疫苗产品的审批要求,在研疫苗产品需完成临床前研究、临床试验批准、临床I期、II期和/或III期试验、上市批准、生产设施认证/核查等主要环节方可上市。疫苗产品的上市周期普遍较长。”

艾棣维欣在苏州建成的DNA核酸疫苗生产线。
按照正常的疫苗研发流程,从研发到提交上市审批,通常需要8到10年。实验室和动物环节的临床前研究就会花费3到6年,临床试验还会花费几年,用来持续观察疫苗的有效性和安全性。但是新冠疫苗的开发,显然等不了这么久。
国内2020年以来针对各类新冠疫苗的研发周期,已压缩至一到两年就能进入I期至III期临床,是一个很大的突破。
研发提速背后一个很大的推动力,在于紧急状况下审批模式的改变。国家药监局原来执行的统一评审,在2020年后一度被优化为滚动评审—要递交的材料并没有变化,但是疫苗研发企业不需要一次性提交完整的申请文件,而是可以按研发成果和审批进程逐步提交已经准备好的申报资料。
选对产研方向展开临床试验的同时,疫苗研发企业还要照顾到另一端—打通产业链上下游资源、让合作方愿意接受相关技术从而实现规模化生产。这是一个从疫苗设计、设备制造到配方和原料,再到生产工艺的多方联动过程,需要企业具备平台级能力,而原料供应和工艺上的优化目前仍然是限制疫苗产能的主要原因。
“之前原料都是从国外买回来,现在我们是从寻找原辅料这些底层环节开始,一点点往上做。”一位mRNA新药研发公司的CEO说。
辉瑞公司的发言人Sharon Castillo曾表示,辉瑞的mRNA疫苗生产涉及全球19个国家和地区的86个供应商,一共包括280种成分,需要配备极为专业的设备和人员,同时还涉及全球供应和制造网络之间复杂的技术转让,即使是开放专利,也难以临摹。
从实验室里的小规模生产转向工业化的大规模制造,考验的是企业的质量把控能力。“生产难的地方在于,首先要保证每一个批次的品质是一致的,这是最基本的要求。在此基础上,工艺是否能稳定地大规模产出。在大规模生产的状态下,每一个参数的细小变动,对产出来讲都会是巨大影响。”张璐楠说。如果没有达到质量控制的标准,整个批次的疫苗都会作废处理。
可以看到,国内现阶段正在推进的十几个mRNA新冠疫苗项目,其运作实体的名单上常常出现的是“双打选手”—艾博生物&沃森生物、瑞科生物&瑞吉生物、锐博生物&阿格纳生物……这样的组合中,往往一家负责底层技术研发,另一家则承担工业化生产的任务,同时也要不断优化生产工艺和确保原材料的稳定供应。当然,也有部分企业会通过收购直接获得生产线和供应链能力。
在这些企业围绕“谁能最快拿到疫苗上市批准许可”而展开的新技术竞赛中,新冠疫苗不应是终点。“口碑做好的背后,是对整个体系和平台的检验。未来再做别的产品,就有更多的优势。”在李航文看来,同行在这场比赛中所付出的努力,实际上也是在共同构建一个产业的生态圈。
