血清PG、G-17在进展期胃癌患者XELOX新辅助化疗中的监测意义
2022-05-11胡磊张寅刚
胡磊 张寅刚
胃癌是消化系统最常见的恶性肿瘤之一,多数患者在就诊时已处于进展期,因此术前新辅助化疗作为进展期胃癌的治疗就显得尤为重要[1]。在基层医院,XELOX 方案因为便宜、副作用少和安全方便而常为广大临床工作者纳为一线方案[2]。在临床实践中,常以腹部增强CT 来评估胃癌的化疗前后的分期及疗效,血清胃蛋白酶原(pepsinogen,PG)、胃泌素-17(gastrin-17,G-17)作为胃黏膜的血清学活检指标,与胃癌的发生发展预后复发等具有高度相关性[3]。因此,本次研究监测血清PG、G-17 在进展期胃癌XELOX 新辅助化疗期间的波动,评估其应用价值。
1 资料与方法
1.1 一般资料 选择2015 年1 月至2021 年6 月在浙江大学医学院附属邵逸夫医院德清院区接受完整新辅助化疗的进展期胃腺癌患者50 例,其中男性31 例、女性19 例;年龄39~80 岁,平均(57.24±5.33)岁。其中胃窦部35 例、胃体部15 例;Ⅱ期30 例、Ⅲ期20 例;所有患者经胃镜活检及影像学检查明确诊断为进展期胃腺癌,参照第8版AJCC 分期标准,分期为ⅡA~ⅢC,有手术机会者;Kamofsky评分≥70 分,自愿行XELOX 新辅助化疗。并剔除:①早期胃癌患者及发生远处转移不能一起切除者;②有较大穿孔及胃癌出血等急腹症风险者;③合并严重心肝肾等疾病不能耐受化疗者;④治疗依从性差者;⑤有化疗禁忌证或未完整接受新辅助化疗疗程者。所有患者患者均签署知情同意书。
1.2 方法 所有患者均接受XELOX 新辅助化疗方案治疗。第1 天,奥沙利铂注射针130 mg/m2加入5%葡萄糖500 ml 持续静脉滴注2 h;第1~14 天,卡培他滨片1 000 mg/m2口服,每日2 次,21 d 为1 个化疗周期,完成2 个周期治疗评定疗效,并对化疗期间的并发症予以对症处理。
1.3 观察指标 所有患者新辅助化疗前后晨起采集空腹静脉血10 ml,采用酶联免疫吸附法检测血清PGⅠ、PGⅡ、G-17 含量。分别于新辅助化疗前一天和2 个周期新辅助化疗1 周后进行腹部增强CT 检查。肿瘤效果评价以实体肿瘤疗效评价(response evaluation criteria in solid tumors,RECIST)1.1 为评价标准。缓解(complete response,CR):所有病灶消失;部分缓解(partial remisson,PR):病灶明显缩小,面积超过50%,无新病灶出现;疾病稳定(stable disease,SD):病灶缩小不足50%,或病灶增大不超过25%,无新发病灶;疾病进展(progression disease,PD):病灶增大超过25%,并出现新的病灶。比较不同疗效组间的血清PGⅠ、PGⅡ、PGⅠ/PGⅡ、G-17的变化。
1.4 统计学方法 采用SPSS 21.0 软件进行统计处理。计量资料采用均数±标准差(±s) 表示,组间比较采用单因素方差分析和配对t检验。四组之间采用Bonferroni 校正多重比较检验。设P<0.05 为差异有统计学意义。
2 结果
2.1 化疗前后血清PGⅠ、PGⅡ、PGⅠ/PGⅡ、G-17比较见表1

表1 化疗前后血清PGⅠ、PGⅡ、PGⅠ/PGⅡ、G-17比较
由表1 可见,化疗后PGⅠ、PGⅠ/PGⅡ、G-17 与化疗前比较,差异均有统计学意义(t分别=7.01、4.85、3.31,P均<0.05);化疗前后的PGⅡ比较,差异无统计学意义(t=1.06,P>0.05)。
2.2 患者治疗情况 化疗后根据肿瘤效果评价,CR 4 例、PR 23 例、SD 21 例、PD 2 例。不同疗效组间的血清PGⅠ、PGⅡ、PGⅠ/PGⅡ、G-17 变化见表2。
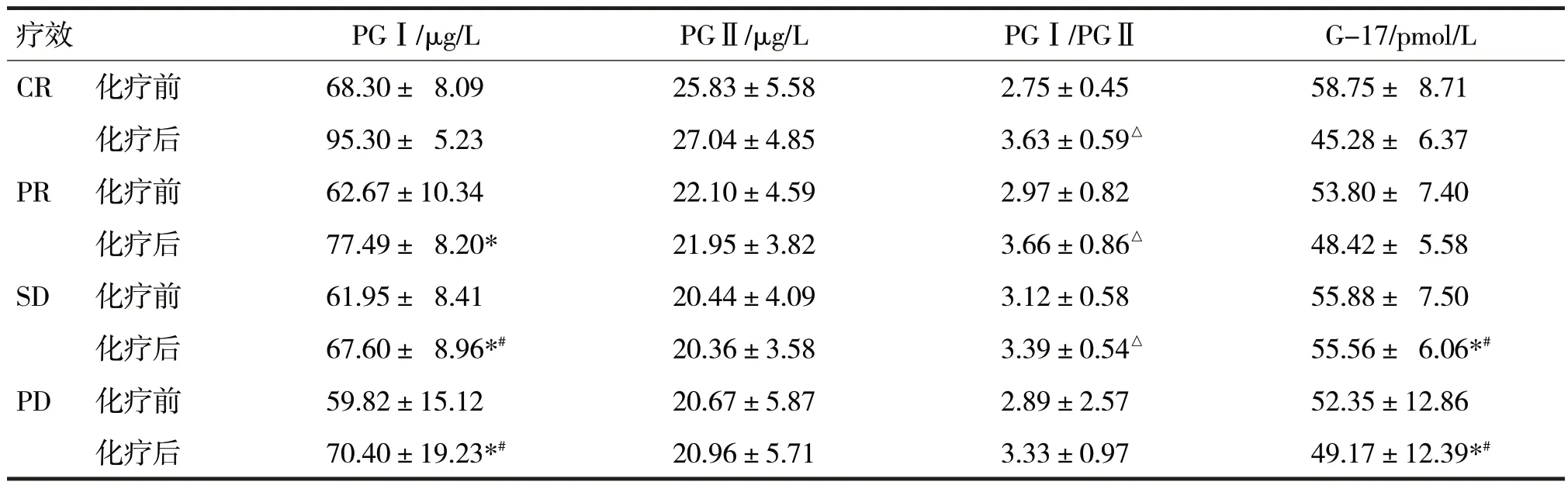
表2 不同疗效组间的血清PGⅠ、PGⅡ、PGⅠ/PGⅡ、G-17变化
由表2 可见,各组治疗前PGⅠ、PGⅡ、PGⅠ/PGⅡ和G-17 水平比较,差异均无统计学意义(F分别=0.82、2.33、0.46、1.29,P均>0.05)。化疗后CR、PR、SD、PD 不同组别之间的血清PGⅠ、PGⅠ/PGⅡ和G-17 水平比较,差异均有统计学意义(F分别=19.49、3.92、8.83,P均<0.05)。同时两两比较,PR组、SD 组、PD 组的PGⅠ水平均低于CR 组(t分别=3.85、5.94、6.35,P均<0.05),SD 组和PD 组的PGⅠ水平低于PR 组(t分别=3.84、4.64,P均<0.05);CR组、PR 组、SD 组的PGⅠ/PGⅡ均高于PD 组(t分别=-2.79、-3.34、-2.82,P均<0.05);SD 组、PD 组的G-17 均高于CR 组和PR 组(t分别=-3.13、-3.30、-3.93、-3.17,P均<0.05);四组之间的PGⅡ比较,差异无统计学意义(F=0.43,P>0.05)。
3 讨论
国内所有恶性肿瘤中,胃癌的发病率居第二位,病死率居第三位[1]。由于胃癌早期症状无特异性,患者早期诊断相对困难,导致我国有超过90%的患者在就诊时已处于进展期,早期胃癌患者不足10%[4]。新辅助化疗+评估+手术+辅助化疗是临床上应用治疗胃癌最有效、常用的方式。新辅助化疗既能在术前有效地减少肿瘤负荷,缩小控制淋巴结转移,使其与周围组织边界清晰,提高R0 切除率而改善患者预后;也能在术后结合免疫组化及基因诊断,指导选择辅助化疗方案。胃癌新辅助化疗方案多样,XELOX 方案因为便宜、副作用少和安全方便而被广泛应用。临床上常以腹部增强CT 兼顾内镜下病理肿瘤退缩分级来评估胃癌的新化疗前后的分期和效果[2,5],而血清免疫学方面则以癌胚抗原、糖类抗原199、糖类抗原50、糖类抗原724 等为代表来监测疗效,但准确性、特异性、敏感性均不高。在评估与检测的补充方案上,康运凯等[3]注意到血清PG、G-17作为胃黏膜的血清学活检指标,能特异性反映胃黏膜的功能及状态,在胃癌的各个发展阶段所均有所不同,与胃癌的发生发展、预后复发等具有高度相关性。PG、G-17 作为常用监测胃黏膜功能的指标,从胃正常黏膜-慢性萎缩性胃炎-癌前病变-癌变的进程中,表现为在胃癌的癌前病变与胃癌阶段即出现一定程度的下降[6,7]。
在既往相关研究的基础上,结合本院的临床实践,对50 例进展期胃癌患者行新辅助化疗,依据RECIST1.1 对其化疗效果进行评价,发现PGⅠ在CR、PR 组中较SD、PD 组明显升高,且CR 组高于PR组(P均<0.05),发现随着疗效的变好,PGⅠ的水平亦会随着化疗效果的变好而出现升高趋势。尤其PD 组中癌细胞出现的浸润性生长,侵袭破坏胃黏膜细胞,使PGⅠ水平下降更为明显。分析原因可能是XELOX 方案新辅助化疗消灭部分胃黏膜肿瘤细胞,肿瘤细胞退缩,中央区形成瘢痕,瘢痕周围新生胃黏膜而分泌PGⅠ。与李世杰等[8]研究结果一致。同时在本次研究中,化疗前后PGⅡ在各组中水平未见明显差异(P>0.05),主要原因可能是PGⅡ的分泌细胞分布较PGⅠ广泛,虽然也存在着因为化疗效果所导致的胃肿瘤细胞减少或增多的可能,胃黏膜新生细胞分泌PGⅡ亦会出现增多或减少的可能,但因PGⅡ基数太大而未见明显变化。但在PGⅠ/PGⅡ的变化上,则出现了CR、PR、SD 组指标均高于PD组,因此,PGⅠ较PGⅠ/PGⅡ更能敏感地反映CR、PR、SD、PD 各组中差异。这可能与在胃癌侵袭行生长过程中,PGⅠ、PG Ⅱ的降低也使原癌及侵袭基因表达上调,新辅助化疗对其有抑制作用,同时参与原癌基因的调节,抑制了胃癌的发生发展与侵袭转移[9]。因此,通过PGⅠ、PGⅠ/PGⅡ的测定不仅能反映胃黏膜非肿瘤细胞腺体和细胞的数量,为判断胃黏膜非肿瘤细胞的形态和功能状态提供依据,还在一定程度上直观地展现出新辅助化疗中原癌及侵袭基因的表达变化情况。
同时本次研究在分析G-17 的数值变化情况中,发现SD 组高于CR、PR 组,PD 高于CR、PR 组(P均<0.05),总体呈现化疗后肿瘤细胞减少与G-17下降呈正相关的趋势。G-17 主要由胃窦及十二指肠、空肠上段的G细胞分泌的胃肠激素,其活性物质以α-酰胺化胃泌素为主,占80%~90%。α-酰胺化胃泌素过度分泌会上调Wnt-β-catenin 通路,激活如C-myc 等原癌基因,使细胞恶变[10],同时调控基质金属蛋白酶、环氧酶等下游因子来参与、调控胃癌的发生与进展。有研究也显示胃泌素以剂量依赖的方式增强胃癌细胞分泌多种基质金属蛋白酶的能力,而基质金属蛋白酶家族是胃泌素促进胃癌细胞在体外迁移和侵袭导致化疗效果不佳的重要因素[11]。在胃癌的病理状态下,肿瘤细胞会分泌大量G-17,G-17 通过反馈上述多种通路来调节细胞膜黏附性,进而对肿瘤的侵袭及转移产生影响,间接也证实了G-17 可以作为进展期胃癌新辅助化疗监测疗效的有效指标。郭玉华等[12]对107 例老年进展期胃癌患者行XELOX辅助化疗,出现胃黏膜功能恢复,PGⅠ升高,G17 下降的情况,这也与本次研究所得结果基本一致。
综上所述,患者血清中PGⅠ、PGⅡ、PGⅠ/PGⅡ和G-17 均能在一定程度上反映出进展期胃癌患者XELOX 新辅助化疗前后的疗效情况,其中PGⅠ和G-17是新辅助化疗效果的独立监测因素,可作为疗效评价的有效血清学参考指标。由于本次研究的样本量有限,存在一定的局限性,在以后的研究中需要扩大样本量并进行相应的深入研究确定诊断界限值。
