右美托咪定联合脉搏压变异度监测在缺血型烟雾病血管搭桥术中的应用
2022-05-11胡丽君金伟郝静许华晔孙玉娥
胡丽君,金伟,郝静,许华晔,孙玉娥
近年来随着医学诊疗技术的不断提高,烟雾病(moyamoya disease,MMD)手术患者日益增加。MMD是一种遗传相关的具有地域差异化的脑血管疾病,目前外科脑血管重建术是治疗此类患者唯一明确有效的方法[1-2]。然而,脑血管重建手术难度较大,加上MMD患者脑部供血系统本身不足,术后极易并发脑梗、脑高灌注综合征等并发症,严重影响预后,对患者家庭及社会造成沉重的经济负担。因此,寻找较为理想的麻醉方案,提高患者恢复质量,改善预后,是目前临床麻醉医师所面临的重点问题。本研究回顾性分析2017年6月—2019年12月南京大学医学院附属鼓楼医院由同一神经外科主任医师操作的90例择期缺血型MMD行颅内-颅外血管搭桥术患者的临床资料,旨在评价右美托咪定联合脉搏压变异度(pulse pressure variability,PPV)监测在缺血型MMD搭桥术中应用效果,为提高临床缺血型MMD手术患者预后提供新思路。
1 资料与方法
1.1 一般资料 共纳入90例择期缺血型MMD行颅内-颅外血管搭桥术的患者,其中男51例,女39例;年龄45~60岁,平均年龄(53.9±4.3)岁。纳入标准:(1)手术方式均为以颞浅动脉-大脑中动脉搭桥术为核心的低流量颅内外血管重建术,并辅以脑硬膜动脉血管通融术;(2)BMI 21~28 kg/m2,ASA Ⅱ或Ⅲ级。排除标准:(1)有严重的心血管系统、呼吸系统、内分泌系统疾病;(2)有高血压病、心律失常疾病史;(3)有精神心理疾病或脑血管意外病史;(4)右美托咪定使用禁忌症者。所有患者随机数字表法分为对照组(C组)、右美托咪定处理组(S组)和右美托咪定联合PPV监测组(P组)。本研究获得南京大学医学院附属鼓楼医院伦理委员会批准(编号:2019-166-01)及签署患者知情同意书。
1.2 本量计算 采用两组比较的样本量计算公式N=[(Zα/2+Zβ)σ/δ]2(Q1-1+Q2-1),其中α= 0.05,β=0.2,Q1、Q2均取值0.5,依据预试验结果进行σ、δ取值,计算样本量为81例,预设脱落率10%,最终取90例。
1.3 处理方法 所有患者均无病房术前用药,术前禁食8 h、禁饮4 h,开放静脉通路后入手术室,入室后常规采用飞利浦多功能监测仪连续监测HR、SpO2、BP、ECG,并局麻下行桡动脉穿刺置管监测有创动脉血压。S组及P组患者麻醉诱导前10 min静脉泵注右美托咪定0.8 μg/kg,麻醉诱导后持续静脉泵注右美托咪定0.2 μg/kg/h直至手术结束前30 min。C组患者麻醉诱导前及术中泵注同等剂量的生理盐水,麻醉诱导后予以股静脉穿刺置管。围术期为了保证脑的足够灌注,维持有创动脉收缩压(systolic blood pressure,SBP)范围为:160 mmHg>SBP >140 mmHg,其中C组和S组,术中根据补液4-2-1法则,结合患者血压、心率和尿量等经验进行容量管理;P组根据PPV监测容量管理,维持 PPV在3%~7%范围内;两组患者液体输注比例为晶(复方氯化钠溶液):胶(羟乙基淀粉130/0.4氯化钠注射液)= 2∶1。若SBP低于设定值30%,予以静脉给予去甲肾上腺素4 μg或持续静脉泵注去甲肾上腺素200 μg/mL/h,随SBP变化调节泵注速度,若SBP高于设定值30%,停用去甲肾上腺素并据情况静脉给予亚宁定25 mg,当HR低于50次/分时,静脉给予阿托品0.5 mg。
1.4 麻醉方法 全麻诱导方案:咪达唑仑0.05 mg/kg、依托咪酯0.3 mg/kg、芬太尼5 μg/kg、维库溴铵0.15 mg/kg,气管内插管,接麻醉机进行机械通气,潮气量设定为8~10 mL/kg、呼吸频率12次/分,吸呼比I/E为1∶2,呼吸末二氧化碳分压(PetCO2)维持在35~40 mmHg;麻醉维持方案:微量泵静注丙泊酚4~10 mg/kg/h、瑞芬太尼 0.5~1.0 μg/kg/min、顺式阿曲库铵0.2 mg/kg/h。术中维持脑电双频指数(bispectral index,BIS)值在40~60范围内。手术结束前30 min停用肌松药,手术结束前停用丙泊酚、瑞芬太尼并追加芬太尼0.15 mg,并静脉给予昻丹司琼8 mg。术毕将患者送入神经外科监护室,符合气管导管拔管指征后拔除气管导管。术后第1 d常规行头颅核磁共振MRI和单光子发射计算机断层成像术(single-photon emission computed tomography,SPECT)扫描检查,判断有无新发脑梗、高灌注综合征影像征象。脑高灌注综合征判断依据:(1)临床上表现为头痛、癫发作、意识障碍,出现局灶性神经功能缺损;(2)术后第1 d在MRI上没有任何额外的缺血性病变;(3)SPECT定量测定术后同侧半球的局部脑血流量(regional cerebral blood flow,rCBF)增加超过对侧半球。
1.5 观察指标 记录患者入室时(T0)、气管导管插管后5 min(T1)、手术开始切皮即刻(T2)、硬脑膜切开即刻(T3)、硬脑膜切开后1 h(T4)、硬脑膜关闭即刻(T5)、手术结束即刻(T6)时的HR、SBP、MAP、PPV及SjvO2,并记录患者术中液体输入总量、尿量、出血量、去甲肾上腺素使用比例及总量、术后意识恢复时间和气管导管拔管时间,计算收缩压变异度(systolic pressure variability,SPV):在1个呼吸周期内分别获得SBP的最大值、最小值及其对应的舒张压,根据公式:SPV=200×(SBPmax-SBPmin)÷(SBPmax+SBPmin);记录患者围术期新发脑梗、脑高灌注综合征等不良反应的发生率。

2 结 果
2.1 一般资料比较 本研究纳入90例患者,每组30例。3组患者的性别、年龄、体重指数、手术时间、失血量、尿量比较,差异无统计学意义(P>0.05);与C组比较,S组、P组输液总量显著减少;与S组比较,P组输液总量显著减少(P<0.05)。见表1。

表1 3组患者一般资料和出入量情况的比较
2.2 3组患者围术期血流动力学比较 与T0时比较,T2-T6时3组SBP、MAP均明显升高,SPV降低(P<0.05)。与C组同时间点比较, S组、P组T2-T6时SPV降低,T4-T6时SjvO2升高(P<0.05)。与S组比较,P组T2-T6时SPV降低,T4-T6时SjvO2无显著差异(P>0.05)。见表2-4、图1-2。

表2 3组患者术中SBP、MAP、HR及SpO2的比较

表3 3组患者术中SPV、SjvO2的比较

表4 3组患者术中去甲肾上腺使用情况的比较(x±s,n=30)

A:MAP比较; B:SBP比较; C:HR比较; D:SpO2比较;与T0时间点比较*P<0.05
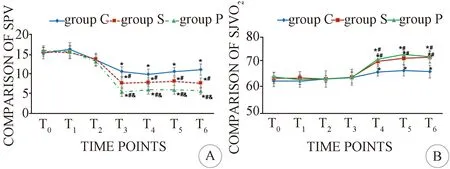
A: SPV比较; B:SjvO2比较;与T0时间点比较*P<0.05;同时间点与C组比较#P<0.05;同时间点与S组比较&P<0.05
2.3 3组患者术后复苏情况比较 术后意识恢复时间和气管导管拔管时间S组、P组较C组显著缩短;与S组比较,P组术后意识恢复时间和气管导管拔管时间明显缩短(P<0.05)。见表5。

表5 3组患者术后复苏情况比较(n=30)
2.4 术后并发症发生情况比较 术后第1 d常规行头颅MRI和SPECT扫描检查,3组患者围术期均无脑出血并发症。3组患者术后桥血管显影均显示良好;C组新发脑梗塞发生率为16.7%,S组新发脑梗塞发生率为10.0%,P组新发脑梗塞发生率为6.7%,P组脑梗发生率显著低于C组、S组,但3组均无因脑梗引发的临床症状;脑高灌注综合征C组与S组发生率均为11.5%,P组3.3%,显著低于C组、S组(P<0.05)。见表6。

表6 3组患者存在术后并发症发生率情况比较(n=30)
3 讨 论
外科脑血管重建术是目前MMD行之有效的治疗手段,然而,术中因大脑中动脉血流形态学改变,极易发生缺血超灌注及分水岭梗死所致神经损伤,受累血管和脑组织对血容量、血压变化非常敏感[3-4](图3),对围术期环境变化的耐受力和反应性降低,维持术中循环平稳对脑功能及术后恢复均十分重要,因此探讨围术期麻醉管理优化策略对MMD手术患者的预后具有重大意义。

A:正常头颅核磁脑血管; B:损伤后头颅核磁脑血管
MMD是基因相关的血管生成异常性疾病,血管病理组织学显示管壁有淋巴浸润,提示炎性反应参与其中[5]。而手术目的为改善缺血区脑组织的血液供应,降低烟雾状发病血管的张力,减轻神经功能损伤。围术期血压过高可导致脑过度灌注综合征,甚至颅内出血;血压过低可引起脑灌注不足所致脑梗死的形成,严重影响患者的生命安全。研究提示,内皮型一氧化氮合酶(endothelial nitric oxide synth ase,eNOS)作为调节血压、维持血管稳态的酶,该酶的变异会导致NO合成异常,引起血管病变[6];进一步有研究表明,缺乏α1β1型血管平滑肌细胞对NO反应迟钝,从而使血管动力学改变的地方出现了异常血管的重建[7]。全身麻醉药物本身扩张血管,引起低血压,加重脑缺血症状,因此MMD患者的麻醉要更为平稳,对麻醉医师的要求更高。PPV作为在机械通气过程中伴随胸腔内压力的周期性变化而发生周期性变化的容量动态监测指标[8],能够比较准确地预测患者容量反应,准确性优于MAP、HR、CVP等血流动力学指标,能够对容量进行合理、有效、及时地监测,具有极大的临床价值和潜力[9]。PPV诊断阈值为10%,高于10%认为有容量反应性。近年来PPV预测患者容量反应性功能性血流动力学监测成为容量治疗的新热点[10-11]。有研究表示,液体输注在手术最开始的40 min内给予总量中的绝大部分,可有效抑制机体炎症反应,改善预后[12];但MMD患者对循环耐受范围较窄,术中补液量过多、过快,会造成前负荷过大,引起肺间质水肿、脑高灌注等。本研究在适度扩容的基础上,小量应用去甲肾上腺素让血管具有一定的张力,有助于维持血流动力学稳定。去甲肾上腺素作为一种内源性交感神经系统节后神经递质,对a受体具有强烈的激动作用,达到最优化的液体管理,加速术后恢复。本研究在探讨优化麻醉管理的同时关注脑氧代谢的影响,通过观察手术不同时间点患者的HR、SBP、MAP、SPV来监测血流动力学变化,SjvO2监测脑氧代谢,与C组比较,S组、P组患者在血流动力学、脑氧代谢更加稳定。SjvO2正常范围为50%~75%,低于50%时,相应区域的脑血流量减少,低于40%时,提示存在全脑缺血缺氧。与P组相比,C组采用传统输液管理方案,虽然SBP、MAP依赖输液和去甲肾上腺素缩血管药物维持在预设范围内,但SPV变异大,可能是因为脑血管壁上的不稳定斑块破裂,血压波动太大,明显升高可诱发不稳定斑块再次破裂使脑梗加重或新发脑梗比例增加,右美托咪定可显著改善血流动力学稳定性。本研究结果显示,3组患者SjvO2值均处于正常值范围内,且在T4-T6时间点,P组高于C组和S组。说明相对于C组、S组,P组患者大脑氧供更充分。
右美托咪定作为一种a2受体激动剂、浓度依赖的N-甲基-D-天冬安酸(N-methyl-D-aspartic acid receptor,NMDA)受体抑制剂,其可能通过抑制炎症、应激反应,改善血流动力学,提高脑组织对氧的利用发挥脑的保护作用[13]。有研究发现,右美托咪定可以阻止皮质细胞凋亡、减少神经元毒性,促进突触形成和神经营养等作用[14-15];当脑组织发生缺血时,脑组织及血中的儿茶酚胺浓度将升高,右美托咪定可通过抑制交感神经系统的活性,减少儿茶酚胺递质释放减少;另外,研究发现右美托咪定亦可直接作用于脑内a2受体,减少脑内儿茶酚胺物质释放,减轻神经元损伤,从而起到脑保护作用[16-17]。本研究前期已经证实,右美托咪定作为一种a2受体激动剂,可显著改善术后疼痛,维持术中血流动力学稳定,有效抑制围术期炎性反应,减少炎性因子TNF-α等表达[18];围术期应用右美托咪啶可以显著改善老年患者的预后。本研究将右美托咪啶的应用同术中PPV 监测指导液体管理两种方法结合起来,为临床提供更好的脑保护策略。
MMD搭桥手术是否成功,取决于搭桥血管的再通情况及术中和术后对患者脑灌注的保护和支持,通过术中荧光造影及术后磁共振血管相薄层扫描能清晰地观察到搭桥后血管是否再通,而术中血流动力学的评估对术中及术后缺血区脑组织的灌注有重要意义[19],本研究选取的病例术中荧光造影及术后磁共振检查均显示血管再通情况良好,术中血流动力学监测对术后短期恢复有临床意义;但MMD病情复杂,外科手术吻合情况、术中及术后麻醉管理、术后血压管理及抗凝情况等均可影响其疗效[20];本研究样本量小,仅对患者术后短期疗效进行分析,对远期血流改善未做分析,存在一定局限性,后续研究仍需要更多大样本、追踪时间更长的深入探讨。
总之,本研究两组患者一般资料比较差异无统计学意义(P>0.05),选择同一神经外科及麻醉团队,规范手术治疗过程,使研究条件具有统一和稳定性,证实具有可比性。本研究认为右美托咪啶联合术中PPV监测在改善MMD 患者预后方面更具有优势,具有一定的脑保护作用。右美托咪定联合术中PPV监测可以明显预防、减轻缺血型MMD手术患者术后并发症,血流动力学、脑氧代谢更加稳定,保障了MMD患者在围术期的安全,优化麻醉方案,改善预后,逐渐实现“舒适化医疗”的目标。
利益冲突:所有作者均声明不存在利益冲突。
