半肝切除术后早期肝再生的影响因素分析
2022-05-10保梅张嘉军2刘普文3朱呈瞻4邢茂青
保梅 张嘉军2 刘普文3 朱呈瞻4 邢茂青
(1 青岛大学附属医院小儿外科,山东 青岛 266003; 2 威海市立医院关节骨科;3 青岛大学附属医院(平度)肝胆外科; 4 青岛大学附属医院(市南)肝胆胰外科)
肝切除术作为治疗肝胆肿瘤的首选方案,可显著延长患者的生存时间[1]。肝功能失代偿是肝切除术后短期内常见的并发症,严重者可导致患者死亡,而肝切除术后残余肝体积(RLV)不足是肝功能衰竭发生及进展的主要原因[2-3]。与门静脉栓塞术一样,肝切除术能够通过增生反应来诱导肝再生。近年来,随着数字医学的快速发展,术前三维可视化评估已常规应用于肝胆肿瘤的术前评估,并通过模拟肝切除术评估RLV及手术风险,提高了肝胆肿瘤切除术的精准性与安全性[4]。但之前对术后肝再生的研究主要集中在动物肝切除模型上,且目前的研究主要集中于肝细胞癌患者的术后肝再生情况。另外,由于评估肝脏体积的方法不一,而且临床混杂因素偏倚较大,导致术后肝再生率及肝再生影响因素的研究结果差异较大。因此,精准预测不同病理类型的肝胆肿瘤肝切除术后早期肝再生情况及其可能的影响因素,对于降低术后肝功能失代偿的发生率及提高患者远期生存率均具有重要意义。本研究回顾性分析了青岛大学附属医院82例因肝胆肿瘤行半肝切除术患者的围手术期临床资料,统计术后1月肝脏再生的体积及肝再生率,探讨影响肝切除术后肝脏再生的相关因素,以期为肝切除术前手术方案的精准制定及术后相关并发症的预防提供参考。
1 资料与方法
1.1 资料来源
筛选2014年1月—2020年12月于青岛大学附属医院肝胆胰外科因肝脏肿瘤行左半肝或右半肝切除术患者82例。纳入标准:①术后病理诊断为肝脏肿瘤,包括肝细胞癌、肝内胆管细胞癌、肝门胆管癌、肝转移瘤和导管内乳头状瘤;②首次行肝切除术,并实施标准左半肝或右半肝切除术;③术前行上腹部动态增强CT扫描,可实现三维重建、模拟手术切除及体积测算;④术后1月行上腹部CT复查。排除标准:临床相关资料不完整者。
1.2 研究方法
1.2.1海信计算机辅助手术系统(CAS)三维成像及肝体积测量 从PACS管理系统中将患者术前上腹部增强CT及术后1月CT图像以Dicom文件格式导出,将Dicom数据导入海信CAS进行肝脏、血管及肿瘤的三维重建(图1A、B),选择性离断门静脉左支主干或右支主干,沿肝中静脉走行对肝脏进行快速自动切割,模拟左半肝切除或右半肝切除(图1C),并自动计算出全肝体积(TLV)、肿瘤体积(TV)、切除肝体积和RLV。同法,将术后1月CT图像的Dicom文件导入海信CAS后自动生成术后1月RLV(FRLV)(图1D、E)。根据下式计算肝再生率、体表面积(BSA)和标准RLV(SRLV)。肝再生率=[(FRLV-RLV)/RLV]×100%,BSA=体质量(kg)0.444×身高(cm)0.663×0.009,SRLV=RLV/BSA。以患者术后1月肝再生率的中位数为分界点,将82例患者分为肝再生率较高组和肝再生率较低组。
1.2.2观察指标 收集所有患者的一般资料,包括年龄、性别、身高、体质量、饮酒史、肝炎史等,计算BMI指数。收集所有患者入院时的实验室和辅助检查结果,包括血常规、肝肾功能、凝血功能、乙肝五项、 HBV-DNA 载量和门静脉主干宽度、门静脉流速、门静脉流量等。收集所有患者的术中及术后资料,包括手术部位、手术时间、术中出血量、病理分型及是否肝硬化等。Child-pugh分级以患者入院后第一次检验结果为准。
1.3 统计学方法
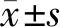

A:术前增强CT图像,B:术前肝脏、血管及肿瘤的三维重建,C:模拟标准右半肝切除,D:术后1月CT图像,E:术后1月FRLV图1 海信CAS三维成像及肝体积测量Fig.1 Three-dimensional imaging and liver volume measurement by the Hisense computer-assisted surgery system
2 结 果
2.1 一般资料
本研究共纳入患者82例,男48例,女34例;年龄(58.90±10.00)岁。肝细胞癌患者44例,肝内胆管癌患者14例,肝门胆管癌患者14例,结直肠癌肝转移患者4例,导管内乳头状瘤患者6例。左、右半肝切除各41例,左半肝和右半肝术后1月中位肝脏再生率分别为22.3%和33.0%。所有患者术后1月肝脏再生率为(31.95±21.79)%,中位数为28.5%。
2.2 影响患者肝再生的单因素分析
以中位肝再生率28.5%为分界点分为2组,即肝再生率较高组(肝再生率≥28.5%,41例)和肝再生率较低组(肝再生率<28.5%,41例)。单因素分析显示,两组患者的SRLV、饮酒史、性别、肝硬化指标比较,差异具有显著性(t/χ2=-3.400~10.818,P<0.05)。见表1。
2.3 影响患者肝再生的多因素逐步Logistic回归分析(向前法)
多因素逐步Logistic回归分析显示,SRLV和肝硬化是影响肝切除术后早期肝再生的独立危险因素(OR=1.008,8.244,95%CI=1.003~1.013,2.264~30.013,P<0.05)。见表2。

表1 影响肝再生的单因素分析(n=82)Tab.1 Univariate analysis of factors affecting liver regeneration (n=82)

续表1:

表2 影响肝再生的多因素逐步Logistic回归分析(向前法)Tab.2 Multivariate forward stepwise Logistic regression analysis of factors affecting liver regeneration
3 讨 论
肝脏是一个具有强大再生能力的器官,其能维持肝脏与体质量的比例始终保持在机体稳态所需的100%。肝切除术等急性肝损伤可触发残余肝脏启动再生程序,以弥补丢失的肝脏组织,满足生理需求。肝脏再生过程分为三个阶段:术后前2周肝再生进展迅速,这与血管充血和组织水肿有关;随后的1~2个月肝脏体积增长逐渐变缓,可能与短暂的血管充盈或组织水肿的消退有关;最后肝脏体积逐渐增大,直到肝再生完成[5]。近年来,随着数字医学的快速发展,利用医学影像学技术(如海信CAS)可以精确、客观地评估肝再生情况,而不受手术医生主观判断的影响[6-8]。GONG等[9]使用肝脏三维重建对肝细胞癌半肝切除术后肝再生情况的研究显示,肝切除术后1周肝再生率为21.3%,术后第5周为30.9%,术后第9周为37.1%,提示肝切除术后1周内肝再生迅速,然后缓慢生长至第5周,在术后第9~13周左右肝再生趋于稳定。本研究中半肝切除术后1个月,肝脏平均再生率为(31.95±21.79)%,中位数为28.5%,与既往文献报道结果相符[9]。
本研究单因素分析发现,女性患者肝切除术后肝再生率明显高于男性患者。SHAN等[10]研究发现肝切除术后女性的肝再生能力高于男性,提示性别是肝再生的影响因素,与本研究结果相符。其原因可能与女性患者肝硬化水平相关。研究表明,与女性相比,男性慢性肝炎进展速度更快,且更容易进展为肝硬化或肝癌[11]。本研究中纳入的女性患者中肝硬化占比为11.8%,远低于男性患者肝硬化占比35.4%。然而,IBIS等[12]对活体供肝脏切除后的研究发现,性别不是肝再生的影响因素。这可能与本次研究中男性患者合并有较多基础疾病有关,性别是否影响切除术后的肝再生有待进一步的研究。
酒精与慢性病毒性肝炎、肝细胞癌的进展具有明确相关性,过量饮酒可促进肝细胞的氧化应激及乙醛、脂多糖在肝脏累积,加重肝脏损伤[13-14]。SHI等[15]证明,乙醇不仅抑制成人肝细胞增殖,还可以抑制肝祖细胞的增殖,并通过Snail信号抑制细胞分化,进而影响肝脏再生。DUBUQUOY等[16]也发现在酒精性肝炎患者中,肝祖细胞分化为成熟肝细胞的效率降低,肝再生受损。HSU等[17]认为酒精性肝损伤影响了细胞周期蛋白D1的表达,进而导致肝切除术后肝脏再生减慢。本研究中,长期饮酒患者肝再生不良的发生率明显高于无饮酒史患者,表明长期饮酒是影响术后肝再生的因素之一。因此对于长期饮酒的患者,术后采取个体化治疗是预防肝再生不良的关键,如严格戒酒、营养支持和肠道微生物调节等均可降低酒精性肝脏损伤,促进肝再生[18]。
RLV是影响术后肝再生水平的重要因素之一。既往研究表明RLV对健康供体和肝肿瘤患者的肝再生都有影响[19-20]。INOUE等[21]研究发现残余肝脏再生速率与切除肝实质量密切相关,切除肝实质量越多,残余肝脏再生越快,而且伴随着RLV的恢复,肝功能逐步恢复。然而对于RLV不足20%的过量肝切除,可迅速导致肝衰竭甚至患者死亡[22-23]。因此,在一定范围内,RLV与术后肝再生率呈负相关。由于不同身高和体质量的个体之间肝脏储备功能存在差异,本研究通过BSA将RLV进行标准化,获得SRLV以缩小个体间差异。多因素Logistic回归分析显示,SRLV是半肝切除术后影响肝再生能力的独立危险因素。其可能与大范围肝切除导致细胞因子和生长因子释放增加,可促进残肝的再生有关[24-25]。FATHI等[26]研究发现,70%的肝脏切除后,促进肝再生的主要炎症因子白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)的表达均显著升高,经IL-6以及TNF-α刺激后肝细胞生长因子(HGF)水平迅速升高并与残肝生长呈正相关[27]。
肝纤维化和肝硬化的严重程度与术后肝储备功能和术后残余肝脏的再生密切相关[28]。AIERKEN等[29]研究表明,肝纤维化严重程度是肝再生的重要预测指标,肝纤维化分级可预测肝切除术后的肝再生率。本研究多因素Logistic回归分析显示,无肝硬化患者术后肝脏再生情况优于肝硬化患者,提示肝硬化是影响肝切除术后残肝再生的独立危险因素。这可能是因为肝硬化患者的肝脏细胞外基质蛋白积累,形成纤维性瘢痕,肝结构发生扭曲,肝内血管阻力增加,因此切除术后门静脉过度灌注及肝静脉回流不畅导致肝动脉灌注不足,肝脏供氧能力下降,肝再生能力下降[30]。此外,肝窦内皮细胞是肝细胞增殖所需的细胞因子和生长因子的关键来源。硬化肝脏肝窦内皮细胞毛细血管化,原有的窗孔结构消失,阻止了肝窦和肝细胞之间的物质交换,使肝细胞更容易受到缺血和营养损害[31]。
综上所述,肝胆肿瘤患者半肝切除术后SRLV及肝硬化是影响肝再生的独立危险因素,另外,长期饮酒或男性患者术后发生肝再生不良的风险可能增加。但本研究为单中心研究,且纳入样本量相对较小,研究结果尚需前瞻性大样本量研究加以佐证。
利益冲突声明:所有作者声明不存在利益冲突。
ConflictsofInterest: All authors disclose no relevant conflicts of interest.
伦理批准和知情同意:本研究涉及的所有试验均已通过青岛大学附属医院医学伦理委员会的审核批准(文件号QYFYWZLL26878)。所有实验过程均遵照《人体医学研究的伦理准则》的条例进行。受试对象或其亲属已经签署知情同意书。
EthicsApprovalandPatientConsent: All experimental protocols in this study were reviewed and approved by The Medical Ethics Committee of The Affiliated Hospital of Qingdao University (Approval Letter No. QYFYWZLL26878), and all experimental protocols were carried out by following The Ethical Guidelines for Human Medical Research. Consent letters have been signed by the research participants or their relatives.
作者贡献:张嘉军、刘普文参与了研究设计;保梅、朱呈瞻、邢茂青参与了论文的写作和修改。所有作者均阅读并同意发表最终稿件。
Contributions: The study was designed byZHANGJiajunandLIUPuwen. The manuscript was drafted and revised byBAOMei,ZHUChengzhan, andXINGMaoqing. All the authors have read the last version of the paper and consented submission.
