不同规格大珠母贝稚贝生长、生理及肠道菌群组成
2022-05-09彭汝雨HebertElyVasquez顾志峰
彭汝雨,李 曦,Hebert Ely Vasquez,郑 兴,顾志峰
(1.中交天航南方交通建设有限公司,广东 深圳 518000;2.海南大学 海洋学院,海口 570228)
0 引言
大珠母贝 (Pinctadamaxima) 俗称白蝶贝,属于珍珠贝科(Pteriidae)、珠母贝属(Pinctada),喜栖息在 10 m 以上水深的珊瑚礁或沙砾海域,营附着生活[1]。大珠母贝是我国热带海域主要的大型珍珠贝品种,是海水珍珠贝中体型最大、贝壳最厚的种类,主要分布在海南、广西、广东等南方沿海区域[2-3]。大珠母贝所培育的圆形游离海水珍珠俗称“南洋珠”,直径最大可达2.0 cm,且具有珠层厚、光泽好的特点,其价值远高于其他珍珠贝品种所培育的珍珠,属珍珠中的珍品[4-5]。
我国海水珍珠主要由体型较小的马氏珠母贝培育,在20世纪90年代,其珍珠产量居世界海水珍珠产量首位,且珍珠质量较好。然而21世纪以来,由于环境、苗种以及马氏珠母贝体型本身的限制等,产量急剧下降,2013年全国海水珍珠产量已不足2 t,而且珍珠小、珠层薄、瑕疵多、质量差,多数无法达到珠宝级标准,基本上不被国际珠宝市场认可[6]。基于目前国际珍珠市场大型海水珍珠价值、产量和地位迅速攀升的现实,培育规格大、珠层厚、光泽好的优质大型海水圆形珍珠是我国海水珍珠养殖产业实现可持续发展的必由之路,而大珠母贝是培育大型海水圆形珍珠最理想的珍珠贝。
我国海水珍珠研究人员自20世纪60年代就开始了大珠母贝研究,于20世纪80年代培育出中国第一颗大珠母贝“南洋珠”,该研究成果曾获国家科技进步一等奖。遗憾的是,这一成果至今没有实现产业化,其主要原因是在养殖生产中大珠母贝人工苗种养殖至壳长3~7 cm时其存在规模化死亡现象,这成为大珠母贝养殖产业可持续发展的技术瓶颈[7]。为有效提高大珠母贝稚贝养殖存活率,诸多学者开展了养殖方式、海上管理方式、喂养策略等多方面的研究[8-9]。在大珠母贝稚贝养殖过程中,饵料的类型会影响稚贝的存活率和生长速度[10],珍珠贝可能在不同发育阶段对饵料的需求存在一定差异,不同发育阶段不同规格的稚贝对养殖环境的耐受能力也有差异。课题组前期进行的大珠母贝稚贝接力式养殖试验结果发现不同规格的稚贝在海上中间培育阶段存活率存在明显差异。本文在此基础上选择两种不同大小规格的大珠母贝稚贝在海棠湾海域继续开展试养实验,并从生长性能、生理活力及肠道菌群结构角度探究稚贝规格和存活率之间的关系,以期为大珠母贝稚贝海上中间培育技术的优化奠定基础。
1 材料与方法
1.1 实验动物与管理
实验所用两种规格的大珠母贝稚贝(壳长分别为30 mm和20 mm)均由海南三亚迈丰实业有限公司提供。稚贝在移入海棠湾海域开展试养实验前,都在室内养殖车间进行养殖管理。期间每天使用湛江等鞭金藻(Isochrysiszhanjiangensis)、亚心形扁藻(Platymonassubcordiformis)和牟氏角毛藻(Chaetocerosmuelleri)进行混合投喂,养殖水体每天换水,换水量为30%,以保证养殖水体中的总氨氮含量小于0.02 mg·L-1,溶解氧浓度不小于6 mg·L-1。
1.2 实验设计
实验采用片笼吊养方式进行实验动物的养殖,将壳长30 mm和20 mm的大珠母贝实验组分别标记为HA组和HB组,在养殖场室内移入相应片笼中后,直接运至海棠湾蜈支洲岛试养海域。实验共持续60 d,期间每10 d进行一次附着物清理工作,试养结束后分别对HA组和HB组稚贝进行样品采集及数据收集,进而开展统计学相关分析。
1.3 检测指标及方法
1.3.1 存活率的检测
试养的大珠母贝稚贝存活率(SR,记为ρSR)的计算方法为
ρSR=(N2/N1)×100%,
(1)
其中:N1、N2分别为稚贝总数和存活稚贝个数。
1.3.2 壳长相关指标的检测
使用游标卡尺对稚贝样品进行壳长测量,以便计算绝对增长率(AGR,记为kAGR)和相对增长率(RGR,记为kRGR),其计算公式为
(2)
(3)
其中:X1和X2分别是试养实验前后样品的平均壳长,t是实验时间。
1.3.3 消化酶及免疫酶活力的检测
对HA组和HB组样品测量其形态指标后,随机取部分样品分别分成2份投入液氮中进行保存,其中一部分用于消化酶和免疫酶活力的检测。消化酶包括淀粉酶(AMS)、胃蛋白酶(PES)、脂肪酶(LPS),免疫酶包括溶菌酶(LZM)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)。实验采用南京建成生物科技有限公司的生化试剂盒进行检测,操作严格按照说明书所示的方法进行。
1.3.4 肠道微生物分析
液氮保存的另一份样品用于肠道菌群构成分析,该部分样品直接送至杭州联川生物技术有限公司进行后续检测,样品保存方法及步骤严格按照技术要求进行。
1.4 数据分析
用统计分析软件DPS 14.5进行显著性检验统计分析,当P<0.05时,认为差异显著。
2 结果与分析
2.1 存活率及生长差异比较
HA组和HB组间的实验存活率、生长性能(表1)存在显著差异(P<0.05),且HA组优于HB组。HA组存活率为(86.16±1.58)%,显著高于HB组的结果(67.88±3.02)%。试养结束后,HA组和HB组壳长分别增至(43.18±3.17) mm和(26.65±2.06) mm;HA组壳长的绝对和相对增长率分别为(0.22±0.05)mm·d-1、(0.73±0.06)%·d-1,显著高于HB组的相应结果(0.11±0.04)mm·d-1、(0.55±0.09)%·d-1。

表1 不同规格大珠母贝稚贝存活率及壳长比较(平均值±标准差)
2.2 部分消化酶和免疫活力差异比较
试养结束后,HA组与HB组间部分消化酶和免疫酶活力(表2)存在显著差异(P<0.05),HA组的酶活力均高于HB组。其中,HA组淀粉酶和胃蛋白酶活力分别为(4.07±0.45)、(3.38±0.19)U·mg·prot-1,显著高于HB组的相应结果(2.00±0.52)、(2.36±0.16) U·mg·prot-1;HA组碱性磷酸酶、酸性磷酸酶和溶菌酶活力都高于HB组,分别为(16.49±0.80)、(14.58±0.38)King·mg·prot-1和(16.86±1.25) U·mg·prot-1。

表2 不同规格大珠母贝稚贝消化酶和免疫酶活力比较(平均值±标准差)
2.3 肠道菌群组成比较
试养结束后,HA组与HB组间肠道菌群结构(图1)总体相似,群落结构不存在显著差异(P>0.05)。其中,在门水平上,变形菌门(Proteobacteria)和浮霉菌门(Planctomycetes)都为两组实验贝的优势菌群,
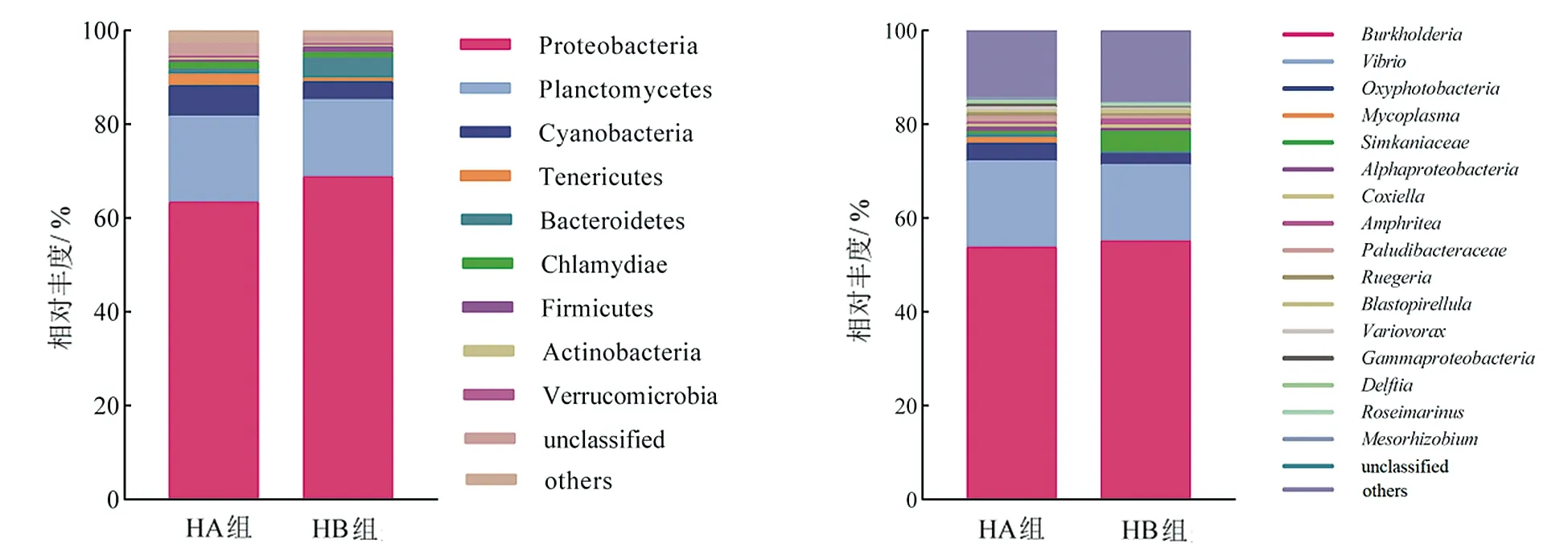
(a)门水平 (b) 属水平 图1 不同规格大珠母贝稚贝肠道菌群组成比较
在HA组中其相对丰度分别为63.36%、68.87%,在HB组中则分别为16.35%、18.32%。在属水平上,伯克霍尔德菌属(Burkholderia)和弧菌属(Vibrio)为优势菌群,在HA组中其相对丰度分别为53.83%、55.11%,在HB组中则分别为18.26%、16.29%。
3 讨论
养殖活动中存活率和生长性能是行业中最关注的重要评判因素之一[10-12]。本文所选海棠湾蜈支洲岛试养海域为典型热带气候海域,自然环境下饵料种类丰富,盐度和温度等环境条件合适,对于大珠母贝、珠母贝、马氏珠母贝等热带养殖经济贝类而言是较好的栖息环境。本研究所获结果表明,两种规格的大珠母贝稚贝在蜈支洲岛试养海域存活率可达67%以上,该存活率虽然低于室内培养的同批次稚贝的结果(88%,数据来源于养殖场),但其生长性能优于室内同批次稚贝的结果。这可能是因为蜈支洲岛试养海域饵料种类较丰富和数量比较充足,可满足大珠母贝稚贝在该阶段生长发育所需的饵料的营养性和数量。本研究结果与Yang等[13]关于大珠母贝稚贝室内养殖与海上养殖的情况对比,以及与杨创业等[12]关于马氏珠母贝室内养殖与海上养殖效果的比较均较为一致,主要原因在于饵料种类和营养的丰富度和充足性。本研究中,将30 mm规格组与20 mm规格组的稚贝的存活率和生长性能进行对比,得到的结果是30 mm规格组稚贝的存活率较高,生长性能也较优。其原因可能在于较大规格的稚贝具有相对较强的体质、摄食能力,对环境的适应耐受性更强,且对饵料的营养吸收更为快速有效。
动物对饵料或饲料的消化吸收过程较为复杂,消化酶在这个过程中有着十分重要的作用。消化酶可以帮助机体消化和分解从外界摄取的食物,从而为机体的生长、发育、繁殖等生命活动提供所需的能量[14]。目前所关注的消化酶主要为淀粉酶、胃蛋白酶和脂肪酶,酶活力的大小常被用作反映动物消化性能、营养状况等方面的重要指标[15]。本研究结果表明,大珠母贝稚贝在海区吊养期间,30 mm规格组稚贝的胃蛋白酶、脂肪酶活力显著高于20 mm规格组的结果,这代表着30 mm规格组稚贝的消化能力强于20 mm规格组稚贝,从而可获得更多的能量用于生长及环境适应,这在一定程度上也反映了两组不同规格稚贝在同一试养海域养殖时生长性能和存活率存在差异的原因。30 mm规格组稚贝具有较好的摄食及消化能力,可更有效地获得食物及吸收营养,从而拥有更多的能量抵御不良环境因子的胁迫,有更多机会生存于野外环境,继而生长发育。
抗氧化系统可清除体内过量活性氧,保护机体不受氧化损伤,其中起免疫防御功能的免疫酶对机体抗逆能力是十分重要的。ACP、AKP 是两种重要的代谢调控酶,同时也是巨噬细胞溶酶体酶的标志酶,通过形成水解酶体系消除异物,从而起到免疫防御的功能[16-18]。LZM属于机体的非特异性免疫因子,是非特异性免疫系统的重要组成成分,参与多种免疫反应,在免疫反应中可以增强巨噬细胞的吞噬和消化能力,激活白细胞的吞噬功能,诱导其他免疫因子的合成和分泌,其活力变化可作为动物免疫机能状态的指标[19-20]。ACP、ALP和LZM的活力都可以反应机体的抗氧化水平及免疫健康状态,本研究结果表明,在海棠湾海域养殖结束后的30 mm规格组稚贝的ACP、ALP和LZM的活力都显著优于20 mm规格组稚贝,这在一定程度上代表着30 mm规格组稚贝具有较强的抗氧化剂免疫性能,体质情况相对较佳,因此可更有效地适应和抵抗外界自然环境因素的变化,从而提高自身存活能力,这可能就是30 mm规格组稚贝在本试养实验中存活率相对较高的原因之一。
肠道菌群由种类多样和数量庞大的微生物所构成,并通过各个种类的相互作用形成复杂的生态网络,在宿主生长、发育、免疫等诸多重要生命活动环节中发挥着重要作用[21-22]。肠道菌群的结构合理性及稳定性对宿主的健康极其重要,不合适的环境、食物等因素都可能会导致肠道菌群的紊乱,从而影响宿主的生命质量。肠道菌群的负向改变会损害宿主的免疫功能,从而使其患病风险提高,影响存活能力[23]。不同物种的肠道菌群组成结构有所差异,且会受到养殖环境、饵料环境等因子的影响[13]。本研究结果表明,在海棠湾蜈支洲岛海域养殖的大珠母贝稚贝肠道菌群结构在门水平上其优势菌群是变形菌门(Proteobacteria)和浮霉菌门(Planctomycetes),该结果与长牡蛎(Crassostreagigas)的肠道菌群研究结果较为一致[24-25]。变形菌门是动物所有生命阶段中数量最大、表型最多样化和最丰富的门[26-27]。本文进一步在属水平上对大珠母贝稚贝进行肠道菌群结构分析,其分析结果表明伯克霍尔德菌属(Burkholderia)和弧菌属(Vibrio)是其核心优势菌群。弧菌属中的弧菌是我们所认知的条件致病菌,但在本研究过程中并未发现大珠母贝稚贝存在感染病害或发病的迹象,其原因可能是条件致病菌只有在满足环境恶劣、宿主体质及抵抗力较差的条件下才会发生致病现象,而本研究所在蜈支洲岛海域环境良好、稚贝体质较佳,且弧菌数量较低,因此在该环境中本实验试养的稚贝未发生致病现象。此外,相关研究表明病原微生物在水生动物肠道中的存在可以看作是一种普遍现象,在宿主体内主要是对代谢和免疫等生命过程起着或大或小的作用,而并不是致病的关键因素[28-30]。
综上所述,壳长30 mm规格的大珠母贝稚贝相对于20 mm规格稚贝而言,在海棠湾蜈支洲岛试养海域的存活率较高,生长性能较好,消化和免疫性能较佳,其后期养殖成功的可能性更大。本研究结果可为大珠母贝稚贝海上中间培育技术的优化奠定基础。
