工厂化循环水养殖珍珠龙胆石斑鱼和红鳍笛鲷肠道菌群的多样性*
2022-05-09熊向英王志成刘旭佳姚坤志梁志辉
熊向英,王志成,刘旭佳,姚坤志,梁志辉
(1.广西海洋研究所有限责任公司,广西北海 536000;2.广西科学院,广西北部湾海洋研究中心,广西近海海洋环境科学重点实验室,广西南宁 530007)
鱼类肠道内定植着大量的微生物,这些微生物参与了鱼类的营养代谢、抑制病原微生物等多方面生理过程[1],查明肠道菌群的组成有助于了解鱼类的生长情况。近年来大量研究报道了不同因素下鱼类肠道菌群的组成,如鱼类生长阶段、环境、病害的发生以及饲料等[2-4]。但由于鱼类种类繁多,已有的报道尚不能全面反映鱼类肠道细菌的多样性及其影响因素。
工厂化循环水养殖模式具有节水、节地、排放废水少、对环境污染小、可实现常年生产等诸多优点[5,6],是水产养殖绿色发展的重要方向之一。工厂化循环水养殖模式下鱼类肠道微生物组成及其与养殖海水的相关性值得关注。珍珠龙胆石斑鱼(Epinephelusfuscoguttatus♂×E.lanceolatu♀)和红鳍笛鲷(Lutjanuserythropterus)都具有生长速度快、营养价值高、经济效益显著等特点,为中国南方重要的优良经济鱼种[7,8]。本研究通过16S rDNA高通量测序的方法,初步分析了在工厂化循环水养殖模式下两种鱼类肠道细菌多样性及其与养殖环境的关系,以期为鱼类肠道菌群的组成和影响因素提供科学依据。
1 材料与方法
1.1 实验系统
工厂化循环水养殖系统建于广西北海市广西海洋研究所海水增养殖基地试验车间,该车间用于试验养殖的水池有13个,每个池面积17.34 m2(5.1 m×3.4 m),水深90 cm,有效养殖水体15.6 m3/个,其中4个池养殖珍珠龙胆石斑鱼,密度为71尾/m3;另外9个池养殖红鳍笛鲷,密度为160尾/m3。循环水养殖系统处理顺序为鱼池→沉淀池→蛋白质分离器→生物滤池→海马齿浮床→紫外杀菌→鱼池。
1.2 养殖管理
试验期间循环水养殖系统水质条件为水温28.5-31.4℃,溶解氧浓度7.87-9.05 mg/L,盐度28-31,pH值7.8-8.1。养殖期间每天早上和下午分别喂1次,投喂量约为鱼体重量的3%-5%,根据其摄食情况投喂。珍珠龙胆石斑鱼投喂广东恒兴石斑鱼配合饲料,红鳍笛鲷投喂广东恒兴海水鱼膨化饲料,两种饲料成分对比见表1。
1.3 样品采集及DNA提取
随机捕捞珍珠龙胆石斑鱼和红鳍笛鲷各3尾置于解剖盘中,用75%酒精对其体表进行消毒,用灭菌的剪刀、镊子解剖取其肠道后迅速放入-80℃冰箱保存。取样时珍珠龙胆石斑鱼平均体长为15.9 cm,平均体质量为136.4 g;红鳍笛鲷平均体长为11.4 cm,平均体质量为42.1 g。用组织匀浆机对珍珠龙胆石斑鱼和红鳍笛鲷肠道匀浆,然后采用Soil DNA Kit试剂盒(Omega Bio-Tek,美国)提取肠道中微生物总DNA。珍珠龙胆石斑鱼养殖池和红鳍笛鲷养殖池水样则采用多点取样法,每池从3个点各取1 L水混合均匀后,取其中1 L水样先经5 μm孔径的混合纤维膜预过滤去除杂质后用0.22 μm无菌聚醚砜膜(天津市津腾实验设备有限公司)抽滤,将带有水体宏基因组的滤膜剪碎,用E.Z.N.A.Water DNA Extraction Kit试剂盒(Omega Bio-Tek,美国)提取水体中微生物总DNA。
1.4 PCR扩增及高通量测序
对16S rDNA基因可变区V3-V4区进行PCR扩增,所用引物序列为细菌特异性引物341F (5′-CCTAYGGGRBGCASCAG-3′)和806R (5′-GGACTACNNGGGTATCTAAT-3′)。PCR产物使用2%琼脂糖凝胶电泳检测,送北京百迈克生物信息科技有限公司进行基于Illumina HiSeq测序平台的高通量测序。
1.5 数据分析
对原始测序序列使用FLASH软件(版本1.2.11)进行拼接,将拼接得到的序列使用Trimmomatic软件(版本0.33)进行质量过滤,并利用UCHIME软件(版本8.1)去除嵌合体,得到高质量序列(Tags)。分析过程中删除古菌、叶绿体、未知序列以及只检测到1次的序列。利用USEARCH (版本10.0)软件对所有样品的Tags进行聚类,默认以97%的一致性(Identity)将序列聚类成为可操作分类单元(Operational Taxonomic Unit,OTU),得到每个样品的OTU数目,利用Venn图分析样品之间共有、特有的OTU数目,与SILVA的SSUrRNA数据库比对,对其进行物种注释分析。通过α多样性分析,统计各样品在97%相似度水平下的Chao1、Shannon及Simpson指数,研究单个样品内部的物种多样性;通过β多样性分析,根据距离矩阵获得相应距离下的PCoA分析,比较不同样品间的物种多样性差异。
2 结果与分析
2.1 珍珠龙胆石斑鱼和红鳍笛鲷肠道、养殖水体的细菌多样性分析
珍珠龙胆石斑鱼和红鳍笛鲷肠道、养殖水体中的细菌多样性见表2。从表2可以看出,珍珠龙胆石斑鱼和红鳍笛鲷肠道菌群Chao1指数高于养殖水体,表明两种鱼肠道菌群丰度要高于养殖水体。珍珠龙胆石斑鱼肠道Shannon指数在所有样品中最高,Simpson指数在所有样品中最低,表明珍珠龙胆石斑鱼肠道菌群多样性高于其养殖水体和红鳍笛鲷。红鳍笛鲷肠道Shannon指数在所有样品中最低,Simpson指数在所有样品中最高,表明红鳍笛鲷肠道菌群多样性比其养殖水体低。
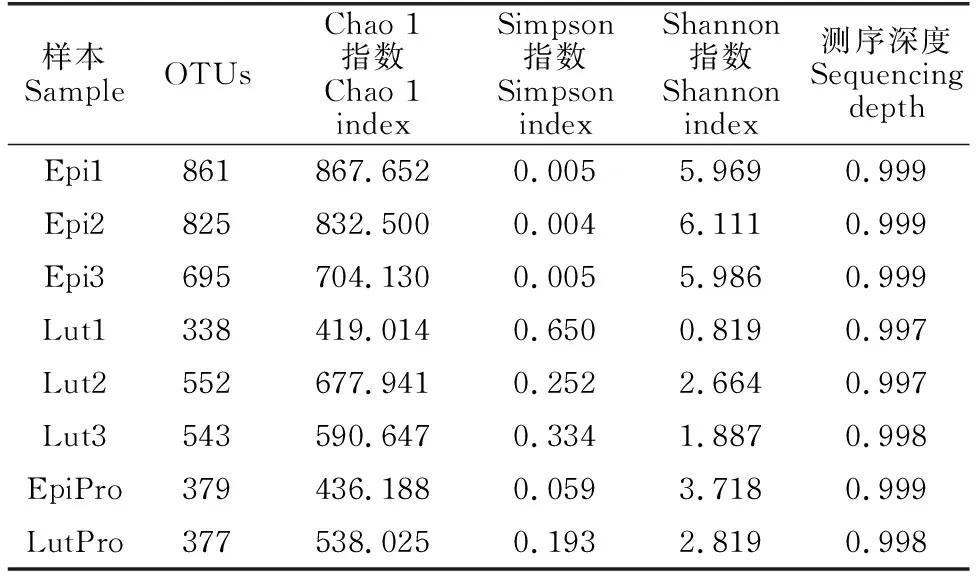
表2 珍珠龙胆石斑鱼和红鳍笛鲷肠道及养殖水体中的细菌多样性
2.2 珍珠龙胆石斑鱼和红鳍笛鲷肠道、养殖池水的细菌相关性分析
所有样品共有的OTUs为72个;珍珠龙胆石斑鱼肠道及其养殖池水共有的OTUs为179个;红鳍笛鲷肠道及其养殖池水共有的OTUs为208个;珍珠龙胆石斑鱼和红鳍笛鲷肠道菌群中的OTUs分别有19.39%和25.68%与其养殖水体中的OTUs一致。珍珠龙胆石斑鱼和红鳍笛鲷肠道中共有的OTUs为696个;珍珠龙胆石斑鱼肠道中有高达75.41%的OTUs与红鳍笛鲷一致(图1)。
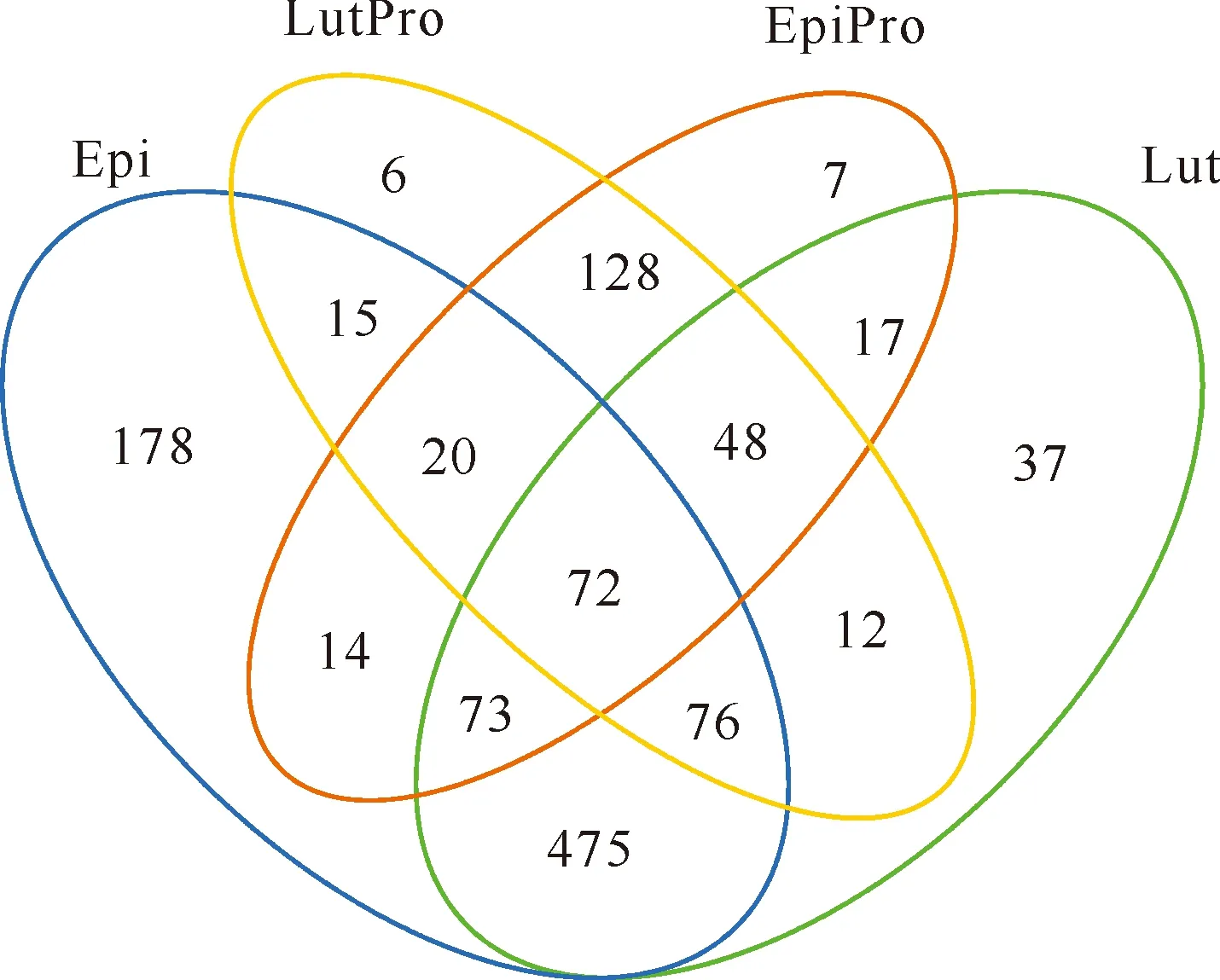
Epi表示珍珠龙胆石斑鱼肠道;Lut表示红鳍笛鲷肠道;EpiPro表示珍珠龙胆石斑鱼养殖池水;LutPro表示红鳍笛鲷养殖池水
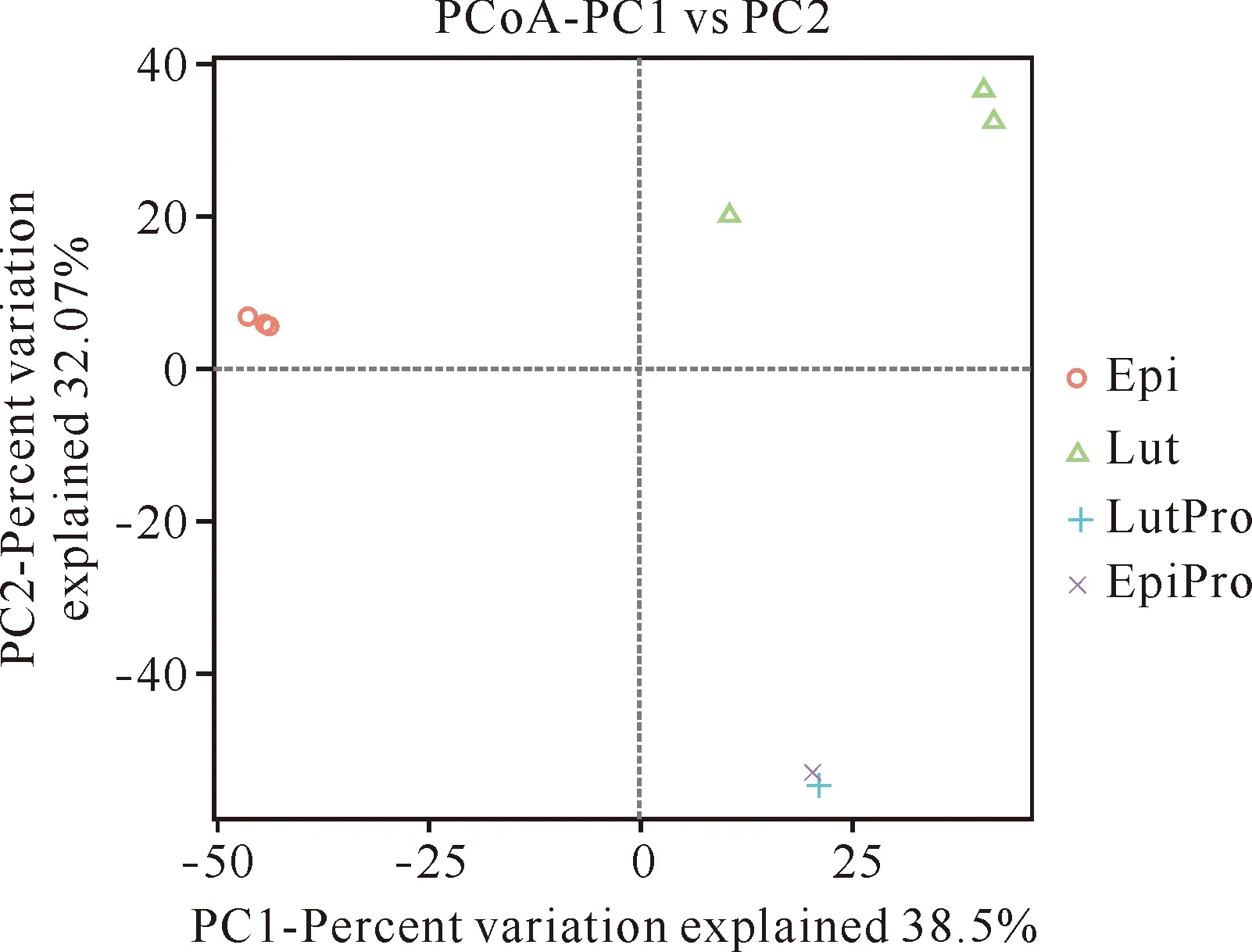
从图2可知,珍珠龙胆石斑鱼和红鳍笛鲷肠道菌群明显分离,珍珠龙胆石斑鱼和红鳍笛鲷肠道微生物与其各自养殖池水体微生物明显分离。珍珠龙胆石斑鱼和红鳍笛鲷肠道菌群的相似性要高于二者与其各自养殖水体中细菌的相似性。
2.3 珍珠龙胆石斑鱼和红鳍笛鲷肠道细菌群落组成及相对丰度
在门分类水平上,珍珠龙胆石斑鱼肠道中相对丰度较高的细菌门类为厚壁菌门、变形菌门、拟杆菌门、放线菌门和酸杆菌门,平均相对丰度分别为32%、28%、13%、8%和7%。红鳍笛鲷肠道中优势菌群为变形菌门和疣微菌门,平均相对丰度为73%和3%。珍珠龙胆石斑鱼和红鳍笛鲷肠道中共有的细菌门类为变形菌门,但相对丰度差异较大(图3)。
Epi表示珍珠龙胆石斑鱼肠道;Lut表示红鳍笛鲷肠道;EpiPro表示珍珠龙胆石斑鱼养殖池水;LutPro表示红鳍笛鲷养殖池水
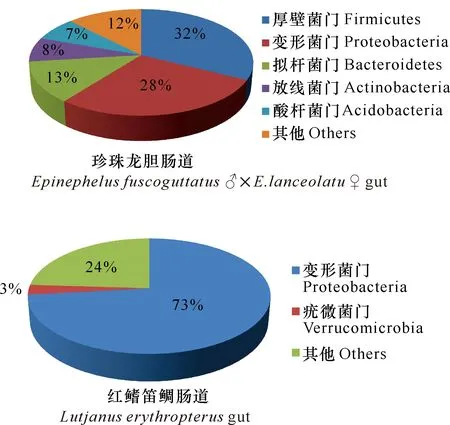
图3 基于门分类水平的珍珠龙胆石斑鱼和红鳍笛鲷肠道细菌群落组成和相对丰度
从图4可以看出,珍珠龙胆石斑鱼肠道中优势细菌为梭菌纲、α-变形菌纲、γ-变形菌纲、拟杆菌纲和杆菌纲,相对丰度分别为24%、12%、9%、8%和6%。红鳍笛鲷肠道排名前3的细菌为δ-变形菌纲、γ-变形菌纲和α-变形菌纲,相对丰度分别为54%、12%和7%。由纲分类水平可知,珍珠龙胆石斑鱼和红鳍笛鲷肠道中α-变形菌纲和γ-变形菌纲的相对丰度类似。
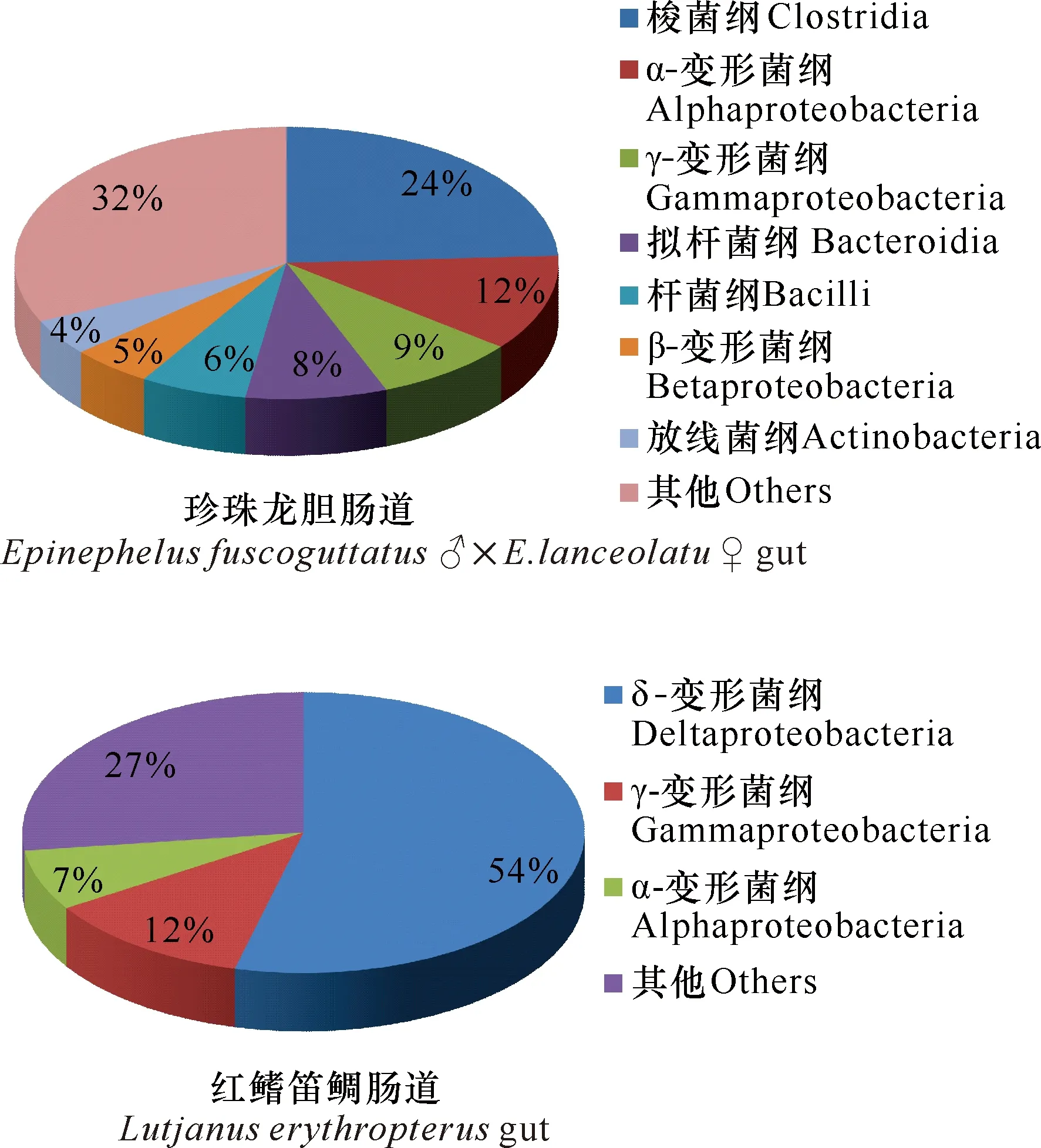
图4 基于纲分类水平的珍珠龙胆石斑鱼和红鳍笛鲷肠道细菌群落的组成和相对丰度
从图5可知,在科分类水平上,珍珠龙胆石斑鱼优势细菌为真杆菌科、毛螺菌科、疣微菌科、鞘脂单胞菌科、乳酸杆菌科和Bacteroidales_S24_7_group,相对丰度分别为9%、8%、6%、4%、4%和4%。红鳍笛鲷肠道中优势细菌为脱硫弧菌科、弧菌科和红杆菌科,相对丰度分别为54%、10%和5%。珍珠龙胆石斑鱼和红鳍笛鲷中优势细菌在科分类水平上完全不一致。

图5 基于科分类水平的珍珠龙胆石斑鱼和红鳍笛鲷肠道细菌群落组成和相对丰度
3 讨论
3.1 珍珠龙胆石斑鱼和红鳍笛鲷肠道及其养殖水体菌群多样性分析
前人研究结果表明,水产养殖动物肠道菌群多样性要低于其养殖环境,如半滑舌鳎(Cynoglossussemilaevis)、大菱鲆(Scophthalmusmaximus)、拟穴青蟹(Scyllaparamamosain)和克氏原螯虾(Procambarusclarkii)肠道菌群多样性均比养殖水体或底泥中低[9-12]。但本研究出现不同的结果,从α多样性指数可以看出,珍珠龙胆石斑鱼和红鳍笛鲷肠道菌群丰度要高于其养殖水体中的细菌,且前者肠道菌群多样性同样高于养殖水体。这可能是因为前人研究的养殖环境都是在网箱或池塘等自然生境中[9-12],本研究是工厂化循环水养殖,水体要经过紫外杀菌处理后才流回养殖池,相比自然环境,工厂化循环水养殖环境中的细菌更少。另外,珍珠龙胆石斑鱼肠道中Chao1指数和Shannon指数都比红鳍笛鲷高,同时Simpson指数比红鳍笛鲷低,表明珍珠龙胆石斑鱼肠道细菌丰度和细菌多样性均比红鳍笛鲷高,这种差异可能与宿主的遗传因素有关。
3.2 珍珠龙胆石斑鱼和红鳍笛鲷肠道及其养殖水体菌群相关性分析
张琛等[13]发现海水网箱养殖的花鲈(Lateolabraxjaponicus)和日本黄姑鱼(Nibeajaponica)之间肠道细菌的相似性高于花鲈或日本黄姑鱼肠道细菌与其养殖网箱内海水细菌的相似性。同样地,近岸网箱养殖大黄鱼(Larimichthyscrocea)和黑鲷(Sparusmacrocephalus)之间肠道细菌的相似性高于其与海水细菌的相似性[14]。本研究中珍珠龙胆石斑鱼和红鳍笛鲷肠道菌群中分别有19.39%和25.68%的OTUs与其养殖水体一致,珍珠龙胆石斑鱼肠道中有75.41%的OTUs与红鳍笛鲷一致。同时通过β多样性分析也显示,珍珠龙胆石斑鱼和红鳍笛鲷肠道菌群的相似性要高于二者与其各自养殖水体中细菌的相似性。因此,本研究表明在同一个养殖环境下两种鱼肠道微生物之间的相似性要比其与养殖水体中的细菌相似性高,工厂化循环水养殖水体对鱼类肠道菌群的影响有限。有研究表明水体中的菌群会直接影响养殖鱼类消化道中的微生物组成[15,16],但随着新技术的发展,近年来越来越多的研究表明养殖水体中的细菌和鱼类肠道菌群相关性不大:池塘养殖半滑舌鳎的消化道菌群和池水中的细菌明显不同,几乎没有相关性[9];健康大菱鲆幼鱼肠道与养殖水体共有的OTU数目为0[17]。
3.3 珍珠龙胆石斑鱼和红鳍笛鲷肠道优势菌群分析
鱼菜共生模式下养殖的不同食性鲤科鱼类肠道微生物优势菌群的组成十分相似[18]。湖泊养殖食性相同的草鱼(Ctenopharyngodonidellus)和团头鲂(Megalobramaamblycephala)消化道微生物群落组成不存在显著差异[19]。养殖池塘中不同种类鱼类肠道细菌结构存在较大差异,认为食性对鱼类肠道细菌群落的影响可能大于栖息水层[20]。同一室内饲养的银鲫(Carassiusauratusgibelio)和异育银鲫(Carassiusauratusgibeliovar.CASⅢ)肠道菌群结构相似,但斑点叉尾鮰(Ictaluruspunctatus)与二者有较大差异,认为该差异受鱼类基因型的影响更大[21]。本研究进一步从优势菌群来比较珍珠龙胆石斑鱼和红鳍笛鲷肠道菌群的差异。由结果可知,虽然珍珠龙胆石斑鱼和红鳍笛鲷肠道优势菌群在门和纲的分类水平上有部分一致,但在更小的分类阶元科水平上完全不同,这可能与鱼饲料差异有关。珍珠龙胆石斑鱼饲料中的粗蛋白质含量比红鳍笛鲷饲料中的粗蛋白质含量高8%,粗脂肪含量高2%(表1),其肠道优势菌群中的厚壁菌门和拟杆菌门有利于肠道对营养物质的转换和吸收[22]。红鳍笛鲷肠道中变形菌门为绝对优势菌群,变形菌门含量过高不利于肠道微生态平衡[23]。
Zhang等[14]发现网箱养殖且投喂相同饲料的大黄鱼和黑鲷肠道优势菌群无论是从门分类水平上还是属分类水平上皆不同。有学者认为肠道微生物更依赖于宿主的遗传背景和免疫反应[24],如不同生境草鱼消化道主要微生物群落组成基本相同,不具有生境特异性[19]。目前还未见有关红鳍笛鲷肠道菌群的报道,但对珍珠龙胆石斑鱼肠道菌群有不少研究。朱旭枫等[25]对珍珠龙胆石斑鱼肠道菌群的研究结果表明,基础饲料组变形菌门含量达到99.13%以上。丛林梅等[7]发现投喂商品饲料的珍珠龙胆石斑鱼幼鱼肠道菌群以变形菌门(61.43%)、拟杆菌门(11.30%)和厚壁菌门(13.61%)为主。麦浩彬等[22]发现投喂不同水平饲料蛋白质的珍珠龙胆石斑鱼幼鱼肠道优势菌群为变形菌门(27.72%-45.46%)、放线菌门(20.50%-45.20%)、厚壁菌门(11.58%-29.55%)和拟杆菌门(3.21%-13.56%)。本研究中珍珠龙胆石斑鱼肠道优势菌群为厚壁菌门(32%)、变形菌门(28%)、拟杆菌门(13%)。以上研究结果表明,珍珠龙胆石斑鱼肠道优势细菌主要有变形菌门、厚壁菌门和拟杆菌门,但不同研究中各门的相对丰度差异较大。综上,影响鱼类肠道微生物组成和丰度的因子繁多,包括物种、个体不同发育阶段、饲料、水环境因子、水体微生物群落以及养殖模式等[26],有待更深入研究。
4 结论
工厂化循环水养殖的珍珠龙胆石斑鱼和红鳍笛鲷肠道菌群丰度要高于其各自养殖水体中的细菌,珍珠龙胆石斑鱼肠道菌群丰度和菌群多样性高于红鳍笛鲷。珍珠龙胆石斑鱼和红鳍笛鲷肠道微生物之间的相似性要高于其与各自养殖水体中的相似性。工厂化循环水养殖的两种鱼类肠道中虽然大部分细菌种类一致,但关键的优势菌群均不同,养殖水体细菌对鱼类肠道菌群的影响有限。
