漆酶/TEMPO体系氧化壳寡糖的制备及其抗脂质氧化效果的研究*
2022-05-09唐延东杨晓莉潘玙璠张方东侯庆喜裴继诚
唐延东,杨晓莉,潘玙璠,张方东,侯庆喜,裴继诚
(天津科技大学 轻工科学与工程学院,天津市制浆造纸重点实验室,天津 300457)
0 引 言
自由基是一种在光热等外界条件下,共价键发生均裂而形成的具有不成对电子的原子或基团,其广泛存在于自然界之中[1]。其中活性氧(reactive oxygen species,ROS)是一类化学性质活泼的自由基的总称[2]。ROS有较高的氧化活性,会使机体的代谢产生失衡。脂质过氧化作用是典型的自由基链式反应,一般表现为不饱和脂肪酸的氧化变质。这些脂肪酸在自由基作用下生成自由基中间产物L·,然后与O2反应形成脂质过氧自由基LOO·,后者与另一脂质作用形成脂质过氧化物LOOH。这些脂质过氧化物可以自发分解,形成更多的自由基来攻击脂类的双键,产生更多的脂质过氧自由基,并依次传递下去,形成自动分解的链式反应,造成更大的破坏[3]。
脂质过氧化反应造成的危害越来越多的被研究学者所发现,比如脂质氧化产物会直接参与细胞衰亡的信号传导,导致人体衰老[4];脂质过氧化反应也是诱发动脉粥样硬化[5]、糖尿病[6]、恶性肿瘤[7]等疾病的重要原因。除去不适用于人体的人工抗氧化剂以外,目前还发现了多种具有抗氧化功效的天然物质,如维生素、多酚类、天然黄酮类、阿魏酸等[8],但它们都存在着不稳定、成本高、不易吸收、容易失活等缺点。因此,寻找一种合适的、高效的外源抗氧化剂,在维持机体平衡上变得尤为重要。
壳寡糖(chitosan oligosaccharide,COS)是来源于虾蟹壳的壳聚糖降解成的带有氨基的小分子寡糖,是世界上最丰富的可再生资源之一[9]。其具有诸多优良的生物活性,如分子量小、溶解性高、生物活性高、人体易吸收等。鉴于其具有的优良性能,不断涌现出新的壳寡糖的改性方法,其中化学改性方面的研究居多,有羟基化、烷基化、交联化、接枝化以及羧基化等改性方向[10-11]。现有研究可以证明,COS及其改性的衍生物具有一定的抗氧化作用[12-13]。
漆酶/TEMPO体系可以选择性地将壳寡糖C6位上的羟基氧化为醛基进而氧化为为羧基,得到含有羧基的氧化壳寡糖(C-COS)[14-15]。近年来,本课题组对于C-COS的制备进行了一系列研究[16],并证明其具有良好的保湿性[17]、抗黑色素沉积[18]及抗菌性能[19]。亚油酸(linoleic acid)和卵磷脂(lecithin)是人体中多不饱和脂肪酸(PUFA)的代表,亚油酸是一种ω-6多不饱和脂肪酸,是人体生长发育的必需脂肪酸;以卵磷脂为代表的磷脂构成了机体细胞膜50%左右的脂质,这些磷脂是维持生命活动的基础物质。脂质过氧化的发生,意味着多不饱和脂肪酸上不饱和键的破坏。本文通过一种绿色化学的方法制备出C-COS,使其分子结构中C6位含有羧基,选取亚油酸和卵磷脂作为实验对象,进行自由基诱导的体外脂质氧化实验来验证C-COS的抗脂质氧化能力,目的是寻找一种安全的、稳定的,对脂质过氧化反应具有良好抑制效果的材料。
1 实 验
1.1 材料与仪器
漆酶,酶活1072 U/mL,由诺维信生物技术有限公司提供;2,2,6,6-四甲基哌啶-1-氧基(TEMPO),购于Sigma公司;壳寡糖,相对分子质量≈1000,脱乙酰度为90.5%,购于上海源叶生物科技有限公司;蛋黄卵磷脂,水分≤5%,购于Solarbio公司;亚油酸,含量≥95%;其他试剂均为分析纯,购于麦克林试剂网。
旋转蒸发仪,型号N-1100,京东理化;傅里叶变换红外光谱仪,型号VERTEX 70,德国布鲁克公司;自动电位滴定仪,型号AT-510,日本京都电子工业株式会社;核磁共振波谱仪,型号AVANCE Ⅲ,德国布鲁克公司;紫外分光光度计,型号UV-2550,日本岛津公司。
1.2 羧基化壳寡糖(C-COS)的制备及表征
将0.08 g(2%)的TEMPO放入200 mL, pH值为4.7的乙酸-乙酸钠溶液中,加入4 g壳寡糖充分搅拌,使其溶解均匀。在30 ℃的恒温条件下使其稳定10 min后,加入400 μL漆酶至溶液中,在30 ℃下通氧反应18 h。通氧结束后,用稀NaOH溶液将反应体系调整至中性,通过旋转蒸发仪浓缩至10~20 mL,加入400 mL无水乙醇并不断搅拌,待静置分层后反应产物析出。利用真空抽滤得到反应物滤渣,加入蒸馏水重复以上操作3次以充分醇洗、水洗产物。最后,将得到的滤渣在真空干燥箱内烘干72 h,经研磨后得到制备好的羧基化壳寡糖。最后将制得的样品通过FT-IR、13C NMR和电导滴定检测,确认COS成功被选择性氧化[16,18]。
1.3 对脂肪酸进行自由基诱导的氧化
取一定量蛋黄卵磷脂,加入0.01 moL/L, pH 值为7.4 PBS缓冲液,搅拌使其溶解成20 mg/mL的溶液。将溶液超声乳化1 min,形成卵磷脂脂质体,低温下保存备用。
1.3.1 羟基自由基对脂肪酸的氧化
羟基自由基是一种最常见、破坏性最强的自由基。分别取2 mL卵磷脂脂质体和2 mL亚油酸(溶于无水乙醇),实验组分为两组,均先加入1 mL、6 mmoL/L的FeSO4溶液和1 mL、6 mmoL/L的H2O2溶液,再分别加入2 mL、5 mg/mL的COS和C-COS溶液混匀;空白组加入等量的蒸馏水,使3组样品在37 ℃水浴锅内避光温浴氧化1 h[20]。将氧化后萃取出反应体系中的脂肪酸成分,后经过旋转蒸发得到氧化后的对比组。
1.3.2 AAPH自由基对脂肪酸的氧化
AAPH是一种在有氧条件下,热分解形成的过氧脂质自由基。分别取2 mL卵磷脂脂质体和2 mL亚油酸(溶于无水乙醇),氧化组加入2mL 0.1 moL/L AAPH启动氧化反应。实验组分别加入2 mL COS和C-COS溶液(5 mg/mL),37 ℃避光温浴1 h,空白组加入等体积的蒸馏水。萃取过程同上,得到经过AAPH自由基氧化后的对比组。
1.3.3 Cu2+自由基对脂肪酸的氧化
过渡金属元素都是重要的脂质氧化参与者,一些过渡金属离子可以作为电子传递体发挥作用,其可以等同于自由基进行反应。分别取2 mL卵磷脂脂质体和2 mL亚油酸(溶于无水乙醇),氧化组加入2 mL 0.1 mmoL/L醋酸铜溶液启动氧化反应。实验组分别加入2 mL COS和C-COS溶液(5 mg/mL),37 ℃避光温浴1 h,空白组加入等体积的蒸馏水。萃取过程同上,得到经过Cu2+氧化后的对比组。
1.4 脂肪酸氧化产物的检测
1.4.1 共轭二烯含量的检测
共轭二烯是脂质过氧化反应生成的初级产物,将1.3实验中两种脂肪酸在3种自由基氧化后的各实验组样品经过乙醇稀释后,以乙醇为参比溶液用紫外分光光度计在234 nm测量样品的吸光度,双键浓度可用摩尔浓度因数计算求得(双键的摩尔吸光率为3.0×104L/(moL·cm))[21-22],并计算其抑制率。
共轭二烯生成抑制率(%)=(A2-A1)/A0×100%
(1)
式中:A0为脂肪酸原样的吸光度;A2为对比组脂肪酸吸光度;A1为各样品组的脂肪酸吸光度。为了避免实验误差,式中均减去了COS和C-COS样品本身的吸光度,并且每组实验测量3次,取得最后的平均值。同时设置空白对照组来消除乙醇对自由基捕获作用造成的影响,下同。
1.4.2 丙二醛含量的检测
丙二醛是脂质过氧化反应的次级产物,具有很高的危害性,其含量也代表了脂质过氧化反应的进程。取1.3实验中所得的样品溶于乙醇中,加入2 mL TCA-TBA-HCL混合溶液,沸水浴15 min,经过冰浴后用紫外分光光度计在532 nm测量样品的吸光度。(MDA的摩尔吸光率为1.56×105L/(moL·cm))[23-24],并计算其抑制率。
丙二醛生成抑制率(%)=(A2-A1)/A0×100%
(2)
1.4.3 过氧化物含量的检测
油脂氧化后会生成氢过氧化物,它可以将碘化钾溶液还原成碘,采用硫代硫酸钠溶液滴定析出的碘单质来比较不同亚油酸氧化后产生的过氧化值。取1.3实验中所得的样品,称量后置于250 mL碘量瓶中,加入30 mL三氯甲烷-冰乙酸混合液(2∶3),溶解样品后加入1 mL饱和碘化钾溶液于暗处静置3 min。再加入30 mL蒸馏水后摇匀,滴加1 mL淀粉指示液(10 g/L),立即用前先已经精准标定好的硫代硫酸钠标准溶液(0.10 mol/L)滴定至蓝紫色消失。同时取用相同量的试剂,用水做空白试验。
过氧化物的含量按式(3)计算:
X=(V1-V2)×c×0.1269/m
(3)
式中:X为过氧化值,g/100g;V1为消耗的硫代硫酸钠溶液体积;V2为空白组消耗的硫代硫酸钠溶液体积;c为硫代硫酸钠溶液浓度;m为样品质量;0.1269为1 mL、1 mol/L硫代硫酸钠溶液相当的碘的质量。
1.5 脂肪酸氧化后结构检测
1.5.1 红外光谱(FI-IR)检测
选取氧化程度最强的自由基来催化两种脂肪酸的氧化,对两种脂肪酸的原样组,对比样组、C-COS组的官能团变化进行分析。取适量反应后的亚油酸和卵磷脂涂到傅里叶变换红外光谱仪的ATR检测台上,以空气为采样背景,扫描范围为400~4 000 cm-1,分辨率为4 cm-1,扫描32次。
1.5.2 核磁共振氢谱(1H NMR)检测
将1.5.1实验中两种脂肪酸的原样组,对比样组、C-COS组进行1H NMR检测。两种油样均以氘代氯仿为溶剂,采用30°脉冲序列,采样时间定为1.36 s,弛豫时间是1.89 s,累计扫描次数为1 024次。
2 结果与讨论
2.1 C-COS抑制脂质氧化性能检测
2.1.1 生成共轭二烯含量的检测
共轭二烯是脂质过氧化反应的初级产物,在亚油酸和卵磷脂启动氧化后分别加入COS和C-COS,检测共轭二烯产生量的变化情况,考察COS和C-COS的抗脂质氧化能力,其结果如图1所示。
由图1可以看到,羟基自由基对两种脂肪酸氧化程度最强,产生的共轭二烯含量最高。通过对比COS组和C-COS组的检测可以看出,两个实验组产生的共轭二烯含量均有所下降,代表着其初级产物减少,说明COS和C-COS均可对自由基诱导的氧化进行抑制。经计算,C-COS相较于COS对亚油酸被自由基催化生成共轭二烯的抑制率分别提高了54%、7%、42%,对卵磷脂的抑制率分别提高了54%、38%、26%。

图1 羟基自由基、AAPH自由基和Cu2+离子氧化亚油酸(a)和卵磷脂(b)产生的共轭二烯含量Fig 1 Amount of conjugated dienes produced by oxidation of linoleic acid and lecithin by hydroxyl radical, AAPH radical, and Cu2+ ion
2.1.2 生成丙二醛含量的检测
丙二醛是脂质过氧化反应的次级产物,在亚油酸和卵磷脂启动氧化后分别加入COS和C-COS,检测丙二醛产生量的变化情况,考察COS和C-COS的抗脂质氧化能力,其结果如图2所示。
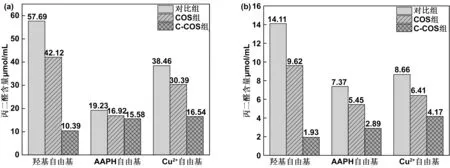
图2 羟基自由基、AAPH自由基和Cu2+离子氧化亚油酸(a)和卵磷脂(b)产生的丙二醛含量Fig 2 Amount of malondialdehyde produced by oxidation of linoleic acid and lecithin by hydroxyl radical, AAPH radical, and Cu2+ ion
由图2可以看出,羟基自由基氧化程度最强,其次是铜离子和AAPH自由基。分别加入COS和C-COS后,丙二醛的生成量会有不同程度的降低,丙二醛的含量减少证明了脂质氧化的抑制程度。COS和C-COS对羟基自由基和Cu2+离子的抑制程度最强,经计算,C-COS相较于COS对亚油酸被自由基催化生成丙二醛的抑制率分别提高了55%、7%、36%,对卵磷脂的抑制率分别提高了55%、36%、26%。
2.1.3 不同自由基氧化脂肪酸产生的过氧化值比较
过氧化值是脂肪酸被氧化程度的一种测量指标。在亚油酸和卵磷脂启动氧化后分别加入COS和C-COS,检测过氧化值的变化情况,考察COS和C-COS的抗脂质氧化能力,其结果如图3所示。
由图3可以看出,C-COS组相比于COS组,其过氧化值均有下降,对脂肪酸产生过氧化物的抑制效果均有提升,但主要在羟基自由基提升较为显著。经计算,C-COS相较于COS对亚油酸被氧化产生过氧化值的抑制率分别提高了51%、43%、8%,对卵磷脂的抑制率分别提高了15%、50%、21%。
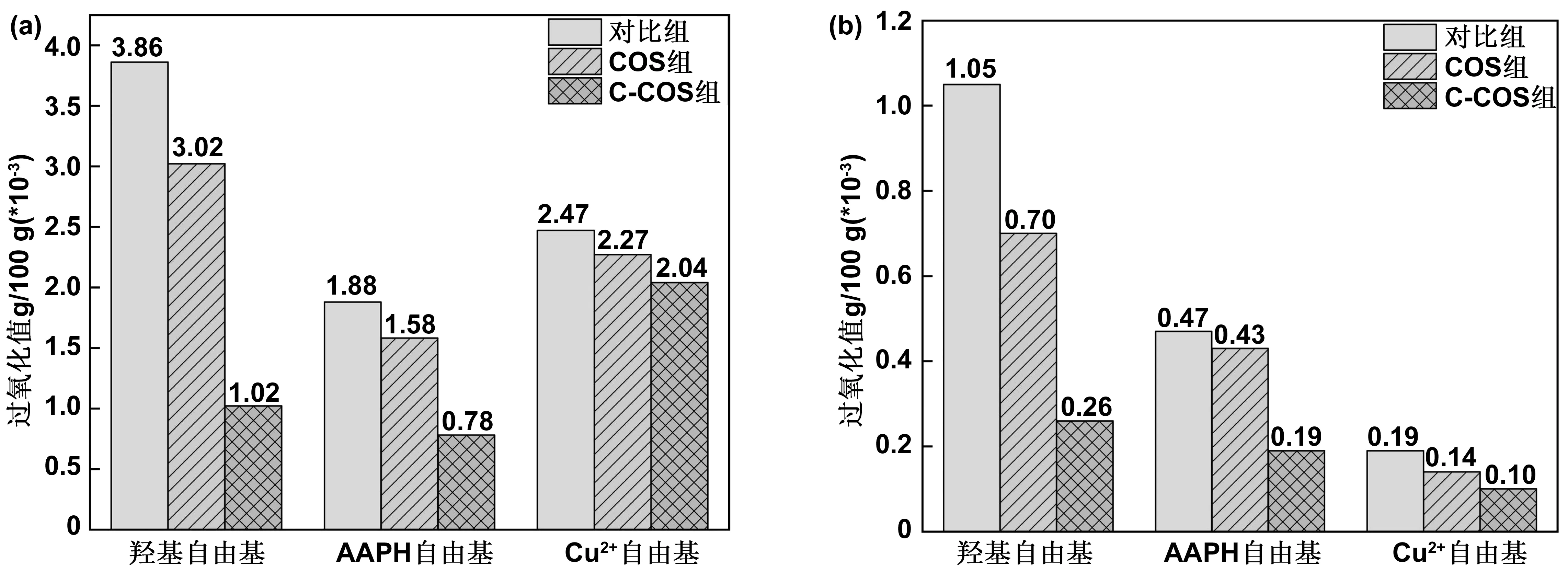
图3 羟基自由基、AAPH自由基和Cu2+离子氧化亚油酸(a)和卵磷脂(b)产生的过氧化值Fig 3 Peroxide values generated from linoleic acid and lecithin oxidized by hydroxyl radical, AAPH radical, and Cu2+ ion
2.2 脂肪酸氧化后结构分析
2.2.1 红外光谱分析
选取氧化效果最强的羟基自由基进行诱导氧化,通过红外光谱分析亚油酸和卵磷脂被氧化前后结构的变化,并与加入C-COS样品后的谱图进行比较,亚油酸和卵磷脂的红外吸收光谱如图4所示。

图4 亚油酸(a)和卵磷脂(b)的FT-IR 图Fig 4 FT-IR spectra of linoleic acid and lecithin
由图4(a)可以看出,亚油酸氧化后,对比样组940 cm-1处出现一个新的峰,为共轭二烯特有的吸收峰。这是亚油酸受到自由基的攻击失去电子而产生的共轭中间形态[25]。1 710 cm-1处羰基的吸收峰增强,这可能是脂质氧化生成的降解产物导致的,如丙二醛(MDA)[26]。在加入C-COS样品后(图4a(c)),1 710处和940 cm-1处的吸收峰强减弱,这印证了2.1.1和2.1.2中的结果,即初级产物和次级产物:共轭二烯和丙二醛的生成量减少,说明加入C-COS后,脂质氧化一定程度上受到抑制。
由图4(b)可以看出,卵磷脂氧化后(图4b(b)),1 556 cm-1处峰强减弱,这是C=C伸缩振动对应的特征峰,推断可能是卵磷脂分子上的不饱和双键受到破坏。1 240 cm-1处峰强减弱,推断可能是卵磷脂分子上P=O键受到了攻击,而C-COS组(图b(c))中C=C键和P=O键吸收峰与对比样相比较原样减弱不大。说明加入C-COS后,卵磷脂的氧化也受到抑制。
2.2.2 核磁共振氢谱分析
为与红外光谱相结合来验证亚油酸和卵磷脂氧化后及加入C-COS结构的变化,采用核磁共振波谱仪进行检测,所得的1H NMR谱图分别如图5和图6所示。

图5 亚油酸的1H NMR图Fig 5 1H NMR spectra of linoleic acid

图6 卵磷脂的1H NMR图Fig 6 1H NMR spectra of lecithin
图5是亚油酸原样的1H NMR谱图。在氧化后,对比样组δ=5.41~5.29(9、10、12、13位置上)的积分由3.64减小到3.42、δ=2.79 (11位置上)的积分由1.77减小到1.61。δ=1.39~1.25(4~7,15~17位置上)的积分由14.03增大到14.14,推测这可能是由于经过氧化进程中,亚油酸分子遭到破坏导致其链的破裂,亚甲基数量增多。同时双键被自由基攻击而破坏,其间的H被俘获,导致其数量减少。而C-COS组9、10、12、13位置和11位置积分分别为3.61和1.75,较对比样组积分有所增大;4~7,15~17位置的峰积分为14.09,较对比样组积分有所减小。说明加入了C-COS后,氧化受到了抑制。
图6是卵磷脂原样的1H NMR谱图。在氧化后,δ=5.36(52~55位置上)的积分值由4.03增大到4.90,而加入C-COS后该处峰的积分值为4.79,较对比组积分有所减小。可以认为是经过氧化后卵磷脂分子上的不饱和双键受到破坏,但C-COS的添加抑制了这一破坏效果,这也印证了上文红外光谱的结果。
2.3 抑制脂质过氧化机理
通过对比各组COS和C-COS的抗脂质氧化实验,发现C-COS抑制脂质过氧化的能力相比COS均有不同程度的增强,推断它们的抑制机理如图7所示。

图7 COS与C-COS对脂质过氧化的抑制机理Fig 7 Inhibitory mechanism of COS and C-COS on lipid peroxidation
从图7中C0S路线可以看出,由于COS中C2位上含有氨基(-NH2),它可以提供电子并捕获自由基,最终生成稳定的大分子自由基(RH)[27]。这解释了COS本身就可以抑制自由基诱导的脂质氧化反应。但经过漆酶/TEMPO体系,COS的C6位羟基被选择性地氧化为羧基(-COO-)而转变为具有更高抗脂质氧化效果的C-COS。即图7中C-C0S路线,羧基一方面具有与过渡金属离子(如Fe2+、Cu2+等)螯合的能力[28],从而避免其催化产生自由基;另一方面螯合作用可以让C2上氨基更多地暴露在糖链外侧,使其更充分地捕获自由基。这两种途径相结合,协同提升了自由基的捕获效率,且C-COS与被氧化底物不饱和脂肪酸形成了竞争机制而起到保护作用。由于自由基的减少,从源头起到了抑制脂肪酸被自由基氧化的程度。
3 结 论
(1)利用漆酶/TEMPO体系选择性的将壳寡糖C6上的羟基氧化成羧基,得到C-COS。通过体外实验法,发现加入C-COS较COS生成的共轭二烯含量、丙二醛含量和过氧化值均有下降,证明了其具有更好的抑制脂质氧化的效果,说明这一新型材料在抗脂质氧化方面有较大的应用价值。
(2)通过FT-IR和1H NMR,检测了亚油酸和卵磷脂被氧化前后结构的变化,并与加入C-COS样品后的谱图进行比较,证实了C-COS的添加可以保护脂肪酸上的不饱和双键,从而抑制其脂质过氧化反应。
(3)根据氨基可以捕获自由基、羧基可以螯合金属离子这两种性质,进一步推断出C-COS有较好抑制效果的原因,说明C6位羧基和C2氨基在清除自由基、减少脂质氧化方面起积极作用。这也为壳寡糖类似结构物质的改性及应用提供了重要思路。
