高、低相对分子质量再生丝素蛋白改性丝素纤维人工血管材料的探究*
2022-05-09于成龙秦金桥关国平TurngLihsheng
于成龙 秦金桥 关国平 Turng Lih-sheng 王 璐
1.东华大学纺织学院,上海 201620;2.东华大学纺织面料技术教育部重点实验室,上海 201620;3.威斯康星大学麦迪逊分校威斯康星探索研究所,麦迪逊 53705,美国
蚕丝作为一种天然的蛋白质材料,在服用领域应用已有几千年的历史。近年来,蚕丝由于优异的生物力学性能和生物可降解性能,在生物医用领域逐渐为人们所重视[1-4]。丝素蛋白是蚕丝的主要组成部分,其质量约占蚕丝质量的70%~80%;其生物相容性较好,可生物降解,且降解周期可控;其在生物医用材料领域的应用形式多种多样,如薄膜、水凝胶或静电纺丝膜等[5-7]。此外,丝素蛋白可独立作为一种生长因子用于改性材料,或与其他生长因子、细胞因子共价结合,用于改性生物材料,调控细胞行为[8-12]。不同的制备方式可获得不同相对分子质量的再生丝素蛋白。有研究表明,相对分子质量会影响再生丝素蛋白的可降解性、可纺性、水溶性、力学性能和生物相容性等[13-16]。故再生丝素蛋白相对分子质量的大小是影响其应用范围和使用价值的重要因素。
当今社会,心血管疾病威胁着人类的生命和健康。人工血管的移植替换是治疗心血管疾病的一种有效方式。有研究证实,真丝管状机织物可作为一种小口径人造血管材料用于血管的移植替换[17-18]。Enomoto等[19]研究表明,改性的丝素纤维人工血管材料在移植到小鼠腹主动脉一年后,其通畅率保持在85%,远高于ePTFE人工血管;Ding等[20]利用蚕丝编织管,并结合硫化丝素蛋白工艺,制备出三层小口径组织工程血管支架,并发现此支架的力学性能、血液相容性和细胞相容性均优异。但也有研究表明,含丝胶的蚕丝纤维材料不利于内皮细胞的黏附与生长[21],同时其与血液直接接触会刺激血小板的分化,造成凝血和血栓的形成[22-23]。因此,对丝素纤维材料进行改性处理,提高其生物相容性,具有非常重要的意义。
低温等离子体处理是一种常用的材料改性方法,其利用高速运动的粒子轰击材料表面,使材料表面分子发生电离或裂解,从而达到材料改性的目的[24]。低温等离子体处理仅作用于材料表层,工艺简单,且处理后无化学试剂残留,适用于对生物医用材料进行活化和改性处理,以改善材料的生物相容性、调控材料的亲疏水性[25]。
本文先对真丝平纹织物脱胶后得到丝素纤维人工血管材料进行低温等离子体处理,增加材料表面极性基团的数量,再通过化学偶联剂1-(3-二甲基氨基丙基)-3-乙基羰二亚胺(EDC·HCl)和N-羟基琥珀酰亚胺(NHS),将采用尿素脱胶制备的高相对分子质量再生丝素蛋白(HRSF)和采用质量分数为0.5%的碳酸钠溶液脱胶制备的低相对分子质量再生丝素蛋白(LRSF)[26-28]分别接枝到低温等离子体处理的丝素纤维人工血管材料表面,以期得到力学性能优异、生物相容性良好的改性丝素纤维人工血管材料,以期为丝素纤维人工血管的开发与制备提供参考。
1 试验部分
1.1 主要材料与仪器
真丝平纹织物,经密为800根/(10 cm),纬密为600根/(10 cm),上海丝绸总公司;桑蚕蚕茧,上海丝绸总公司;无水碳酸钠(Na2CO3),分析纯AR,上海凌峰化学试剂有限公司;尿素,分析纯AR,国药集团;溴化锂(LiBr),分析纯AR,上海麦克林生化科技有限公司;氦气(He),分析纯,上海浦江特种气体有限公司;牛血清白蛋白(BSA),分析纯AR,美国Thermo Fisher Scientific公司;PBS缓冲液,自制;抗凝兔血,内含0.109 mol/L枸橼酸钠抗凝剂,自取;胎牛血清(FBS),美国Thermo Fisher Scientific公司;人脐静脉内皮细胞(HUVEC),中国科学院细胞所;Cell Counting Kit-8 (CCK-8试剂盒),上海翊圣生物科技有限公司。
HD-300低温等离子体处理仪(常州中科常泰等离子体科技有限公司);JAC-4020P超声波清洗机(韩国KODO公司);TM3000台式扫描电子显微镜(日本日立公司);OCA15EC接触角测量仪(德国Dataphysics公司);HD-10厚度测量仪(沧州连峰试验仪器厂);Nicolet 6700傅里叶红外拉曼光谱仪(美国Thermo Fisher Scientific公司);YG(B)026 h-500医用纺织品多功能强力仪(温州市大荣纺织有限公司);CO2恒温培养箱(美国Thermo Fisher Scientific公司)。
1.2 试验方法
1.2.1 真丝平纹织物的脱胶处理
考虑到脱胶处理对丝素纤维人工血管材料力学性能的影响,本文优选采用文献[28]中的脱胶方法,即先将真丝平纹织物裁剪成10 cm×10 cm的尺寸,按1∶100的浴比置于质量分数为0.5%的Na2CO3溶液中煮沸处理30 min,之后取出织物,用去离子水冲洗,直至其表面无黏腻感。重复上述脱胶步骤3次,以提升真丝平纹织物的脱胶效率。随后在60 ℃的烘箱中烘干织物,并放入恒温恒湿室内调湿备用。
真丝平纹织物脱胶后得到的丝素纤维人工血管材料命名为SFF。
1.2.2 低温等离子体处理
本课题组前期的研究[29]表明:相同试验条件下,He低温等离子体处理对真丝织物的表观形貌、结晶结构和力学性能等影响较小,同时还可以显著提升织物表面的亲水性;此外,He低温等离子体处理可以提高丝素纤维人工血管材料表面极性基团的密度,为下一步接枝再生丝素蛋白提供更多的结合位点。因此,本试验确定选用He为低温等离子体处理气体,同时根据前期的研究成果,确定最优处理工艺为处理时间180 s、放电功率70 W、处理体系真空度50 Pa。
He低温等离子体处理后的SFF命名为He-SFF。
1.2.3 高、低相对分子质量再生丝素蛋白溶液的制备
高相对分子质量再生丝素蛋白(HRSF)溶液的制备:将除去杂质的蚕茧剪成小块,按1∶30的浴比将其置于8.0 mol/L的尿素溶液中,100 ℃处理3 h,去离子水清洗干净后得到无黏腻感的丝素纤维,再将丝素纤维置于60 ℃的烘箱中烘干,调湿备用;随后,按1∶10的浴比将一定量的丝素纤维置于9.3 mol/L的LiBr溶液中,室温(25 ℃)下搅拌至溶液中固体纤维完全溶解;将溶解纤维的溶液置于截留相对分子质量在8 000~14 000的透析袋中,去离子水透析3 d,且每6 h更换去离子水一次,透析后即得到HRSF溶液,其质量分数约为3.3%。利用质量分数为30.0%的聚乙二醇(相对分子质量为20 000)溶液可获得相对高质量分数的HRSF溶液,利用双蒸水稀释可获得相对低质量分数的HRSF溶液。
低相对分子质量再生丝素蛋白(LRSF)溶液的制备:将除去杂质的蚕茧剪成小块,按1∶50的浴比将其置于质量分数为0.5%的Na2CO3溶液中,100 ℃处理30 min,去离子水清洗干净;重复该脱胶过程3次;将洗净的无黏腻感的丝素纤维置于60 ℃的烘箱中烘干,调湿备用;随后,按1∶10的浴比将一定量的丝素纤维置于9.3 mol/L的LiBr溶液中,90 ℃下搅拌至溶液中固体纤维完全溶解;后续透析及质量分数调节步骤与HRSF溶液过程一致。
HRSF溶液和LRSF溶液制备完成后,利用SDS-PAGE凝胶电泳试验测定两者的相对分子质量分布范围。
1.2.4 高、低相对分子质量再生丝素蛋白接枝改性处理
将1,6-己二胺溶于异丙醇中配制出浓度为20 g/L的溶液,再将He-SFF浸入配制的溶液中,37 ℃水浴反应1 h,使He-SFF表面氨基化,为下一步接枝再生丝素蛋白提供反应位点。按照m再生丝素蛋白溶液∶mEDC·HCl∶mNHS=1∶1∶2的要求,将EDC·HCl和NHS粉末溶于再生丝素蛋白溶液中,室温下静置反应15 min,得到活化的再生丝素蛋白溶液。随后,将表面氨基化的He-SFF浸入活化的再生丝素蛋白溶液中,25 ℃条件下反应1 h,取出后用去离子水冲洗,晾干备用。
将接枝HRSF和LRSF的He-SFF分别命名为HRSF-SFF和LRSF-SFF。
2 性能测试与表征
2.1 再生丝素蛋白接枝改性效果表征
为分析再生丝素蛋白相对分子质量和溶液质量分数对接枝改性效果的影响,本文采用扫描电镜法,利用TM3000台式扫描电子显微镜对HRSF-SFF和LRSF-SFF的微观形貌进行表征;采用称取质量的方法,对接枝前后丝素纤维人工血管材料的质量增长率进行定量表征;利用厚度测量仪,对接枝前后丝素纤维人工血管材料表面的厚度进行测量,分析厚度的变化规律及厚度变化的离散程度,间接表征再生丝素蛋白在丝素纤维人工血管材料表面的接枝均匀性;利用超声波对接枝后丝素纤维人工血管材料进行震荡处理,测定并计算再生丝素蛋白的质量损失率,以表征再生丝素蛋白在丝素纤维人工血管材料表面接枝的稳定性。
2.2 接枝改性对丝素纤维人工血管材料性能的影响
2.2.1 基本性能表征
采用Nicolet 6700型傅里叶变换红外光谱仪对接枝前后丝素纤维人工血管材料的化学结构进行分析,扫描波长为500~4 000 cm-1;采用大荣026 G-500型织物强力仪,根据GB/T 528—1998,测试接枝前后丝素纤维人工血管材料的力学性能;采用OCA15EC型水接触角仪,利用气泡捕获法测量接枝前后丝素纤维人工血管材料的水接触角。
2.2.2 蛋白吸附试验
前期研究将牛血清白蛋白(BSA)溶于PBS缓冲液中,配制成浓度为1.0~5.0 mg/L的BSA溶液;使用紫外分光光度计在278 nm波长下,测量不同浓度BSA溶液的吸光度值,并依据结果绘制BSA溶液浓度-吸光度值标准曲线,计算拟合曲线,得到回归函数方程y=0.739 84x-0.046 16,其中R2=0.998 9。
将待测试样裁剪成直径为1.2 cm的圆片,灭菌后将其置于24孔板中,随后加入1 mL浓度为2.5 mg/mL的BSA溶液,浸没试样;再将24孔板整体置于37 ℃的培养箱中培养24 h,测定蛋白吸附试验后的BSA溶液在278 nm波长下的吸光度值,对照BSA溶液浓度-吸光度值标准曲线即可得到蛋白吸附试验后BSA溶液的浓度;最后,根据被测试样的质量和试验前后BSA溶液的浓度,计算出单位质量试样的BSA吸附量。
2.2.3 溶血性试验
先取适量抗凝兔血,在5 000 r/min条件下离心5 min,获取红细胞;再取红细胞1 mL,加入到34 mL的PBS溶液中,混匀后即得到红细胞悬液。将1 mL红细胞悬液加入4 mL双蒸水中制得的混合液作为阳性对照组;将1 mL红细胞悬液加入4 mL PBS溶液中制得的混合液作为阴性对照组。每种待测试样裁剪成1 cm×1 cm尺寸,生理盐水冲洗干净后分别浸入1 mL红细胞悬液和4 mL PBS溶液的混合液中,37 ℃培养箱中放置2 h,将所得的混合液作为试验组。最后,阳性对照组、阴性对照组及试验组均于5 000 r/min条件下离心3 min,取各自上清液,于540 nm波长下测出阳性对照组、阴性对照组及试验组各自的吸光度(kOD阳性对照组、kOD阴性对照组及kOD试验组),并根据式(1)计算待测试样的溶血率(kHR)[30]:
(1)
2.2.4 细胞毒性测试
依据标准ISO 10993-5:2009[31],分别提取SFF、He-SFF、HRSF-SFF、LRSF-SFF 4种材料的浸提液,培养人脐静脉内皮细胞,随后利用CCK-8测量细胞增殖率,评判材料的细胞毒性。
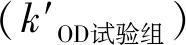
(2)
3 再生丝素蛋白相对分子质量分析
所得HRSF和LRSF的SDS-PAGE图谱如图1所示,两者的相对分子质量均在一定范围内呈连续分布,其中HRSF相对分子质量在117 000~460 000,LRSF相对分子质量小于117 000。相对分子质量的差异说明两种制备方法对丝素蛋白的降解程度不同。随着脱胶时间、脱胶温度和脱胶碱液pH值的增大,丝素蛋白的降解程度随之增大,再生丝素蛋白相对分子质量有不同程度的下降[32-33]。本文中,质量分数为0.5%的碳酸钠溶液的碱性要高于8.0 mol/L的尿素溶液,同时前者对应的溶解温度为90 ℃,高于后者对应的溶液温度(室温)。脱胶碱液pH值和溶解温度的不同使得两种脱胶方法对蛋白分子链的降解和破坏作用存在差异,故再生丝素蛋白的相对分子质量存在明显差异。
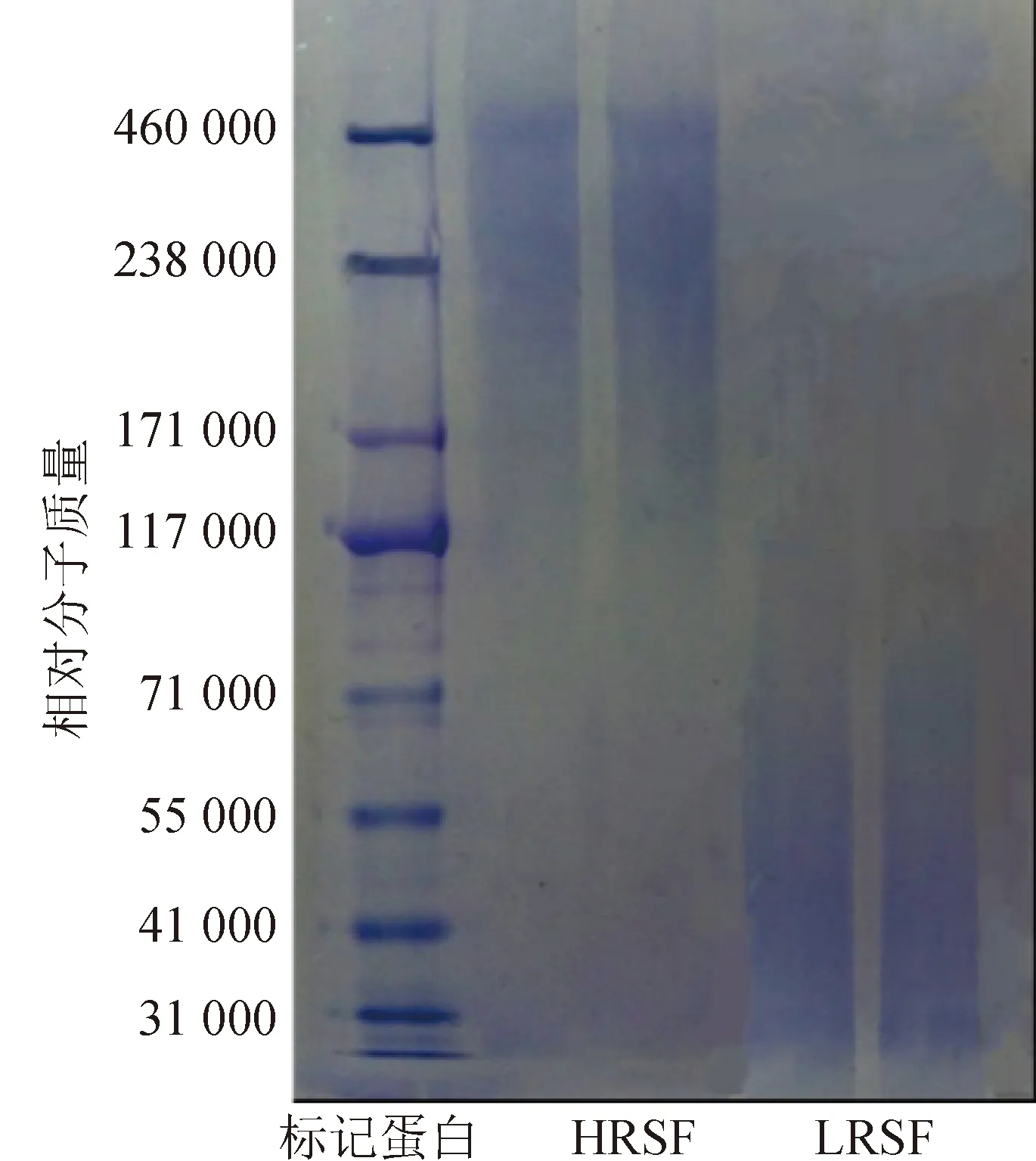
图1 标记蛋白、HRSF和LRSF的SDS-PAGE图像
4 结果与讨论
所有测试数据均表述为“平均值±标准偏差”的形式,并采用单向方差分析(One-way analysis of variance)和LSD检测的方法比较数据之间的显著性差异。当p<0.05(*)时,两组数据之间具有显著性差异。
4.1 再生丝素蛋白接枝改性效果
4.1.1 微观形貌
所得HRSF-SFF和LRSF-SFF的SEM图像如图2所示,选用的再生丝素蛋白溶液质量分数分别为1%、3%、5%及7%,图像放大倍数分别为200和1 000。
从图2可以看出:
(1)HRSF会在丝素纤维人工血管材料表面聚集,形成一层蛋白膜,且高倍图像显示HRSF并未渗透到纤维之间。其中,当接枝的HRSF的质量分数为1%时,材料表面蛋白膜覆盖完整;随着HRSF质量分数的增加,材料表面的蛋白膜出现了破裂(破裂处见图2中红色圆圈处),同时其在材料表面的分布量逐渐减小,并不再完整地覆盖材料表面,原因可能与接枝高质量分数的HRSF后,HRSF会在材料表面堆叠,清洗后有大量蛋白膜脱落有关。

图2 不同质量分数的再生丝素蛋白溶液制备的HRSF-SFF和LRSF-SFF的SEM图像
(2)接枝LRSF后,材料表面都未见完整的蛋白膜,但纱线表面吸附了一层蛋白,且蛋白会渗透到纱线内部。随着LRSF质量分数的提升,纱线及纤维的表面形貌都未见明显变化。
研究表明,再生丝素蛋白的相对分子质量越高,其分子构象越容易向稳定的β-折叠结构转变[34]。此外,本研究在活化HRSF和LRSF溶液的制备过程中,都加入了具有交联作用的EDC·HCl和NHS,加速了再生丝素蛋白分子构象向β-折叠结构的转变。因此推测,接枝HRSF时,EDC·HCl和NHS的存在使丝素蛋白分子间迅速发生交联,并在丝素纤维人工血管材料表面形成了一层稳定的β-折叠结构蛋白膜;而LRSF主要以相对分子质量较小的短肽呈现,交联速度较慢,这使得其需要足够的时间与丝素纤维人工血管材料表面的氨基共价结合并吸附在纱线及纤维表面[35]。
4.1.2 质量增长率
表1归纳了丝素纤维人工血管材料接枝改性后的质量增长率。由表1可以看出:在再生丝素蛋白溶液质量分数相同时,接枝HRSF的质量增长率明显大于接枝LRSF的质量增长率;随着再生丝素蛋白溶液质量分数的增大,接枝HRSF的质量增长率逐渐减小,接枝LRSF的质量增长率逐渐增大,这与图1的SEM图像的结果基本吻合。
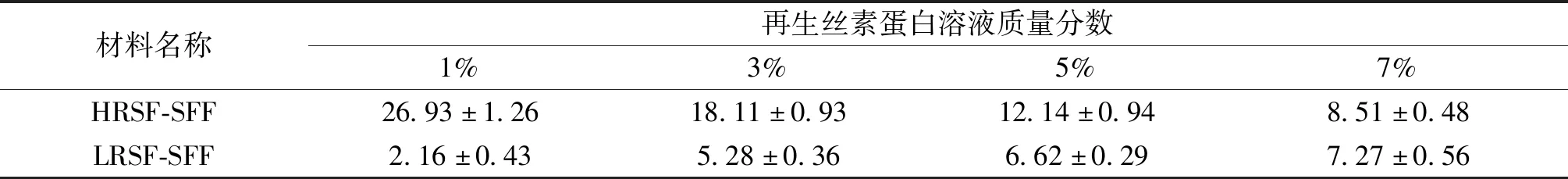
表1 接枝改性后丝素纤维人工血管材料质量增长率 (%)
4.1.3 均匀性
测得SFF的平均厚度为(0.206±0.005)mm,不同再生丝素蛋白溶液质量分数制备的HRSF-SFF和LRSF-SFF的平均厚度及厚度的离散程度(即CV值)见表2。从表2可以看出:对于HRSF-SFF,其平均厚度随着再生丝素蛋白溶液质量分数的增加并无显著性变化(p>0.05),但厚度CV值随着再生丝素蛋白溶液质量分数的增加逐渐变大,说明接枝HRSF的均匀度随再生丝素蛋白溶液质量分数的增加而降低;对于LRSF-SFF,其平均厚度随着再生丝素蛋白溶液质量分数的增加呈显著增大趋势(p<0.05),且厚度的离散程度较小,说明接枝LRSF较接枝HRSF更为均匀。这一现象也与接枝后丝素纤维人工血管材料表面的SEM图像的结果基本吻合。

表2 HRSF-SFF和LRSF-SFF厚度测量结果
4.1.4 稳定性分析
表3归纳了不同再生丝素蛋白溶液质量分数制备的HRSF-SFF和LRSF-SFF超声震荡后的质量损失率。由表3可以得出:超声震荡后,HRSF-SFF的质量损失率大于相同再生丝素蛋白溶液质量分数制备的LRSF-SFF,说明LRSF在丝素纤维人工材料表面的接枝稳定性高于HRSF;同时,随着再生丝素蛋白溶液质量分数的增加,两种接枝改性丝素纤维人工血管材料表面的再生丝素蛋白的质量损失率均逐渐增加。

表3 HRSF-SFF及LRSF-SFF超声震荡后的质量损失率 (%)
4.2 接枝改性对丝素纤维人工血管材料性能的影响
4.2.1 红外光谱
图3所示为SFF、HRSF、LRSF、HRSF-SFF及LRSF-SFF的红外光谱图,可以看出所有试样均具有相似的波峰结构。SFF中酰胺Ⅰ和酰胺Ⅱ的吸收峰位置分别在1 628 cm-1和1 523 cm-1处;冷冻干燥后的HRSF和LRSF中酰胺Ⅰ的吸收峰位置分别在1 652 cm-1和1 645 cm-1处,酰胺Ⅱ的吸收峰位置分别在1 539 cm-1和1 537 cm-1处,分别对应α-螺旋和无规卷曲构象,这与Yin等[36]的研究结果相吻合;再生丝素蛋白接枝后,HRSF-SFF和LRSF-SFF中酰胺Ⅰ的吸收峰位置分别在1 622 cm-1和1 625 cm-1处,酰胺Ⅱ的吸收峰位置分别在1 514 cm-1和1 518 cm-1处,均转变成了β-折叠构象[37],这说明再生丝素蛋白在接枝过程中会发生结构重组,使无规卷曲构象转变成更稳定的β-折叠构象。只是β-折叠构象中存在大量的氢键和疏水性作用键,接枝后材料具有热力学稳定性,且不溶于水。此外,从图3还可以看出,HRSF的β-折叠峰的位置偏移趋势更加明显,说明其结构更加稳定。原因可能在于,丝素蛋白相对分子质量偏小时,蛋白中的小分子肽链多,故分子构象转变困难;丝素蛋白相对分子质量偏大时,蛋白中的大分子肽链多,故分子构象转变容易。这与Zhong等[38]的研究结果相一致。

图3 SFF、HRSF、LRSF、HRSF-SFF及LRSF-SFF的红外光谱图
4.2.2 力学性能
SFF的断裂强度为(18.49±0.58)MPa、断裂伸长率为(12.45±0.32)%、初始模量为(1.20±0.24)MPa。不同质量分数再生丝素蛋白溶液接枝得到的HRSF-SFF及LRSF-SFF的力学性能测试结果见表4。由表4可以看出,接枝再生丝素蛋白后,材料的断裂强度和初始模量较接枝前均有提高。这是因为再生丝素蛋白接枝后,HRSF-SFF纱线及纤维表面形成的蛋白膜填充了纤维间的空隙,这使得材料在受到拉力作用时纤维之间的滑移减小,同时蛋白膜也会贡献一定的强力;对于LRSF-SFF,LRSF渗透到了纱线的内部,使得纤维之间的抱合力增强(图2)。另一方面,HRSF-SFF的断裂伸长率较SFF有所提升,而LRSF-SFF的断裂伸长率较SFF有所下降。造成此现象的原因是,蚕丝纤维的脱胶处理会造成丝素纤维力学性能的下降,接枝HRSF后形成的蛋白膜可以有效覆盖并包裹受损的丝素纤维,使得HRSF-SFF的断裂伸长率高于SFF;而LRSF接枝到丝素纤维的表面后,其对受损丝素纤维的力学性能无显著提升作用,但是接枝后的水洗会对LRSF-SFF的断裂伸长率产生负面作用。
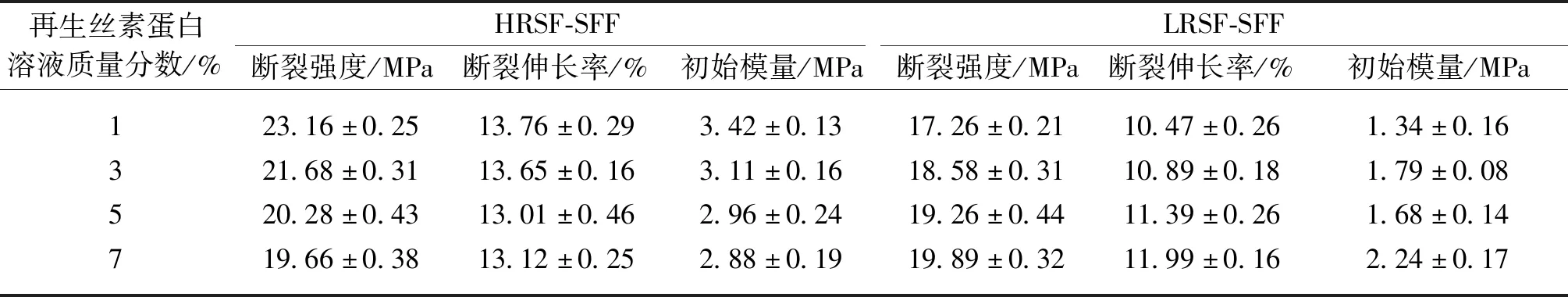
表4 不同质量分数再生丝素蛋白接枝得到的HRSF-SFF及LRSF-SFF的力学性能测试结果
值得注意的是,接枝再生丝素蛋白会使材料的刚度提升、弹性下降,所以接枝再生丝素蛋白的溶液质量分数要适中。
4.2.3 亲水性能
前期测试得到SFF的接触角为(32.1°±0.6°),He-SFF的接触角为(22.4°±0.3°)。研究指出,材料接触角的大小是材料表面的亲疏水性和粗糙度共同作用的结果。疏水材料表面粗糙度增加,其接触角值增大;亲水材料表面粗糙度增加,其接触角值减小[39]。丝素纤维本身是一种亲水性材料,He低温等离子体处理后其表面粗糙度增大,故He-SFF表面亲水性增强。表5归纳了不同质量分数再生丝素蛋白溶液接枝改性的丝素纤维人工血管材料的接触角。由表5可以看出:接枝再生丝素蛋白后,丝素纤维人工血管材料的接触角均有明显提升,原因可能是接枝再生丝素蛋白后,丝素纤维人工血管材料原有的孔隙被填充,测定接触角时,水滴无法有效地渗透致使接触角增大;相较于LRSF-SFF,HRSF-SFF的表面亲水性下降更为明显,原因可能是接枝HRSF后,材料表面形成了结晶度更高的β-折叠结构的丝素蛋白膜,致使其亲水性下降更加显著。

表5 再生丝素蛋白接枝后丝素纤维人工血管材料接触角测试结果
综合考虑再生丝素蛋白的接枝效果,以及材料的微观形貌、力学性能和亲水性能,本文确定优选质量分数为1%的HRSF溶液和质量分数为5%的LRSF溶液,用于后续的再生丝素蛋白接枝改性的研究。
4.2.4 蛋白吸附性能
图4归纳了SFF、He-SFF、HRSF-SFF及LRSF-SFF对BSA的吸附性能。图4中:SFF的BSA吸附量为15.76 mg/g;经He低温等离子体处理后,He-SFF的BSA吸附量减至12.36 mg/g;再生丝素蛋白溶液接枝后,改性丝素纤维人工血管材料的BSA吸附量均显著提升,HRSF-SFF和LRSF-SFF的BSA吸附量分别达到了19.59 mg/g和18.84 mg/g。相关研究表明,BSA在血管植入材料表面的吸附可以有效提升材料的血液相容性[40],而BSA的吸附效果又与材料表面的亲疏水性有关,其倾向于吸附在亲水性表面[41]。本文4.2.3节中,4种材料的亲水性大小为HRSF-SFF

图4 BSA吸附量测试结果
4.2.5 溶血率
依据ASTM F756-2017材料溶血特性的评定标准,当溶血率为0.0%~2.0%时评定生物材料不溶血,当溶血率为2.0%~5.0%时评定生物材料轻微溶血,当溶血率大于5.0%时评定生物材料溶血[44]。图5为丝素纤维人工血管材料改性前后的溶血率测试结果,4种材料的溶血率均小于5.0%。其中:SFF和He-SFF的溶血率分别为2.8%和2.4%,属于轻微溶血材料,原因与丝素纤维人工血管材料前期的脱胶处理没有将容易引发溶血的丝胶和其他杂质完全去除有关;HRSF-SFF和LRSF-SFF的溶血率分别为1.2%和1.6%,属于不溶血材料,原因在于接枝再生丝素蛋白后,再生丝素蛋白会覆盖甚至包裹材料表面的丝胶和杂质,避免它们与血液的接触。HRSF-SFF的溶血率更低,说明HRSF在材料表面形成的蛋白膜覆盖并包裹丝胶和杂质更有效,接枝HRSF可以更有效地降低材料溶血率,不溶血效果更显著。
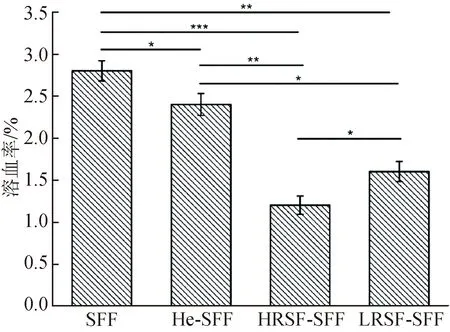
图5 溶血率测试结果
4.2.6 细胞毒性
图6反映了丝素纤维人工血管材料改性前后细胞毒性测试结果。由图6可以看出,SFF和He-SFF两者的细胞毒性无显著性差异,原因可能与丝素纤维人工血管材料表面残留的丝胶和杂质产生了细胞毒性有关;接枝再生丝素蛋白后,材料的细胞增殖率显著提升,表明细胞毒性下降,生物相容性好,这是由于接枝改性的丝素纤维人工血管材料表面可以提供更多的细胞结合位点,有利于细胞的黏附[45]。参照ISO 10993-5∶2009第5部分——材料的体外细胞毒性测试,当浸提液培养24 h后,若细胞增殖率>70.0%,则可判定该材料无细胞毒性[31]。测试发现:LRSF-SFF的细胞增殖率为67.7%,较未处理材料有明显提升,但仍未达到无细胞毒性的标准;HRSF-SFF的细胞增殖率达到了72.3%,参照标准,其可判定为无细胞毒性,说明接枝HRSF后可以更为有效地覆盖并包裹丝胶和杂质,最大限度地减弱材料的细胞毒性。
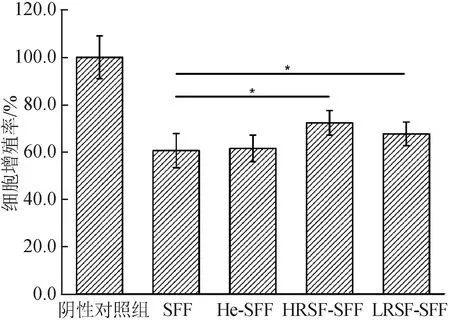
图6 细胞毒性测试结果
5 结论
利用HRSF和LRSF对He低温等离子体处理后的丝素纤维人工血管材料进行接枝改性处理,并对接枝改性前后的材料进行一系列的性能表征,发现不同质量分数的HRSF和LRSF溶液的接枝改性效果存在差异,但都会在一定程度上提升材料的拉伸断裂强度、初始模量和疏水性。综合考虑接枝改性效果,确定优选质量分数为1%的HRSF溶液和质量分数为5%的LRSF溶液分别对He-SFF接枝。生物学评价结果发现,接枝HRSF可以实现更优的抗凝血效果,显著降低材料的血液相容性,减弱材料的细胞毒性,是一种实用且有效的改性方式,在丝素纤维人工血管材料的改性领域具有良好的应用前景。
