乳腺癌组织hsa-mir-337表达降低的临床意义与预后分析
2022-05-09金一王昕仪杜润森郑丽华赵亚恒杨艳
金一 王昕仪 杜润森 郑丽华 赵亚恒 杨艳
乳腺癌的预后不尽人意。许多分子已被确定为重要的预后因素。为乳腺癌病人寻找新的生物标志物和治疗靶点尤为重要。研究发现,与正常组织相比,肿瘤组织中的 hsa-mir-337显著下调。 Cox分析表明 hsa-mir-337可以作为乳腺癌预后的独立生物标志物。
材料和方法
一、材料
所有数据集均使用 R(版本 3.6.0)中的RTCGA Toolbox包下载,包括乳腺癌病人miRNA测序数据及其对应的临床病理资料,组织样本来源于癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据库。
二、方法
1.基因集富集分析(GSEA):使用Broad研究所的GSEA软件3.0进行GSEA分析。基因组被认为在NOM p-val<0.25时显著富集。
2.靶标预测 :通过三种在线分析工具预测miRNA的靶基因,分别是TargetScan(http://wwwtargetscan.org/vert_72/)、miRDB(http://www.mirdb.org/cgi-bin/searc)和miRTarBase。为了进一步提高生物信息学分析的可靠性,我们使用维恩图将重叠的靶基因和差异表达的miRNA相交,以识别与miRNA共表达的基因。荧光素酶检测用于靶基因的验证。Cox检验用于鉴定最重要的靶基因。
三、统计学分析
使用R-studio 3.6.0进行数据分析。Boxplots用于离散变量测量表达差异,χ2检验用以检查hsa-mir-337表达与临床数据之间的关系。使用Youden指数评估的最佳截止值将病人分为hsa-mir-337高表达组和低表达组。使用Kaplan-Meier进行生存分析,使用Log-rank检验比较曲线。单变量Cox分析用于选择相关变量,输出风险比(hazard ratio,HR)、P值等。将Cox单因素回归分析得到的相关变量进一步进行多变量Cox分析,用于确定hsa-mir-337的表达对乳腺癌病人的独立预后价值。
结果
1.TCGA数据库资料下载与整理:所有乳腺癌病人数据均从TGGA数据库下载,病人总数为503例。乳腺癌病人数据特征见表1。

表1 乳腺癌病人数据特征(n=503)
2.hsa-mir-337被认为是乳腺癌的独立预后因素:如图1A所示,与正常组织相比,hsa-mir-337在肿瘤组织中显著下调。Paired-Samples T Test用于验证hsa-mir-337的差异性表达(图1B)。Kaplan-Meier 生存分析表明,与高表达组比较,hsa-mir-337低表达组的总生存率更差(图1C)。单变量Cox分析和多变量Cox 分析表明,hsa-mir-337 可以作为乳腺癌的独立预后因素。见表2,表3。
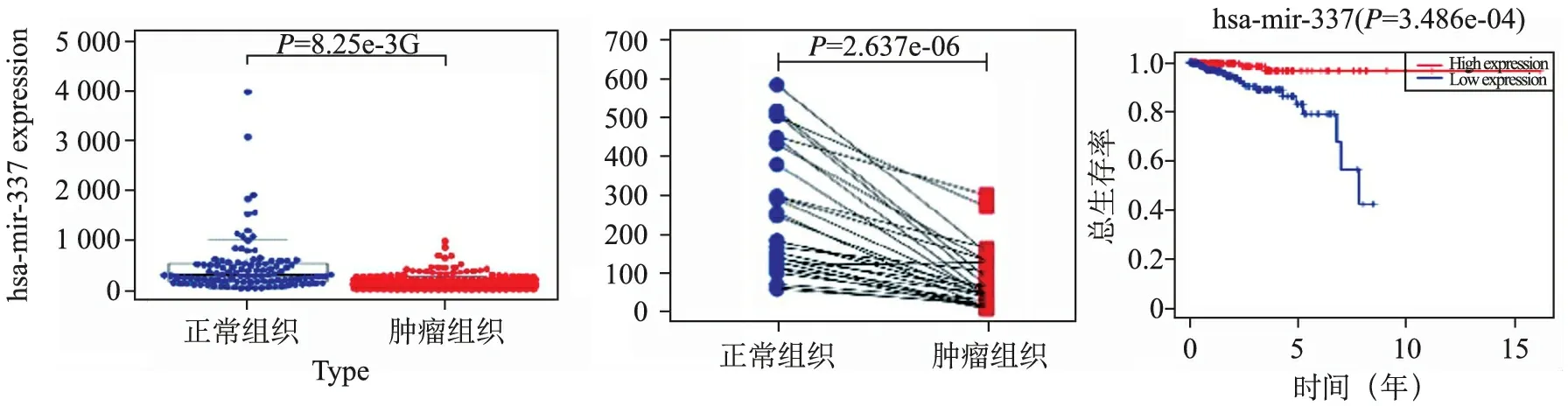
A hsa-mir-337在肿瘤组织中的表达显著降低。B Paired-Samples T Test用于验证hsa-mir-337的差异表达。C Kaplan-Meier生存分析表明,与高表达组相比,低表达组的总生存期更差。

表2 乳腺癌病人相关因素的单因素分析

表3 乳腺癌病人相关因素的多因素分析
3.GSEA 表示与hsa-mir-337相关的生物学功能和蛋白质:我们进行了GSEA(图 2A、B)来鉴定乳腺癌中激活的生物学功能 ,发现部分GO通路在hsa-mir-337低表达表型中差异性富集,例如GO_BASEMENT_MEMBRANE,GO_COLLAGEN_CONTAINING_EXTRACELLULAR_MATRIX(表4)。随着hsa-mir-337表达的降低,ECM PECEPTOR INTERACTION、FOCAL ADHESION等信号通路也出现了差异性富集(表4)。

图2 通过GSEA进行功能注释
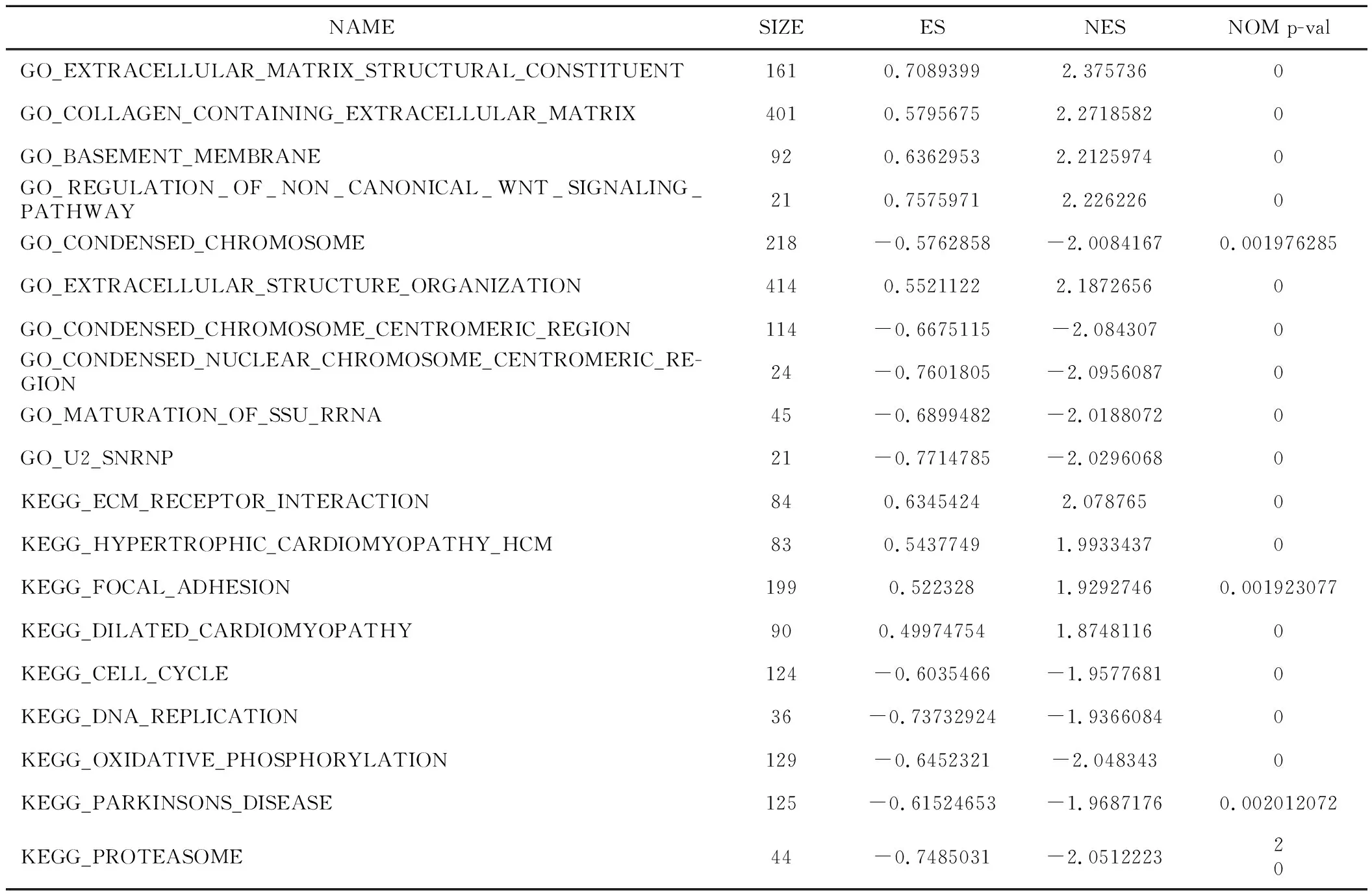
表4 hsa-mir-337低表达相关GO通路与KEGG通路
4.目标预测:通过靶基因预测,并利用维恩图将重叠的靶基因和差异表达的miRNA相交,我们确定了53个hsa-mir-337的潜在靶基因。此外,我们发现,随着hsa-mir-337的上调,C2CD2、CXCR2、FREM1、GAS7、GHR、NKAPL、PCDH18、SYT4的表达水平上调,而ESRP1的表达水平下调。另外,Kaplan-Meier生存分析表明,这些mRNA的差异表达显示出更差的总生存期。
讨论
miRNA是是一类长度约为21~ 25个核苷酸的内源性非编码小分子单链 RNA,它可以通过抑制信使RNA(mRNA)翻译或诱导mRNA的降解来调节基因表达。它可以参与和调控多种生理和病理过程,包括细胞发育、增殖、分化、迁移、侵袭、自噬和信号转导。有研究表明,miRNAs在各种恶性肿瘤细胞中差异表达,在肿瘤生物标志物中显示出巨大的潜力。例如,MiR-126 通过与多种分子相互作用在乳腺癌中发挥重要作用[1]。miR-378的上调通过抑制上皮间质转化来抑制结肠癌细胞的增殖、迁移和侵袭[2]。这些发现有助于我们实现抑制乳腺癌细胞的转移。
有研究表明,hsa-mir-337在非小细胞肺癌的癌变过程中起着至关重要的作用,可以作为非小细胞肺癌有前景的生物标志物[3]。miR-337在胃癌的发生过程中也起到了一定作用[4-5]。miR-337通过直接靶向KRAS抑制AKT和ERK通路,在结直肠癌的进展中作为肿瘤抑制因子[6]。此外,miR-337通过靶向STAT3/Wnt/β-catenin轴调节细胞增殖和侵袭,影响胰腺癌的发生[7]。据报道,miR-200家族水平升高与包括乳腺癌在内的种癌症的不良预后有关[8]。同样,hsa-miR- 21-5p被认为是主要的致癌miRNA之一,在多种癌症(例如,乳腺癌、结直肠癌、胃癌[9-11]和非小细胞肺癌)中观察到其上调。研究表明,miR-4417的低表达与三阴性乳腺癌病人较差的预后显著相关[12]。
mIR196A的表达也被证明是晚期和绝经后ER+病人的可靠预后因素[13]。有研究进行了整合microRNA和mRNA免疫细胞特征的构建,以预测乳腺癌和卵巢癌病人的生存[14]。
在本次研究中,我们发现乳腺癌组织中hsa-mir-337的表达显著下调。我们进行了单变量Cox分析和多变量Cox分析,以确定hsa-mir-337表达对病人总生存期的影响,结果表明,hsa-mir-337可以作为乳腺癌的独立预后因素。为了进一步探索hsa-mir-337的生物学作用,我们进行了GSEA分析,发现GO_BASEMENT_MEMBRANE、GO_CONDENSED_CHROMOSOME等差异表达。随着hsa-mir-337的减少,各种信号通路也受到影响,如ECM PECEPTOR INTERACTION、FOCAL ADHESION。
此外,我们证实了随着hsa-mir-337的上调,C2CD2、CXCR2、FREM1、GAS7、GHR、NKAPL、PCDH18、SYT4上调,而ESRP1而下调,可以作为hsa-mir-337的靶基因[15]。然而,hsa-mir-337与这些基因之间相互作用的具体机制尚不清楚。如果进一步阐明它们之间的作用机制,hsa-mir-337的应用将会更广泛。
