不同地区稻田养殖小龙虾生理代谢、肌肉品质及营养价值比较
2022-05-09贾丽娟王广军夏耘张凯高书伟1李奕潮高岩
贾丽娟,王广军,夏耘,张凯,高书伟1.,李奕潮,高岩
(1.水产科学国家级实验教学示范中心,上海海洋大学,上海 201306;2.中国水产科学研究院珠江水产研究所,农业农村部热带亚热带水产资源利用与养殖重点实验室,广东 广州 510380)
小龙虾(Procambarusclarkii),学名为克氏原螯虾,其生长速度快,适应能力强,摄食范围广,是淡水重要经济虾类之一[1]。克氏原螯虾原产于北美,1929年经日本引入中国,1983年首次提出将其作为一种水产资源加以开发利用,现已形成全国性分布[2-3],其养殖方式主要有稻田养殖、池塘主养、池塘混养等,其中稻田养殖是小龙虾的主要生产方式。2020年我国稻田养虾的产量206.23万t,养殖面积126.13万hm2,分别占总产量和总面积的86.15%和86.61%,占全国稻渔综合种养总面积(256万hm2)的49.22%[4]。
我国小龙虾养殖最多的省份是湖北,其次是江苏、安徽、江西、湖南,这5个省份总产量占全国总产量的95%[5]。华南地区虽然也有养殖,但养殖规模较小,产量也较低。有研究表明,不同地区、不同养殖模式以及不同饲料会影响水产动物的生长性能、肌肉品质、免疫性能、生理状况以及经济效益等[6-9]。徐晨等[10]对南京附近几个地区养殖小龙虾的营养成分和品质进行了研究,发现不同地区小龙虾肌肉品质存在不同程度的差异;刘永涛等[11]研究发现,不同饲料会对小龙虾肌肉口感和营养品质产生影响;万金娟等[12]对盱眙地区不同养殖模式下小龙虾肌肉品质的比较分析发现,稻田养殖模式下小龙虾肌肉硬度和咀嚼性高于其他模式下的小龙虾肌肉硬度和咀嚼性。国内外在这方面也进行了不少研究,但关注较多的是不同养殖模式和不同饲料对小龙虾肌肉的影响,但对华南地区养殖的小龙虾与 “小龙虾之乡”湖北地区养殖的小龙虾肌肉品质等方面的对比鲜有报道。
华南地区小龙虾养殖发展比较缓慢,普遍认为与华南地区温度较高有关[13]。前期对华南地区与湖北地区稻田小龙虾的养殖环境研究发现,华南地区和湖北地区水环境理化特征、水体微生物种类等方面存在不少差异,华南地区小龙虾虽然能很好地存活,但个体整体偏瘦,且繁殖率低下,为了进一步分析2个地区养殖的小龙虾生理状况及营养价值的差异,本试验针对湖北省武汉市蔡甸区(E 114.03,N 30.59)和广东省韶关市南雄市(E 114.31,N 25.12)稻田养殖小龙虾进行生理代谢指标、营养成分对比分析,并对其营养价值进行了评价,旨在了解不同产区不同养殖环境下小龙虾肌肉品质和生理代谢的差异,以期为华南地区小龙虾营养需求和配套饲料的开发提供基础数据,也为华南地区小龙虾健康养殖提供理论依据。
1 材料与方法
1.1 试验材料
采集广东省韶关市南雄市古市镇丰源村养殖场(E114.31°,N 25.12 °,简称韶关组)和湖北省武汉市蔡甸区侏儒山街道肖诗银养殖场(E 114.03°,N 30.59°,简称武汉组)养殖的小龙虾, 两个地区小龙虾均达到上市规格。韶关组小龙虾体质量(26.16±4.65) g,体长(6.38±0.24) cm,含肉率(17.65±0.68)%;武汉组小龙虾体质量(28.52±5.01)g,体长(6.5±0.35) cm,含肉率(18.54±0.71)%.两个地区各采集小龙虾30尾进行检测。
1.2 样品采集与分析
1.2.1 生理代谢酶活性测定 每个地区随机选取10尾小龙虾进行肝胰腺样品的采集,液氮速冻后带回实验室保存于-80 ℃冰箱待测。使用上海酶联生物有限公司试剂盒,采用双抗体一步夹心法酶联免疫吸附试验[14](ELISA)测定肝胰腺碱性磷酸酶(ALP)、酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)和总抗氧化能力(T-AOC)活性,具体操作按照试剂盒说明书进行。
1.2.2 常规营养成分的测定 采集小龙虾腹部肌肉用于肌肉营养成分、氨基酸和脂肪酸组成分析。水分含量测定参照GB 5009.3-2016第一法,直接干燥法;粗蛋白含量测定参照GB 5009.5-2016第一法,凯氏定氮法;粗脂肪含量测定参照GB 5009.6-2016第二法,索氏提取法;灰分含量测定参照GB 5009.4-2016第一法,马弗炉灰化法。
1.2.3 总氨基酸含量测定 参照GB 5009.124-2016,称取1.0 g(精确到0.001 g)样品,用盐酸(6 mol/L)水解法进行水解,然后使用高速氨基酸分析仪测定。
1.2.4 氨基酸营养价值评价 根据联合国粮食及农业组织/世界卫生组织(FAO/WHO)1973年建议的氨基酸评分标准模式和全鸡蛋蛋白质的氨基酸模式[15]进行比较,分别按以下公式计算氨基酸评分(amino acids score,AAS)、化学评分(chemical score,CS)和必需氨基酸指数(essential amino acidindex,EAAI)。
式中:n为比较的必需氨基酸数目(n=7);A、B、C、…、J为试验小龙虾肌肉蛋白质中必需氨基酸的含量/(mg/g);AE、BE、CE、…、JE为全鸡蛋蛋白质中同种氨基酸含量/(mg/g)。
氨基酸含量/(mg·g-1)=
1.2.5 脂肪酸含量测定 参照GB 5009.168-2016第二法。称取样品0.3~0.5 g于10 mL离心管中,加入氯仿-甲醇(2∶1,V/V)溶液5 mL,高速分散器(XHF-D,SCIENIZ,宁波)匀浆,4 ℃静置1~2 h后定量滤纸过滤。滤液中加4 mL蒸馏水,振荡2 min后3 000 r/min离心5 min,除去上层甲醇溶液,下层用水浴锅负压抽干(40 ℃),除去氯仿得到总脂肪。随后加入1 mL色谱纯正己烷将油脂溶解,加入1 mL 0.5 mol/L氢氧化钠-甲醇溶液(2 g/100 mL)静置30 min进行甲酯化,之后加2 mL去离子水,待分层后提取上层溶液在气相色谱仪(安捷伦 7820a,安捷伦科技,美国)上进行测定.每种脂肪酸与已知标品(47015-U,Sigma-Aldrich,Inc.,St.Louis,USA)进行比对鉴别。
1.2.6 脂肪酸营养价值评价 根据相关文献[16-17],分别按以下公式计算致动脉粥样化指数(index of atherogenic,IA)和血栓形成指数(index of thrombogenic,IT),用于评估小龙虾肌肉脂肪酸对人类心血管疾病发生的影响。
1.3 数据统计与分析
2 结果与分析
2.1 生理代谢酶活性
如图1所示,2组小龙虾肝胰腺总抗氧化能力和谷胱甘肽过氧化物酶活性无显著性差异(P>0.05);武汉组小龙虾肝胰腺超氧化物歧化酶活性(72.95±14.48 U/mL)显著高于韶关组(48.52±11.65 U/mL)(P<0.05);过氧化氢酶活性和丙二醛含量分别为(28.46±4.65) U/mL和(2.50±0.41) nmol/mL,均显著低于韶关组(36.72±4.11) U/mL和(3.05±0.22) nmol/mL)(P<0.05)。武汉组碱性磷酸酶和酸性磷酸酶活性分别为(4.73±0.74) U/L和(6.32±0.76) U/L,均显著低于韶关组(P<0.05)。
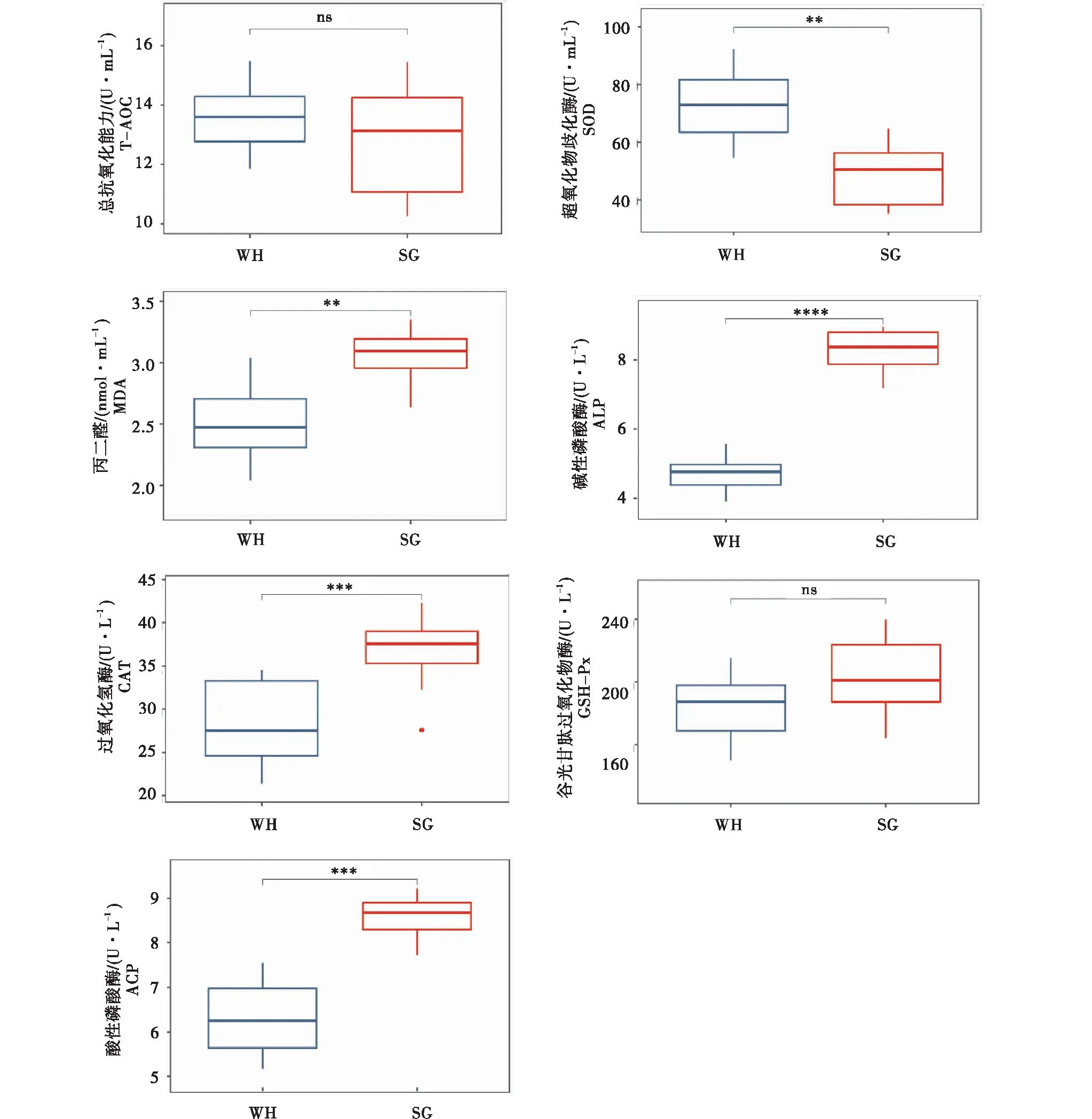
图1 2组小龙虾肝胰腺生理代谢酶活性比较Figure 1 Comparison of enzyme activities in hepatopancreas of Procambarus clarkii between two groups
2.2 常规营养成分分析
由表1数据可知,武汉组小龙虾肌肉粗蛋白和粗灰分含量显著高于韶关组(P<0.05),但水分含量显著低于韶关(P<0.05),肌肉粗脂肪含量2组之间无显著性差异(P>0.05)。
2.3 氨基酸组成
2组小龙虾肌肉氨基酸组成见表2,共检测出16种氨基酸,其中必需氨基酸有7种,半必需氨基酸2种,非必需氨基酸7种。2组含量最高的是谷氨酸和精氨酸,其次是天冬氨酸,含量最低的是组氨酸。武汉组小龙虾肌肉中缬氨酸、苯丙氨酸、异亮氨酸、赖氨酸、苏氨酸、精氨酸、天冬氨酸、谷氨酸、丝氨酸、丙氨酸、酪氨酸和脯氨酸含量均显著高于韶关组(P<0.05)。武汉组小龙虾肌肉中必须氨基酸、总氨基酸、非必需氨基酸和呈味氨基酸含量均显著高于韶关组(P<0.05),且必需氨基酸和总氨基酸的比值更接近FAO/WHO 要求的40% 的标准,表明武汉组小龙虾肌肉比韶关组的味道更鲜美,氨基酸组成更符合人体需求。
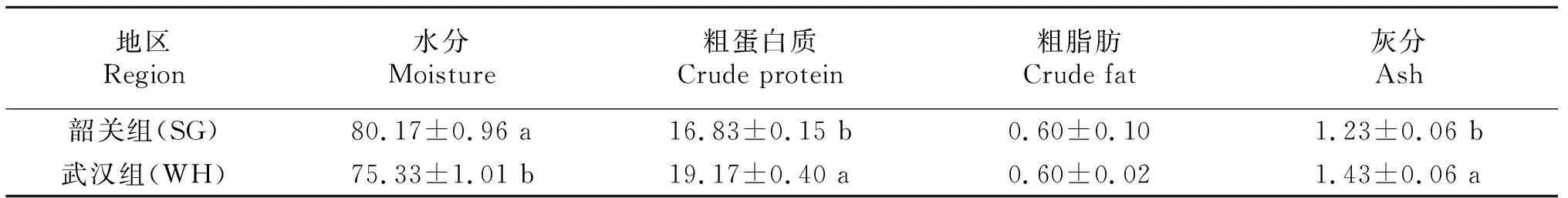
表1 2组稻田养殖模式下小龙虾肌肉的常规营养成分比较(湿重)
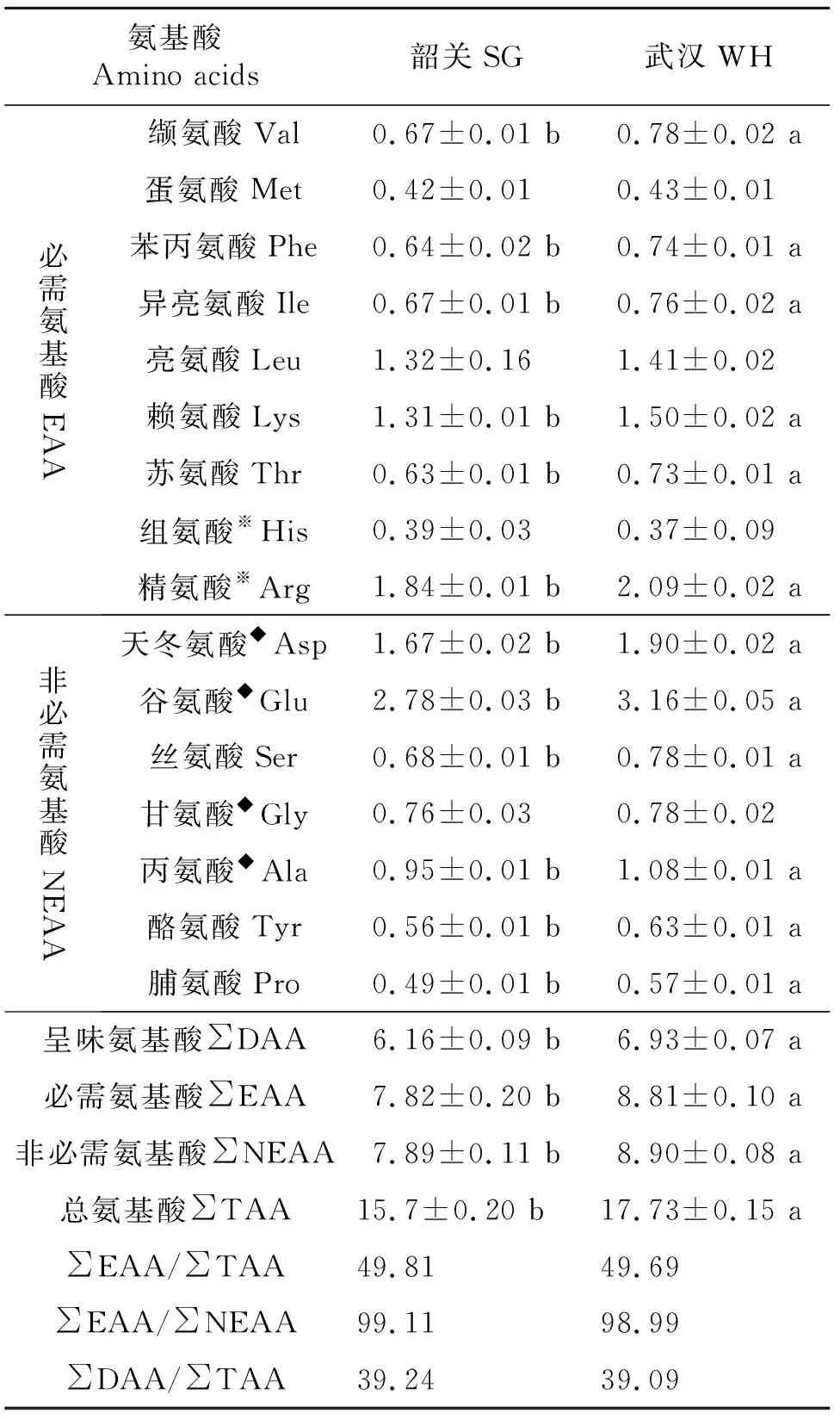
表2 2组小龙虾肌肉的氨基酸成分分析
2.4 氨基酸营养价值评价
2组小龙虾肌肉氨基酸营养价值评价结果见表3。结果显示,异亮氨酸、苏氨酸、缬氨酸和蛋氨酸含量低于WHO/FAO标准,亮氨酸、苯丙氨酸+酪氨酸和赖氨酸含量高于WHO/FAO标准。2组小龙虾肌肉赖氨酸含量显著高于WHO/FAO标准和全鸡蛋蛋白标准。武汉组和韶关组小龙虾肌肉中氨基酸总量分别为177.3和157.0 mg/g,必需氨基酸占氨基酸总量分别为39.37%和39.55%,均高于WHO/FAO标准(35.38%);与非必须氨基酸的比值分别为71.35%和70.85%,均超过WHO/FAO蛋白模式标准(60%);呈味氨基酸(天冬氨酸、谷氨酸、甘氨酸和丙氨酸)分别占总氨基酸的39.09%和39.24%。
基于WHO/FAO模式和全鸡蛋蛋白模式评分标准,计算2组小龙虾肌肉必需氨基酸的氨基酸评分、化学评分和氨基酸指数,结果见表4。武汉组小龙虾肌肉苏氨酸和缬氨酸的氨基酸评分和化学评分高于韶关组,亮氨酸和蛋氨酸的氨基酸评分和化学评分均低于韶关组;异亮氨酸、苯丙氨酸+酪氨酸和赖氨酸的氨基酸评分和化学评分与韶关相同。2组第一限制性氨基酸均是蛋氨酸(Met),第二限制性氨基酸均是缬氨酸(Val)。氨基酸指数EAAI可以用来反映必需氨基酸与标准蛋白质含量的接近程度。EAAI高于0.95,表示是优质蛋白源;EAAI在0.86~0.95之间,表示为良好蛋白源;EAAI在0.75~0.86之间,表示为可用蛋白源;EAAI低于0.75则表示为不适蛋白源[18]。由表4数据可知,武汉组小龙虾和韶关组小龙虾肌肉EAAI分别为1.01和0.90,说明武汉组小龙虾属于优质蛋白源,韶关组小龙虾属于良好蛋白源。

表3 必需氨基酸组成与含量

表4 必需氨基酸评分
2.5 脂肪酸组成与营养价值评价
不同地区小龙虾肌肉脂肪酸组成和含量见表5。共检测出20种脂肪酸,其中武汉组小龙虾共检测出17种脂肪酸,韶关组小龙虾共检测出19种脂肪酸。韶关组小龙虾肌肉十五烷酸、十七烷酸、二十碳四烯酸和二十二碳六烯酸含量显著高于武汉组(P<0.05);亚麻酸含量显著低于武汉组(P<0.05)。武汉组小龙虾脂肪酸含量为PUFAs>MUFA>SFA,韶关组小龙虾脂肪酸含量为PUFAs>SFA>MUFA。2组小龙虾肌肉∑PUFAn-3/∑PUFAn-6值分别为0.97和1.80,均显著高于FAO/WHO推荐的日常膳食∑PUFAn-3/∑PUFAn-6值(0.1和0.2)。武汉组小龙虾肌肉饱和脂肪酸总量低于韶关组,不饱和脂肪酸总量高于韶关组。武汉组和韶关组小龙虾肌肉IA分别为0.24和0.22;IT分别为0.26和0.20,说明小龙虾肌肉脂肪酸不饱和度较高。
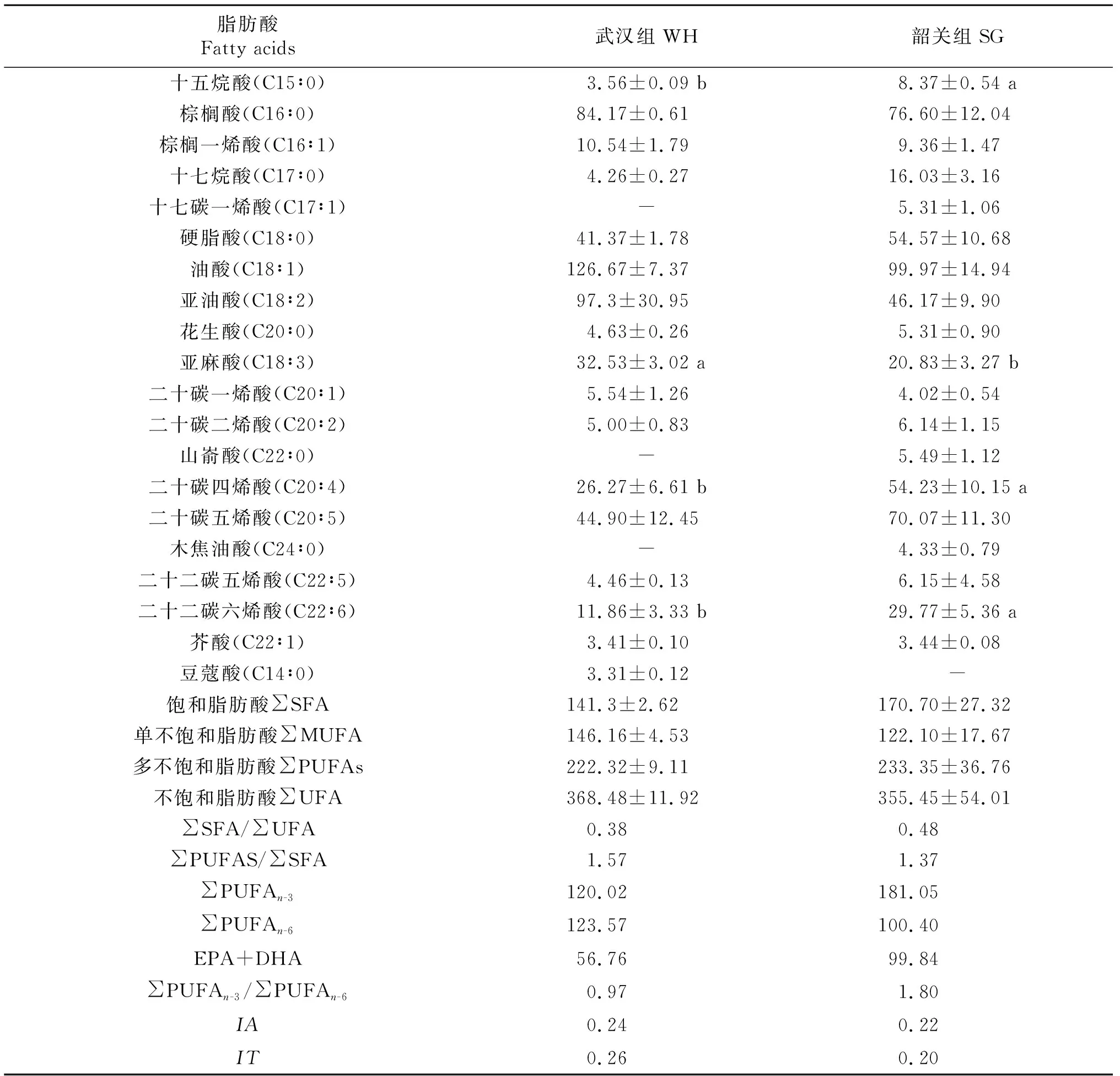
表5 小龙虾肌肉脂肪酸组成(mg/100 g湿重)
3 讨论
3.1 2组小龙虾生理代谢酶活性的比较
氧化应激在集约化水产养殖中非常常见,当水产动物受到拥挤、高温等应激时抗氧化系统失调,导致代谢紊乱,最终影响其生长和抗病力等[19]。T-AOC可反映机体自由基代谢状态和机体抗氧化系统的工作能力,所以是机体反映体内组织抗氧化功能的一个良好指标[20]。SOD是生物体内清除自由基的首要物质,可催化超氧阴离子发生歧化反应从而保护机体免受伤害; MDA是膜脂过氧化最重要的产物之一,其活性的高低可以间接反应出机体受到自由基攻击的损伤程度[21];CAT 可催化H2O2分解为对机体无害的氧气和水,而H2O2又是由SOD清除超氧阴离子所产生的,所以CAT是生物体内抗氧化体系的关键酶之一[22]。GSH-Px可以催化还原型谷胱甘肽(GSH)变为氧化型谷胱甘肽(GSSG),让有毒的过氧化物还原成无毒的羟基化合物,保护细胞膜不受损害,并且GSH-Px还可以促进过氧化氢的分解[23],机体内GSH-Px的含量越高,代表机体的抗氧化能力越强。因此,上述几种指标常用作是否存在氧化应激的指标。本研究中,2组小龙虾肝胰腺组织抗氧化酶活力不同,其中韶关组小龙虾CAT活性和MDA含量显著高于武汉组小龙虾,表明韶关组小龙虾氧化应激较强,氧化损伤严重,可能是由于韶关位于华南地区,高温季节较长,较长时间高温导致小龙虾抗氧化系统失调。所以小龙虾在华南地区养殖的过程中,在采取一些降温措施的同时,可向水体泼洒一些抗应激的物质来减缓因高温导致的应激。
碱性磷酸酶广泛存在于动物体内,催化水解磷酸单酯,参与磷酸基团的转移,是动物体内重要的解毒体系[15]。一般认为,动物体内的碱性磷酸酶参与了肠道上皮细胞的吸收与转运,协助肠道上皮细胞吸收葡萄糖等营养物质[16]。在本研究中,韶关组小龙虾肝胰腺碱性磷酸酶活性显著高于武汉组,在一定程度上可能有利于细胞代谢,加速了营养物质的转运,也可能是机体主动减少应激的一种反应。
3.2 肌肉基本营养成分
小龙虾主要可供食用部分为其腹部肌肉,蛋白质和脂肪含量的高低是评价其营养价值的重要指标[17],其含量受生活环境、饵料类型、养殖模式等多种因素影响。程小飞等[27]研究发现,不同养殖模式下稻田组克氏原螯虾肌肉粗蛋白质含量最高;万金娟等[12]对盱眙地区不同养殖模式下克氏原螯虾肌肉品质的研究表明,稻虾共作模式下小龙虾肌肉粗蛋白含量(20.54%)高于其他模式。徐晨等[10]对南京浦口、苏州太湖及宿迁泗洪地区的小龙虾肌肉营养成分和品质进行研究,发现宿迁泗洪地区小龙虾肌肉的弹性、咀嚼性、蛋白质含量及脂肪含量均高于其他两地,宿迁泗洪地区小龙虾必需氨基酸含量占比相对较高。本研究武汉组小龙虾肌肉蛋白质和粗灰分含量显著高于韶关组,水分含量显著低于韶关组,武汉组小龙虾肌肉必需氨基酸和总氨基酸含量均显著高于韶关组,且武汉组小龙虾机体抗氧化能力较强,与前人研究结果一致,即不同地区小龙虾肌肉品质存在一定差异,武汉组小龙虾肌肉品质较高,机体抗氧化能力也相对韶关组较强。究其原因,可能是韶关位于华南地区,高温时间过长(超过小龙虾适宜温度范围的时间较长),养殖环境不利于小龙虾的生长,从而也影响了其体内蛋白质的合成,也可能是2组之间稻田内天然饵料种类不同,食物的差异导致其肌肉营养成分的差异。
3.3 氨基酸组成及其营养价值评估
蛋白质的质量主要取决于氨基酸的种类与含量,优质食用蛋白质不仅所含必需氨基酸种类要齐全,而且必需氨基酸之间的比例也要适宜。本研究中,2组小龙虾肌肉的∑EAA/∑TAA和∑DAA/∑TAA的值均在40%左右,与WHO/FAO的要求接近,说明不同地区小龙虾肌肉蛋白质接近理想蛋白源。肌肉的风味取决于呈味氨基酸的组成与含量,呈味氨基酸所占比例与肌肉的鲜美程度正相关[28]。本研究中武汉组小龙虾肌肉呈味氨基酸含量显著高于韶关组,2组小龙虾肌肉中呈味氨基酸所占比例均高于凡纳滨对虾[29],说明其味道较凡纳滨对虾更加鲜美。刘永涛等[11]在不同饲料对稻田养殖克氏原螯虾肌肉质构特性和营养品质的影响研究中发现,不同饲料对小龙虾呈味氨基酸无显著性影响,其呈味氨基酸占总氨基酸的34.75%~36.70%;万金娟等[12]对盱眙地区不同养殖模式下克氏原螯虾肌肉品质的比较中发现,不同模式下小龙虾呈味氨基酸含量无显著差异;徐晨等[10]对不同地区小龙虾营养价值和品质的比较研究发现,不同地区小龙虾肌肉呈味氨基酸含量存在一定差异,但无显著性。本次研究表明,武汉组和韶关组小龙虾呈味氨基酸含量差异也不显著,分别占总氨基酸的39.03%和39.23%,高于潜江地区养殖的[11]小龙虾而低于盱眙地区养殖的[12]小龙虾。
同时,食品中氨基酸含量主要还取决于必须氨基酸含量。2组小龙虾肌肉中共检测出7种人体必需氨基酸,其中武汉组小龙虾肌肉必需氨基酸中的异亮氨酸、苏氨酸、缬氨酸、赖氨酸、苯丙氨酸和酪氨酸含量均高于韶关组,说明武汉组小龙虾必需氨基酸组成和含量更能满足人体需求。武汉组和韶关组小龙虾肌肉必需氨基酸占总氨基酸含量的百分比分别为49.69%和49.81%,均高于湖南南县[27]和盱眙[12]不同模式养殖的和野生的小龙虾。
氨基酸评分(AAS)和化学评分(CS)是广泛被采用的蛋白质营养价值评价方法,而必需氨基酸指数(EAAI)可表示样品中必需氨基酸含量与标准蛋白质的相符程度,常用于评价食物营养价值高低。本试验中,武汉组和韶关组小龙虾EAAI值分别为1.01和0.90,整体而言,武汉组小龙虾的AAS评分和CS评分以及EAAI都高于韶关组,说明武汉组小龙虾肌肉营养价值高于韶关组。同时,研究结果也显示,2组小龙虾肌肉第一限制性氨基酸均为蛋氨酸(Met),第二限制性氨基酸均为缬氨酸(Val),与王广军[30]、田娟等[31]的研究结果基本一致。故建议在养殖小龙虾饲料中添加适量的蛋氨酸和缬氨酸来提高小龙虾的营养价值。
3.4 脂肪酸组成
脂肪酸包括饱和脂肪酸和不饱和脂肪酸,不饱和脂肪酸又包括单不饱和脂肪酸和多不饱和脂肪酸。研究表明,饱和脂肪酸可为机体提供能量,不饱和脂肪酸可以降低血脂,预防心血管疾病,对机体生长发育有促进作用,其中多不饱和脂肪酸中的二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)对婴幼儿脑部发育具有促进作用,还对老年人心脑血管疾病具有预防作用[32-34]。本研究武汉组小龙虾肌肉共检测出17种脂肪酸,韶关组小龙虾肌肉共检测出19种脂肪酸,且2组小龙虾肌肉脂肪酸均是棕榈酸、油酸和亚油酸含量较高,其总量超过总脂肪酸含量的50.00%,与郭占林等[35]研究结果一致。武汉组小龙虾肌肉饱和脂肪酸含量低于韶关,不饱和脂肪酸含量高于韶关组,表明武汉组小龙虾肌肉脂肪酸组成更利于人体健康。武汉组小龙虾肌肉单不饱和脂肪酸含量明显高于韶关,且以油酸为主。武汉组和韶关组小龙虾∑PUFAn-3/∑PUFAn-6值分别为0.97和1.80,远高于WHO/FAO推荐的0.1~0.2,与程小飞、刘永涛等研究结果一致,较高的∑PUFAn-3/∑PUFAn-6对降低血脂和心血管疾病发生有利[36]。研究表明,养殖方式、饵料来源、外环境以及个体大小等都会影响肌肉中氨基酸组成,同时养殖方式的不同也会造成肌肉中脂肪酸种类和含量的不同。2组小龙虾生长区域不同,环境中存在的生物饵料以及所处的生态环境因子不同也可能会对脂肪酸组成造成影响[37]。
4 结论
在生理代谢方面,武汉组小龙虾肝胰腺超氧化物歧化酶活性显著高于韶关组,过氧化氢酶和丙二醛含量显著低于韶关组,碱性磷酸酶和酸性磷酸酶活性显著低于韶关组;在肌肉营养成分方面,武汉组小龙虾肌肉粗蛋白和粗灰分含量显著高于韶关组,水分含量显著低于韶关组;在氨基酸组成方面,武汉组小龙虾肌肉必需氨基酸、总氨基酸、非必需氨基酸和呈味氨基酸含量均显著高于韶关组,且必需氨基酸和总氨基酸比值更接近FAO/WHO要求;在脂肪酸组成方面,武汉组小龙虾肌肉饱和脂肪酸含量低于韶关组,不饱和脂肪酸含量高于韶关组。综上所述,武汉组小龙虾机体抗氧化能力和肌肉营养价值均高于韶关组。
