异硫氰酸烯丙酯对兰州百合枯萎病菌的抑菌作用
2022-05-09苏国礼师桂英王文珠杨宏羽李谋强李天祥
苏国礼,师桂英,王文珠,杨宏羽,李谋强,李天祥
(1.甘肃农业大学园艺学院,甘肃 兰州 730070;2.定西市华家岭造林站,甘肃 定西 743000)
生物熏蒸是一种天然、环保且具有较好应用前景的溴甲烷熏蒸替代措施,是通过分解植物体内的代谢物而产生挥发性气体,从而抑制或杀死土传病、虫、草害的土壤熏蒸方法[1]。随着中国“双减”政策的颁布和实施,化学熏蒸剂的用量受到控制[2]。生物熏蒸剂对环境友好,替代化学熏蒸剂更为安全。芸薹属植物体内,含有大量的硫苷,且硫苷与细胞内源黑芥子酶反应会生成——异硫氰酸酯类化合物(ITCs),此类化合物对土壤具有消毒作用[3],可以作为一种新型生物熏蒸剂使用,对有害微生物、虫卵、杂草等进行防控[4-5]。ITCs含有多种成分,现已发现的大概有100种。常见的ITCs主要包括:莱菔硫烷(SFN)、烯丙基异硫氰酸酯(AITC)、苯基异硫氰酸酯(BITC)、苯甲基异硫氰酸酯(PITC)和苯乙基异硫氰酸酯(PEITC)5种[6]。在众多的ITCs家族成员中,以AITC的含量较高。AITC俗称芥子油,对土壤病原菌、根结线虫及杂草均有一定的抑制作用[1]。关于ITCs的诸多研究表明,ITCs可有效地抑制黑胫病豌豆根腐病菌(Fusariumoxysporum)[7]、油菜茎基溃疡病菌(Leptosphaeriamaculans)[8]、小麦根腐病菌(Pythiumirregulare)和立枯丝核菌(Rhizoctoniasolani)[9]等土传病原菌的菌丝生长,抑制寄生霜霉(Peronosporaparasitica)[10]和灰霉菌(Botrytiscinerea)[11]等病原菌的孢子萌发。研究生物熏蒸剂的有效成分对土传病原微生物的抑菌作用是生物熏蒸技术应用的基础。
兰州百合(Liliumbrownievar.viridulumBaker)是极具地方特色的名优蔬菜,狭域性分布,土传病害枯萎病发生严重[12]。甘肃农业大学百合课题组从兰州百合主产区分离鉴定了包括尖孢镰刀菌(F.oxysporum)在内的5种百合枯萎病致病镰刀菌类群[13];同时还利用第二代测序技术研究了0~9 a连作栽培条件下兰州百合土壤微生物群落的变化,证明镰刀菌属的积累是引起兰州百合连作障碍的主要原因之一,在连作6 a及9 a土壤中,其相对丰度分别达到了3.26%和7.60%[14]。镰刀菌属(Fusarium)是植物根际土壤中存在最广泛的真菌之一[15],该属中的一些种,如F.oxysporum是引起植物发生枯萎病的典型病原真菌[16-19],在作物连作栽培条件下,镰刀菌属真菌的积累是引起花生、黄瓜和香草等作物产生连作障碍的重要原因[20]。基于以上研究背景,本研究开展了AITC对尖孢镰刀菌百合专化型(Fusariumoxysporumf.sp.lilii)的抑菌效果研究,以期为AITC控制兰州百合枯萎病提供依据。
1 材料与方法
1.1 供试材料
AITC由北京百灵威科技有限公司提供;尖孢镰刀菌,由甘肃农业大学蔬菜生理实验室提供。
1.2 供试培养基
PDA固体培养基(马铃薯葡萄糖琼脂培养基),由北京奥博星生物技术有限公司提供;PDB液体培养基(马铃薯葡萄糖培养液):马铃薯洗净去皮,再称取200 g切成小块,加1 000 mL蒸馏水煮烂(煮沸20~30 min,能被玻璃棒戳破即可),用8层纱布过滤,加入葡萄糖12 g搅拌均匀,稍冷却后再补足水分至600 mL。然后将配制好的培养基溶液分装至4个三角瓶(500 mL)中,121 ℃高压蒸汽灭菌锅中灭菌20 min后备用。
1.3 试验设计
本试验设有4个浓度梯度,依次为:CK(清水对照)、T1(0.005 μL/mL)、T2(0.015 μL/mL)、T3(0.025 μL/mL),每个处理4个重复。本试验通过生长速率法,将AITC与PDA培养基按体积1∶9混合[21],分装至直径为9 cm培养皿中,待冷却至凝固状态时,将直径为4 mm的菌饼接种于含药平板中央,盖上皿盖,封口倒置,置于27~30 ℃温度的培养箱中培养2~7 d。
1.3.1 AITC尖孢镰刀菌菌丝生长及产孢量的测定 用电子数显游标卡尺采用十字相交法量取气生菌丝及基生菌丝生长圈的直径(mm)。在培养至第7天时,用接种针在菌落中央挑取少量菌丝至载玻片上,滴加乳酸酚棉蓝染色液后,将菌丝充分展开,盖上载玻片置于显微镜下进行菌丝的显微镜结构观察(20×40)。
菌落纯生长量=菌落直经-菌饼直径
用PDB培养液对尖孢镰刀菌进行液体培养,第8天时利用布氏漏斗真空抽滤装置收集其发酵液,即为孢子悬浮液,吸取1 mL孢子悬浮液,至血球计数板的计数室内,盖上盖玻片进行产孢量的计数。
产孢量(个/mL)=(测量所得孢子数/80)×400×10 000×稀释倍数
1.3.2 尖孢镰刀菌细胞电导率的测定 将活化5 d的尖孢镰刀菌用无菌打孔器打取直径为1 cm的菌饼,接至空白的PDB培养液中,置于振荡培养箱中,28 ℃、140 r/min培养72 h。利用布氏漏斗真空抽滤装置进行菌丝收集[22],用于测定电导率。具体方法是:各处理称取0.5 g的菌丝,将其加入用无菌去离子水配置的浓度为0.005、0.015、0.025 μL/mL的AITC药液中,以无菌去离子水作对照。在室温下放置0、2、4、6、8和10 h后,用DDS-307型电导仪测定,并扣除背景本身的电导率。
1.3.3 尖孢镰刀菌Pro、MDA及抗氧化酶活性的测定 按1.3.2中所述方法振荡培养尖孢镰刀菌72 h后,将不同浓度的AITC药液加至PDB培养液内,且各处理分别在24、48、72和96 h收集0.2 g菌丝,用于Pro、MDA及抗氧化酶活性的测定。MDA含量测定采用硫代巴比妥酸法[23],Pro含量测定采用茚三酮比色法[23],SOD、CAT活性测定按照Pinheiro[24]的方法进行,POD活性测定采用愈创木酚法。
1.3.4 培养基中还原糖、可溶性蛋白含量的测定 在收集菌丝的同时,对0、24、48、72、96 h过滤的培养基发酵液进行还原糖含量的测定及可溶性蛋白含量的测定。还原糖含量采用了3,5-二硝基水杨酸比色法,可溶性蛋白含量采用考马斯亮蓝法,均参考任伟[25]的方法进行。
1.4 数据分析
采用Microsoft Excel 2010软件进行原始数据处理及图表绘制,SPSS 22.0统计软件进行方差分析,用Duncan’s法进行差异显著性检测。
2 结果与分析
2.1 AITC对尖孢镰刀菌形态指标的影响
2.1.1 AITC对尖孢镰刀菌菌丝生长的影响 由表1可知,AITC对尖孢镰刀菌菌落生长具有显著的抑制作用(P<0.05),作用效果呈现一定的浓度效应,并且在基内菌丝与气生菌丝之间出现一定的分化作用效果。与CK相比,在0.005~0.015 μL/mL的浓度范围内,AITC对基内菌丝的生长具有低促高抑的作用效果,即T1处理的菌落直径在培养至4,5,6,7 d时均显著大于CK;而T2处理的菌落直径在培养至5,6 d时,相较CK差异不显著。AITC对气生菌丝的生长产生了显著的抑制效应,与CK相比,T1、T2气生菌丝在培养2、3、4、5、6、7 d时,均显著小于CK,且CK中菌丝表现致密均匀,颜色较深,T1、T2处理中菌丝表现稀疏,颜色较浅。而T3处理完全受到了抑制,在整个培养过程中未观察到菌落生长(图1)。

由上往下依次为第3、5、7天的菌落。Colony growth at 3 rd,5 rd,and 7 rd,respectively (from up to down).图1 AITC对尖孢镰刀菌的抑菌效果Figure 1 Inhibitory effect of AITC on Fusarium oxysporum
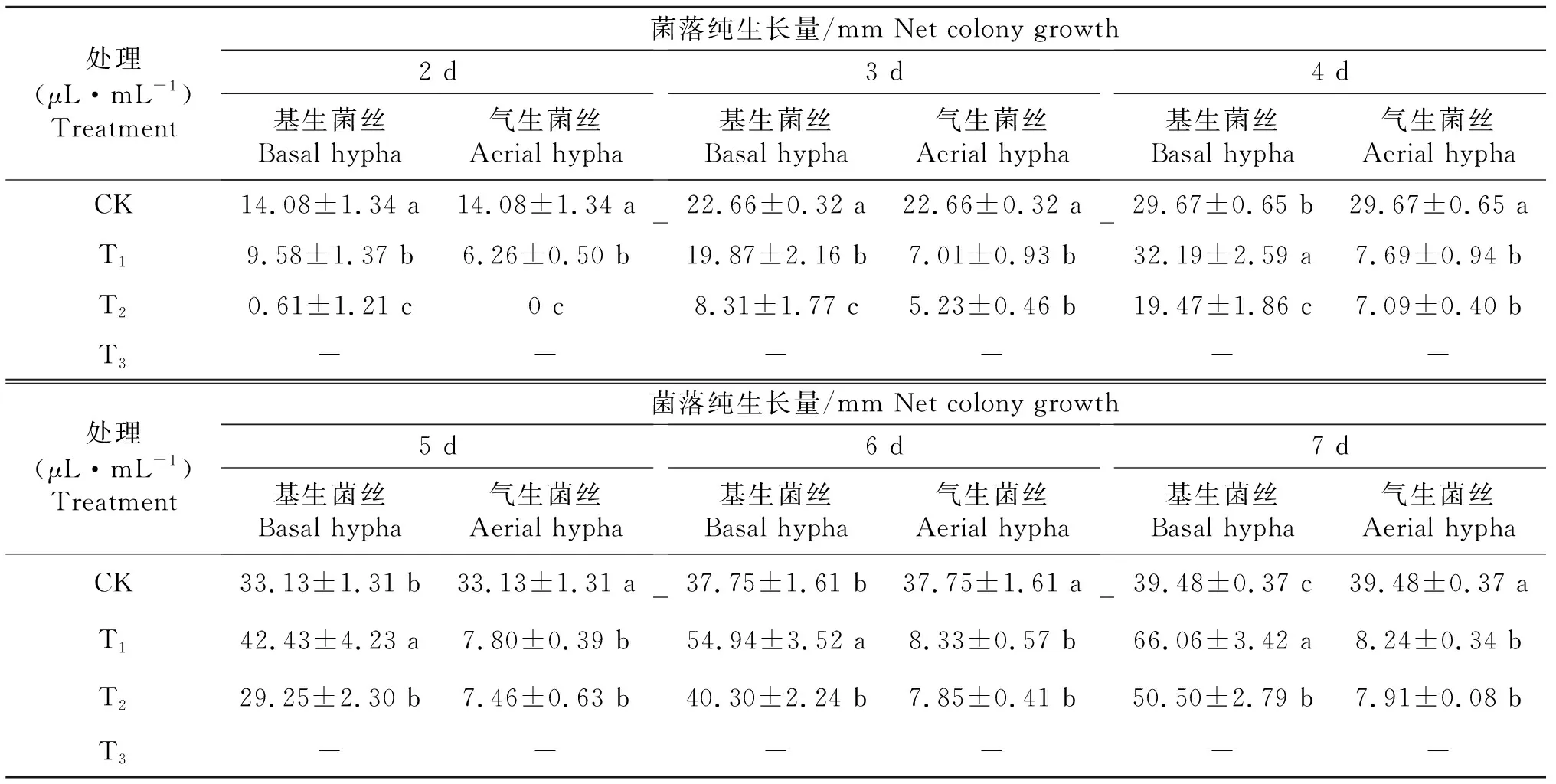
表1 AITC对尖孢镰刀菌菌丝的影响
2.1.2 AITC对尖孢镰刀菌的菌丝结构的影响 AITC对尖孢镰刀菌菌丝的形态结构具有破坏作用。如图2所示,CK中菌丝表面光滑,粗细均匀,分枝少,未观察到隔膜;T1处理中,菌丝表面粗糙,粗细不均,出现少量分枝,且菌丝内有膈膜出现;T2处理中,菌丝粗细明显不均,分枝越多,表面更显粗糙,膈膜更显繁多且膈膜处有缢缩形成,部分菌丝裂解。T3处理未能培养出菌丝结构。

圆圈部分表示菌丝分枝部分,箭头部分表示菌丝内膈膜部分(20×40)。The ringed part represents the bifurcation part of hypha,the arrow part represents the internal diaphragmatic part of hyphae(20×40).图2 AITC对尖孢镰刀菌产孢量的影响Figure 2 Effect of AITC on the spore production of Fusarium oxysporum
2.1.3 AITC对尖孢镰刀菌产孢量的影响 菌丝在固体培养基上生长时,分为基生菌丝和气生菌丝,基生菌丝伸入基质内吸收水分和养料,气生菌丝分化为繁殖菌丝,形成孢子。为进一步验证AITC对尖孢镰刀菌气生菌丝分化为繁殖菌丝的影响,测定了其产孢量。结果显示:AITC对尖孢镰刀菌的产孢量具有显著的抑制作用。相较于CK,T1处理中产孢量显著下降86.4%;T2处理中产孢量显著下降90.78%(P<0.05);T3处理则未形成孢子(图3)。
2.2 AITC对尖孢镰刀菌生理指标的影响
2.2.1 AITC对尖孢镰刀菌膜的通透性及渗透调节物质的影响 AITC对尖孢镰刀菌体内电导率具有显著的影响(P<0.05)。由图4-A可知,随着时间的延长,各处理间的相对电导率逐步增加,并随AITC浓度的增加而升高。当浓度≤0.015 μL/mL时,电导率变化相对较小,上升趋势较缓慢;当浓度为0.025 μL/mL时,其电导率变化明显,上升趋势显著。在10 h时,CK、T1、T2、T3处理所测定的电导率依此为28.6%、42.4%、55.5%、74.4%。在AITC的作用下,菌丝体中MDA和Pro的含量随着AITC浓度的增大而提高。如图4-B、4-C)所示,在72 h之前,处理T1、T2中MDA和Pro的含量均高于CK,72~96 h时,处理T1、T2中MDA和Pro的含量均趋于下降趋势,96 h时,MDA含量相较72 h依次下降了57.27%、65.39%;Pro含量相较72 h依次下降了10.66%、45.94%.

图3 AITC对尖孢镰刀菌菌丝结构的影响Figure 3 Effects of AITC on the structure of Fusarium oxysporum hypha
2.2.2 AITC对尖孢镰刀菌细胞抗氧化酶活性的影响 在AITC胁迫下,SOD、POD、CAT活性均呈现先上升后下降趋势。如图4-D所示,随着AITC浓度的增加,菌丝体中SOD活性逐渐增强,培养至72 h时,T1、T2处理中SOD活性相较CK增加了9.1%、77.8%;72 h后,T1、T2处理中SOD活性呈下降趋势,相较CK依次下降了23.4%、28.3%。如图4-E所示,随着AITC浓度的增加,菌丝体中CAT活性逐渐增强,培养至72 h时,对照与各处理均达到最大值,依次为162.22、185.56、218.89;72 h后,CK、T1、T2中CAT活性均呈下降趋势;96 h时,各处理中CAT活性相较于72 h时的酶活性依次下降了13.7%、31.7%、43.7%。POD活性的变化趋势与CAT活性的变化趋势大致相同,都随着AITC浓度的增加,菌丝体中酶活性逐渐增强。如图4-F所示,培养至72 h时,对照与各处理中POD活性均达到最大值;72 h后,CK、T1、T2中POD活性均呈下降趋势。
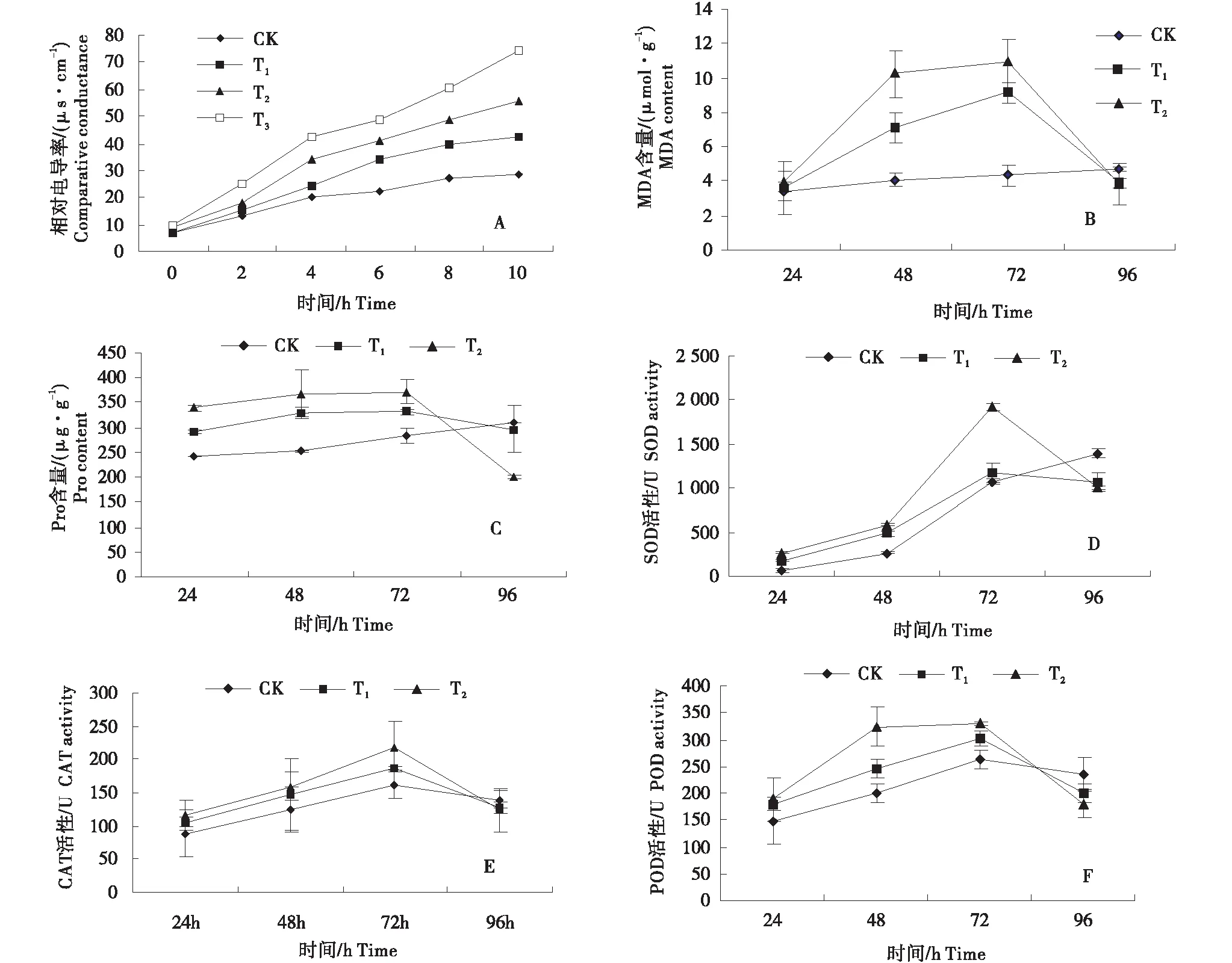
图4 AITC对尖孢镰刀菌通透性及氧化还原酶活性的测定Figure 4 Determination of permeability and oxidoreductase activity of Fusarium oxysporum by AITC
2.3 AITC对尖孢镰刀菌营养代谢的影响
尖孢镰刀菌受AITC作用,对培养基中还原糖的吸收利用产生显著影响。如图5-A所示,从给药时刻开始,在24 h时,CK中还原糖含量开始下降;48 h时,CK中还原糖含量达到最低且开始出现上升趋势,而T1、T2处理还原糖含量较CK高,这是由于部分菌丝尚且处于存活状态,培养基中的营养物质受到不同程度的消耗,24~96 h还原糖含量也不同程度的呈现下降趋势。T3处理由于菌丝基本死亡,培养基中还原糖始终未能消耗,即还原糖含量保持基本不变。
尖孢镰刀菌受AITC作用,对培养基中可溶性蛋白的形成产生显著影响(P<0.05)。由图5-B所示,各处理中可溶性蛋白均趋于上升趋势,但是T1、T2、T3处理中可溶性蛋白的含量均低于CK。因此,随着培养基中AITC浓度的增加,各处理中所含的可溶性蛋白含量呈降低趋势。

图5 AITC对培养基中还原糖及可溶性蛋白含量的影响Figure 5 The effect of AITC on the content of reducing sugar and soluble protein in the medium
3 讨论
AITC是来源于十字花科植物具有土壤消毒作用的功能化合物,对土壤病原菌、根结线虫及杂草均具有一定的抑制作用。本研究发现:AITC对尖孢镰刀菌菌丝生长及其产孢量均具有显著的抑制作用。与吴华等[26]关于AITC和EITC能够完全抑制尖孢镰刀菌厚垣孢子萌发的结果相符。结果还显示,AITC在0.005~0.015 μL/mL的浓度范围内,对尖孢镰刀菌的基生菌丝具有低促高抑的效应。AITC是源于十字花科植物的酯类化合物,酯类化合物为化感物质的一种,可以作为腐生真菌的优质碳原,促进真菌的生长。因此,本研究中AITC对镰刀菌产生“低促高抑”的浓度效应,可以解释为:低浓度的AITC作为碳源物质,促进了病原微生物的生长,而在高浓度下,对病原微生物产生了抑制作用。另外,在该浓度范围内,可分化为繁殖菌丝的气生菌丝因受AITC影响与基生菌丝出现明显的分化现象,即随着AITC浓度的增加,气生菌丝的抑制效果越明显,当AITC的浓度为0.025 μL/mL时,尖孢镰刀菌完全受到抑制。高橼等[27]在月腺大戟根总黄酮对尖孢镰刀菌抑制作用的研究中并未发现基生菌丝与气生菌丝的分化现象,这可能是由于AITC抑制了尖孢镰刀菌中蛋白质合成的启动和延迟反应引起[28],致使气生菌丝受到了抑制作用。由于气生菌丝发育到一定阶段会分化为繁殖菌丝,产生孢子,所以其产孢量明显受到影响。在菌丝的显微形态结构观察中发现,镰刀菌受AITC影响,菌丝表面粗糙,粗细不均,分枝及膈膜增多,并产生畸形。
MDA和Pro在生物体中的积累程度反映生物体在逆境环境下所受的胁迫程度[29]。本研究结果表明,AITC处理对镰刀菌造成了逆境胁迫,随AITC浓度的增加,镰刀菌菌丝内MDA及Pro的含量增加,生物细胞质膜过氧化程度增大,使细胞膜受到较大的伤害,最终造成细胞膜通透性增大,致使电解质外渗,电导率增大。SOD、CAT、POD具有将体内形成过氧化物转换为毒害较低或无害物质的功效,起到减缓氧化速度的作用,是生物体内源活性氧清除剂,它们的共同作用可以维持植物体内活性氧保持正常水平。在本试验中,由于菌丝受AITC胁迫,SOD、POD、CAT活性由于细胞内O-2、H2O2及酚类、胺类、醛类、苯类的生成,驱使SOD、CAT和POD活力暂时上升,但O-2、H2O2及酚类、胺类、醛类、苯类在菌体内积累,产生毒害,SOD、CAT和POD活性又随时间的延长逐渐下降,即呈现先上升后下降趋势。这与高橼等[27]关于月腺大戟根总黄酮对尖孢镰刀菌抑制作用的研究中对抗氧化酶活性的测定结果相符。同时,本研究还通过测定培养基中还原糖和可溶性蛋白的含量,评估了AITC对真菌营养代谢的影响。结果显示,尖孢镰刀菌受AITC影响,高浓度处理相较低浓度处理的培养基中还原糖含量增加,可溶性蛋白含量降低。这可能是由于AITC对菌丝体造成了破坏,还原糖的吸收利用受到阻止,无法为其他代谢提供原料,则蛋白质合成减少,菌丝体生长速度下降,随即外渗至培养液中的可溶性蛋白就越少。关于AITC对于真菌营养代谢的影响十分复杂,其机制机理还需进一步深入探讨。
4 结论
1) AITC对尖孢镰刀菌的孢子数量和菌丝生长两个方面均具有显著的抑制作用;在0.005~0.025 μL/mL的浓度范围内,浓度越大,抑菌效果越明显;当浓度为0.025 μL/mL时,对尖孢镰刀菌可起到完全的抑制作用.。
2) 以AITC作为主要成分的生物熏蒸剂进行兰州百合枯萎病病原菌的防治具有可行性。但是,在兰州百合产区早春低温干旱的土壤环境下,AITC对植物的安全性评价,是AITC应用技术研究的工作重点,还需要进一步深入研究。
