东海乌参多糖制备及其抗氧化活性研究
2022-05-09何卓宏李运超杨凌杰闻正顺
何卓宏 李运超 杨凌杰 闻正顺

摘要 [目的]研究不同浓度东海乌参粗多糖的体外抗氧化活性。[方法]利用碱解辅以木瓜蛋白酶解法提取东海乌参粗多糖,再用大孔树脂对其脱色后,对不同浓度的东海乌参粗多糖进行体外抗氧化活性研究。[结果]用AB-8型号的大孔树脂脱色后的东海乌参多糖,在0.5~2.0 mg/mL,随着东海乌参多糖浓度的增加其对羟基自由基、DPPH自由基、超氧阴离子自由基的清除能力以及还原力逐渐增强,且呈现浓度依赖性。[结论]东海乌参多糖体外抗氧化活性呈现明显的量效关系,在0.5~2.0 mg/mL,2.0 mg/mL的东海乌参多糖体外抗氧化活性最强。
关键词 东海乌参;多糖;制备;脱色;抗氧化活性
中图分类号 R 285 文献标识码 A 文章编号 0517-6611(2022)08-0160-03
doi:10.3969/j.issn.0517-6611.2022.08.044
开放科学(资源服务)标识码(OSID):
Preparation and Antioxidant Activity of Polysaccharides from Acaudina leucoprocta
HE Zhuo-hong, LI Yun-chao, YANG Ling-jie et al
(School of Food Science and Pharmaceutics, Zhejiang Ocean University, Zhoushan,Zhejiang 316022)
Abstract [Objective]To study the antioxidant activity in vitro of crude polysaccharides from Acaudina leucoprocta at different concentrations.[Method]The crude polysaccharides of Acaudina leucoprocta were extracted by alkaline hydrolysis supplemented by papain hydrolysis, and then decolorized with macroporous resin. The antioxidant activity in vitro of crude polysaccharides from Acaudina leucoprocta with different concentrations in vitro was studied.[Result] The polysaccharide was decolorized by AB-8 macroporous resin. In the concentration range of 0.5-2.0 mg/mL, the scavenging ability of polysaccharides from Acaudina leucoprocta on hydroxyl radical, DPPH radical and superoxide anion radical, and the reducing capacity enhanced with the increase of polysaccharide concentration. [Conclusion] The antioxidant activity in vitro of polysaccharides of Acaudina leucoprocta show a significant dose-effect relationship. In the concentration range of 0.5-2.0 mg/mL, 2.0 mg/mL of polysaccharides of Acaudina leucoprocta has the strongest antioxidant activity in vitro.
Key words Acaudina leucoprocta; Polysaccharide;Preparation; Decolorization; Antioxidant activity
东海乌参,又称为白肛海地瓜,属棘皮动物门、海参纲、海地瓜属,是一种海洋无脊椎生物 [1]。东海乌参体型呈纺锤形,长4~12 cm,颜色为棕黑色,因其颜色和体形都与地瓜相仿,因此又名“海地瓜”;其广泛分布于我国浙江、福建等沿海海域,资源丰富 [2]。东海乌参有着非常丰富的营养成分,包括蛋白质、多糖、皂苷、脂肪和氨基酸等活性成分 [3-4]。但因其重金属含量超標,不宜直接食用,因此许多研究者把目光转向了东海乌参的药用价值研究。
多糖从来源上区分,可大致分为植物多糖和动物多糖,大量的试验研究揭示了多糖具有多种有应用前景的药理和生理活性,而目前与植物多糖相关的活性研究较多,而与动物多糖相关的研究相对而言较少。如白羽等 [5]研究指出马齿苋多糖能对糖尿病大鼠心脏起保护作用;陈平等 [6]研究表明香菇柄多糖具有抗氧化活性;潘世杰等 [7]研究指出茯苓多糖能对小鼠急性胃黏膜损伤有保护作用。海参多糖是海参体壁的一种重要成分,含量约为6% [8]。研究表明,海参多糖具有极高的药用价值和生理活性,如蔡彬新 [9]研究显示海地瓜多糖能显著抑制高脂饮食诱导的小鼠血脂升高作用;龚燕波等 [10]研究得出海地瓜多糖可以显著增长实验小鼠的存活时间,有一定程度的抗衰老作用;钱晋等 [11]临床研究发现海参多糖具有抗凝和降低血黏度的功效。在我国东海乌参资源丰富易获取,且经济成本低廉,因此研究海参多糖具有极高的药用价值和临床价值。笔者研究了不同浓度的东海乌参粗多糖的体外抗氧化活性,为东海乌参多糖的进一步开发和利用打下基础。6ABFBC21-3921-40E9-A183-6C2C7E489A2B
1 材料与方法
1.1 试验材料
1.1.1 试材。
东海乌参原材料购自浙江宁波海鲜市场。
1.1.2
试剂。无水乙醇(20170413)、硫酸(10021618)、三氯甲烷(191108558F)、正丁醇(20210508)、苯酚(20171020)均来自国药集团化学试剂有限公司,纯度规格均为分析纯;DPPH自由基清除能力试剂盒(K1629061,南京建成生物工程研究所);邻苯三酚(EK290154,安耐吉);H2O2(B1826048,阿拉丁)。
1.1.3
仪器。中药粉碎机(103型,瑞安市永历制药机械有限公司);大容量低速离心机(TD5K,长沙旺东实验仪器有限公司);冷冻干燥机(FD-1E,北京德天佑科技发展有限公司);恒温水浴锅(HH-S,巩义市予华仪器责任有限公司);SB-1100型旋转蒸发仪(上海爱朗仪器有限公司);电子分析天平(梅特勒-托利多国际贸易有限公司);Multiskan FC全自动酶标仪(赛默飞世尔科技有限公司)。
1.2 试验方法
1.2.1 东海乌参多糖的提取。
东海乌参清洗干净后去除内脏,接着将东海乌参放入烘箱中50 ℃充分烘干,然后用粉碎机将烘干后的东海乌参粉碎成细粉状,最后将细粉过80目筛得到的东海乌参干粉备用。称取100 g东海乌参干粉,加入400 mL 6%NaOH溶液在4 ℃浸提24 h。然后使用冰醋酸调节pH至6.5,接着再添加5 g木瓜蛋白酶在55 ℃条件下酶解5 h后,置于100 ℃灭酶。冷却后3 000 r/min离心10 min,离心后取用上清液。往上清液里加入1/5体积Sevage溶液进行脱蛋白,磁力搅拌40 min后,接着3 000 r/min离心10 min,然后弃去溶液的蛋白层和有机试剂,只留取上清液,再往上清液中加入Sevage溶液,重复该步骤多次,直至溶液离心分层后再无蛋白层。最后进行醇沉操作,即加入4倍体积的无水乙醇溶液于上清液中,静止24 h后离心取沉淀,加水溶解后于-45 ℃冻干,得东海乌参粗多糖。
1.2.2 多糖脱色率和保留率的测定。
在300~600 nm对还未脱色的东海乌参多糖进行扫描,以确定未脱色的东海乌参多糖的最大吸收波长为380 nm,因此用380 nm处的吸光度来表征东海乌参多糖溶液的色值,根据公式(1)计算脱色率。采用苯酚-硫酸法对东海乌参多糖的含量进行测定,根据公式(2)计算多糖保留率。
脱色率=脱色前吸光度-脱色后吸光度脱色前吸光度×100%(1)
多糖保留率=脱色后多糖含量脫色前多糖含量×100%(2)
1.2.3 大孔树脂预处理。
试验前让大孔树脂在无水乙醇溶液完全浸泡24 h,将浸泡好的大孔树脂装柱后用乙醇溶液淋洗,直至淋洗的流出液与水按1∶5的比例混合后不发生浑浊。接着将乙醇溶液换成纯水继续淋洗,直到淋洗至无醇味。然后用配制好的5% HCl溶液流经树脂柱,使树脂柱完全浸泡在5% HCl溶液中2~4 h,接着用纯水淋洗至中性后,再用配制好的2% NaOH溶液通过树脂柱,使其完全浸泡在2% NaOH溶液中2~4 h,最后用纯水淋洗至中性后,备用。
1.2.4 大孔树脂筛选。
称取处理好的3种树脂D101、AB-8和732阳离子树脂各50 g装柱,对东海乌参多糖溶液进行动态吸附试验。树脂装柱平衡后,将东海乌参多糖配制成50 mg/mL 的溶液,加入10 mL过柱,上样流速为2 BV/h,上样后待吸附完全后,用纯水以2 BV/h的流速洗脱,直至层析柱流出液未检测出糖为止。
1.2.5 东海乌参多糖的体外抗氧化活性研究。
1.2.5.1 羟基自由基清除能力的测定。
将体积为1 mL 0.03%过氧化氢溶液分别与1 mL 9 mmol/L 的硫酸亚铁溶液、1 mL 9 mmol/L 水杨酸的50%乙醇溶液和1 mL不同浓度的东海乌参粗多糖溶液37 ℃条件下精确反应1 h,然后等到所有溶液冷却至室温,再于510 nm处测定溶液吸光度,将该吸光度记为A1;用蒸馏水替换东海乌参粗多糖溶液来设置空白对照组,对该组测得的吸光度记为A2;将水杨酸的50%乙醇溶液换成50%乙醇溶液设为样品对照组,该组测得的吸光度记为A3。羟基自由基清除率的计算公式如下:
清除率=(1-A1-A3A2)×100%(3)
1.2.5.2 DPPH自由基清除能力的测定。
加入2 mL的DPPH(1,1-二苯基-2-苦苯肼)溶液于干净的玻璃试管中,接着往试管中加入1 mL的无水乙醇,将试管内的溶液充分混匀后,置于避光条件下充分反应30 min,最后在519 nm处测定溶液的吸光度,将该溶液的吸光度记为A1。量取2 mL的DPPH溶液加入至干净的玻璃试管中,接着向试管中分别加入不同浓度的东海乌参多糖溶液0.5 mL,然后再加入0.5 mL无水乙醇溶液,将试管内的溶液充分混匀后,同样置于避光条件下完全反应30 min,测定该溶液517 nm处吸光度,将其记为A2。DPPH自由基清除率的计算公式如下:
清除率=A1-A2A1×100%(4)
1.2.5.3 超氧阴离子自由基清除能力的测定。
将配制好的0.1 mol/L 的Tris-HCl溶液(pH=8.2)按2.25 mL加入到各试管内,在25 ℃下水浴20 min后,继续向试管内分别加入不同浓度东海乌参多糖溶液500 μL和25 mmol/L的邻苯三酚溶液250 μL,将试管置于室温下反应5 min后取出,接着向试管中加入2 mol/L的HCl溶液0.5 mL。静置一段时间后,最后于325 nm处测定该溶液的吸光度,将其记为A1。空白组的设置则为用等体积的去离子水替换样品溶液,将其记为A2。超氧阴离子自由基清除率的计算公式如下:6ABFBC21-3921-40E9-A183-6C2C7E489A2B
清除率=A2-A1A2×100%(5)
1.2.5.4 还原力。
配制浓度分别为0.5、1.0、1.5、2.0 mg/mL 4个梯度的东海乌参多糖样品溶液,分别量取2 mL的东海乌参多糖溶液于干净的玻璃试管中,接着向试管内加入2 mL的0.2 mol/L pH 6.6的PBS溶液和2 mL 1%铁氰化钾溶液,将试管内的溶液充分混合均匀,再将试管置于50 ℃条件下,恒温水浴20 min,水浴完成后向试管内加入2 mL的10% 三氯乙酸(TCA)溶液,将试管内溶液充分混合,最后于700 nm处测定该溶液的吸光度。通过吸光度的大小来判断东海乌参多糖的还原能力。
2 结果与分析
2.1 东海乌参多糖的脱色率和保留率
树脂D101、AB-8和732对东海乌参多糖溶液的动态吸附试验的结果如表1所示,由三者结果比较可知,树脂AB-8的脱色效果最佳,其得到的多糖保留率为82.8%,脱色率为64.7%。因此,用AB-8树脂脱色后的东海乌参多糖进行体外抗氧化试验研究。
2.2 东海乌参多糖的抗氧化活性
2.2.1 羟基自由基清除能力。
羟基自由基的化学活性强,易与氨基酸、蛋白质和DNA等生物分子发生反应,并且也可以有效地诱发脂质的过氧化反应。因此,去除羟基自由基可能是机体对抗各种疾病最有效的防御手段之一。从不同浓度东海乌参多糖对羟基自由基的清除能力(图1)可以看出,在浓度为0.5~2.0 mg/mL,东海乌参多糖的浓度越高,则其对羟基自由基的清除能力越强;在2.0 mg/mL浓度下,东海乌参多糖对羟基自由基的清除能力达到50%。
2.2.2 DPPH自由基清除能力。
DPPH已广泛用于抗氧化活性分析,该测试体系可用于初步表征化合物的清除能力。从图2可以看出,东海乌参多糖样品浓度越高,其对DPPH自由基清除能力越强。当东海乌参多糖浓度从0.5 mg/mL增加至2.0 mg/mL时,东海乌参多糖对DPPH自由基的清除率也从30%增加至45%。
2.2.3 超氧阴离子自由基清除能力。
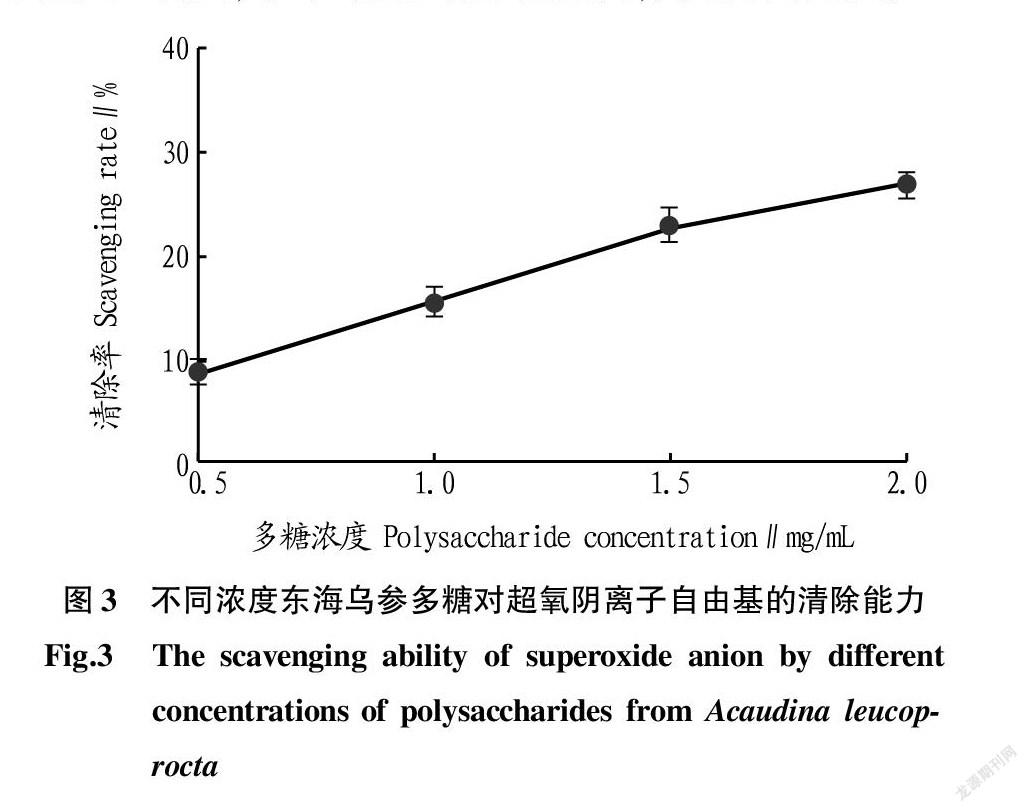
超氧阴离子自由基通常首先在细胞氧化反应中形成。超氧阴离子自由基是生物体内形成自由基的重要来源,虽然其本身活性不高,但通过多种反应超氧阴离子自由基可以产生活性较高的过氧化氢和羟基自由基,使氧化反应更易发生。从不同浓度东海乌参多糖对超氧阴离子自由基的清除能力(图3)可以看出,东海乌参多糖样品浓度越高,其对超氧阴离子自由基的清除能力越强。当东海乌参多糖浓度为2.0 mg/mL时,其对超氧阴离子自由基的清除率为26%。
2.2.4 還原力。
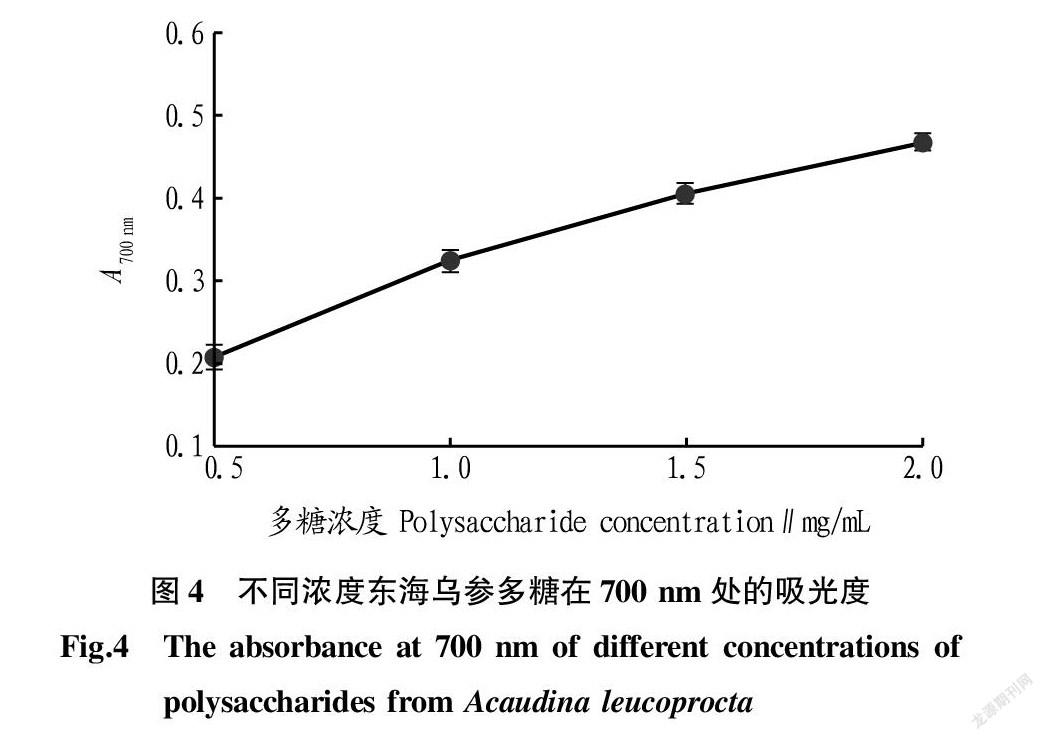
抗氧化活性可以通过还原力反映,还原力越强,抗氧化活性越强。700 nm 吸光度越高,东海乌参多糖的还原性越强。从图4可以看出,溶液吸光度与东海乌参多糖浓度呈正相关,东海乌参多糖浓度越高,其还原力越强。
3 结论与讨论
通过碱提法提取东海乌参体壁中的多糖,分别用树脂D101、AB-8和732对东海乌参多糖进行脱色处理,树脂AB-8得到的多糖保留率为82.8%、脱色率为64.7%,为3种树脂中最佳。
羟基自由基清除能力的测定可为抗氧化活性提供了有力的参考,高羟基自由基清除能力增强了其抗氧化能力和保护羟基自由基损伤的能力 [12]。该研究结果表明,东海乌参多糖浓度在0.5~2.0 mg/mL,其浓度与羟基自由基的清除能力有明显的量效关系,2.0 mg/mL浓度下,东海乌参多糖对羟基自由基的清除能力最强,清除率高达50%。试验结果显示了东海乌参多糖对羟基自由基有较好的清除能力。
大多数自由基活性高,存在时间短。DPPH自由基是在室温下仍能保持稳定的少量自由基之一。DPPH自由基在517 nm处具有很好的吸光度,吸光度水平的减少代表着抗氧化性的增加,如果用清除率来表示,则清除率越大抗氧化性就越强 [13]。该试验结果表明,东海乌参多糖随浓度的增加对DPPH自由基的清除能力逐渐增强,具有明显地抑制DPPH自由基的能力,有较强的抗氧化性。
超氧阴离子自由基及其衍生物均具有细胞损伤性,可对DNA和细胞膜造成损伤。因此,清除超氧阴离子自由基对生
命体来说至关重要 [14]。该研究结果表明,东海乌参多糖对超氧阴离子自由基的清除能力呈现剂量依赖,浓度为2.0 mg/mL时,清除率最高。
该试验检测了东海乌参多糖的还原力,从试验结果可知,东海乌参多糖的还原力与其浓度呈正相关。
综上可知,经AB-8树脂脱色后的东海乌参多糖具有抗氧化活性,在一定范围内,其抗氧化能力与浓度呈正相关。该试验结果为东海乌参多糖的进一步活性研究和开发利用提供参考。
参考文献
[1] 廖玉麟.中国动物志:棘皮动物门 海参纲[M].北京:科学出版社,1997.
[2] 罗先群,王新广,杨振斌.海地瓜的开发和利用[J].食品研究与开发,2000,21(3):34-35.
[3] 苏永昌,刘淑集,刘秋凤,等.海地瓜营养成分的分析及评价[J].渔业研究,2016,38(4):288-294.
[4] 伏纬华,吴凤梧,戚宝凤,等.海地瓜与海参营养成分的比较[J].现代应用药学,1991,8(3):46-47.
[5] 白羽,王燕,张心雨,等.马齿苋多糖对糖尿病心肌病大鼠的影响[J].中成药,2021,43(10):2858-2862.
[6] 陈平,江崇弘.香菇柄多糖的提取纯化及抗氧化活性研究[J].科学技术创新,2021(30):47-49.
[7] 潘世杰,丁丽婷,胡婕伦,等.茯苓多糖对乙醇致小鼠急性胃黏膜损伤的辅助保护作用[J].食品研究与开发,2021,42(17):1-6.6ABFBC21-3921-40E9-A183-6C2C7E489A2B
[8] QIN Y J,YUAN Q X,ZHANG Y X,et al.Enzyme-assisted extraction optimization,characterization and antioxidant activity of polysaccharides from sea cucumber Phyllophorus proteus[J].Molecules,2018,23(3):1-19.
[9] 蔡彬新.海地瓜多糖提取純化及其降血脂活性研究[D].福州:福建农林大学,2009.
[10] 龚燕波,方崇波,邵青.海地瓜多糖的抗衰老生物活性研究[J].基层中药杂志,2001(5):17-18.
[11] 钱晋,过鑫昌,王学锋,等.玉足海参酸性粘多糖对冠心病患者血凝、血液粘度及血脂的影响[J].上海医学,1997,20(6):342-344.
[12] JE J Y, PARK P J, KIM S K.Antioxidant activity of a peptide isolated from Alaska pollack(Theragra chalcogramma)frame protein hydrolysate[J].Food research international,2005,38(1):45-50.
[13] GHRIBI A M,SILA A,PRZYBYLSKI R,et al.Purification and identification of novel antioxidant peptides from enzymatic hydrolysate of chickpea (Cicer arietinum L.)protein concentrate[J].Journal of functional foods,2015,12:516-525.
[14] XIE Z J, HUANG J R, XU X M,et al.Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J].Food chemistry,2008,111(2):370-376.6ABFBC21-3921-40E9-A183-6C2C7E489A2B
