氨磷汀对小鼠肝脏缺血再灌注损伤的保护作用
2022-05-07黄烽如
潘 艳,黄烽如
1 江苏医药职业学院 基础医学部,盐城 224005;2 复旦大学附属肿瘤医院 药剂科,上海 200032
缺血再灌注损伤(ischemia/reperfusion injury,IRI)是指组织器官缺血缺氧,恢复血流供应后,则进一步加重组织器官损伤的病理生理过程[1]。在肝脏部分切除和肝移植等手术过程中,为了降低出血量,经常需要持续阻断入肝血流,造成肝脏缺血再灌注损伤,这会增加术后肝功能衰竭发生率和围手术期死亡风险[2]。故深入研究肝脏缺血再灌注损伤的发生机制,以及寻找降低肝脏缺血再灌注损伤的方法具有重要的临床意义[3]。
氨磷汀是一种细胞保护剂,在临床中主要用于降低放疗和化疗副作用[4]。最新研究显示,氨磷汀在预防脊髓、肾脏、肺、心脏和脑等器官的缺血再灌注损伤中发挥着一定的保护作用[5,6],但其是否能预防肝脏缺血再灌注损伤尚不清楚。本实验的目的是研究氨磷汀预处理对小鼠肝脏缺血再灌注损伤的作用及其相关机制。
1 材料和方法
1.1 材料
30 只雄性C57BL/6 小鼠,体重18~20 g,由复旦大学附属肿瘤医院实验动物中心提供;饲养在SPF级动物房内,造模前12 h 禁食,不禁水。
氨磷汀(阿米福汀)购于美罗药业;丙氨酸氨基转移酶(ALT)测试盒和天门冬氨酸氨基转移酶(AST) 测试盒由南京建成生物工程研究所提供;TUNEL 凋亡诊断试剂盒购于Roche;多克隆兔抗小鼠抗体 Cytochrome C、Bcl -2、BAX、Caspase -3、GAPDH 和HRP 标记的山羊抗兔IgG 均由沈阳万类生物技术公司提供。
1.2 方法
1.2.1 肝脏IRI 模型建立小鼠腹腔注射1%戊巴比妥钠麻醉,剂量为50 mg·kg-1,采用腹部正中切口暴露小鼠肝脏,仔细分辨小鼠肝脏各叶,用棉签游离第一肝门,找出支配肝脏左叶和中叶血管的共干,夹闭两叶血管共干,使得肝左叶和中叶肝组织缺血,以实现70%肝脏组织缺血。肉眼观察肝组织色泽变化,以确定造模是否成功;当肝脏组织由红色变成白色时表明造模成功,临时关闭腹腔,注意保温,当缺血45 min 后松开血管夹,关闭腹腔,将小鼠放在保温毯上等待其苏醒。
1.2.2 实验分组及具体步骤30 只雄性C57BL/6小鼠运用随机化数字表分为3 组:假手术组、模型组和氨磷汀组;每组各10 只。假手术组:小鼠仅开腹,解剖肝门,不结扎血管,45 min 后关闭腹腔。模型组:小鼠只建立部分缺血再灌注损伤模型,不预处理。氨磷汀组:小鼠在建立部分缺血再灌注损伤模型15 min 前予尾静脉注入剂量为400 mg·kg-1的氨磷汀预处理。当达到180 min 再灌注时间,麻醉3 组小鼠,取肝脏组织和血液,部分肝组织用4%多聚甲醛固定,部分肝组织液氮速冻,保存在-80 ℃冰箱里,血液离心后,取上清液血清保存于-80 ℃冰箱里。
1.2.3 转氨酶检测采用ALT 测定试剂盒和AST测定试剂盒分别检测各组小鼠血清ALT 和AST 水平来评估肝细胞功能,根据试剂盒说明书进行操作,最后用酶标仪在510 nm 处测定各样本数值,计算后得出各样本ALT、AST 数值。
1.2.4 HE 染色在HE 染色过程中,石蜡组织切片大致经过脱蜡、脱水、染苏木素、盐酸酒精分化、染伊红、透明和封片等步骤,在高倍镜下(×400)随机观察。肝组织病理分析采用Suzuki 评分。Suzuki 评分含3 项:肝细胞坏死、肝窦淤血和细胞质空泡化;每项指标损伤程度由轻到重以0~4 分计。
1.2.5 TUNEL 染色根据TUNEL 凋亡诊断试剂盒(Roche)操作说明书,将石蜡切片进行染色。在高倍镜下(×400)随机观察,每张片取5 个视野计数,计算平均值,计数肝细胞总数和TUNEL 阳性细胞总数。阳性比值=TUNEL 阳性细胞数/肝细胞总数。
1.2.6 免疫印迹技术提取各组肝组织总蛋白,用BCA 法测定蛋白浓度,加入上样缓冲液后煮沸5min,放入-20 ℃冰箱 保存。上样前煮沸5 min,用10%SDS-PAGE 电泳分离蛋白,并转移至聚偏二氟乙烯膜上进行电转,转膜结束后,室温条件下在摇床上用5%脱脂奶粉封闭处理聚偏二氟乙烯膜2 h,加入多克隆兔抗小鼠抗体Cytochrome C、Bcl-2、BAX、Caspase-3 和GAPDH,稀释比例均为1∶500。4 ℃过夜,用TBST 洗膜3 次后,加入辣根过氧化物酶(HRP)标记的山羊抗兔IgG(稀释比例为1∶3000),37 ℃反应1 h,再用TBST 洗膜3 次,于暗室内曝光成像。以GAPDH 为内参照,以目的蛋白灰度值/GAPDH 灰度值的比值计算目的蛋白的表达量。
1.2.7 统计分析采用SPSS 20.0 统计包和Graph-Pad Prism 5 进行统计分析。所有数据以均值±标准差()表示。分析方法为单因素方差分析。P<0.05为差异有统计学意义。所有实验均重复3 次。
2 结果
2.1 各组肝功能的比较
为了研究氨磷汀预处理对缺血再灌注损伤后肝功能的影响,采用血清ALT 和AST 来评估肝功能,结果如图1 所示。假手术组ALT 和AST 数值分别为(51.60±8.72)IU·L-1和(95.74±14.25)IU·L-1;模型组分别为(792.12±69.74)和(970.71±130.08)IU·L-1;氨磷汀预处理组分别为(559.77±95.49)IU·L-1和(781.49±80.62)IU·L-1。模型组ALT 和AST 数值高于假手术组,而氨磷汀预处理组ALT 和AST 数值则低于模型组,差异均有统计学意义(P<0.05)。
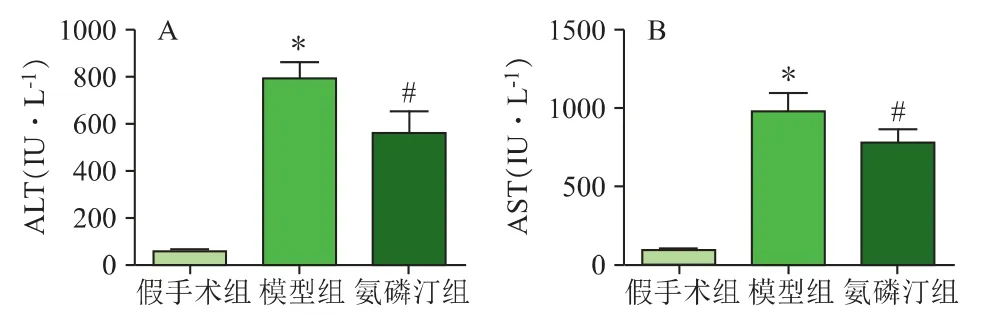
图1 各组小鼠血清ALT 和AST 的变化(,n=10)
2.2 各组肝组织病理变化的比较
为了研究氨磷汀预处理对缺血再灌注损伤后肝组织病理变化的影响,采用Suzuki 评分来评估肝组织病理变化,结果如图2A、图2C 所示。假手术组肝组织结构正常;模型组肝组织表现为肝窦充血、炎性细胞浸润,许多肝细胞肿胀、空泡和坏死。与模型组相比,氨磷汀预处理组肝细胞空泡和坏死显著减少。Suzuki 评分结果显示,模型组评分高于假手术组,而氨磷汀预处理组评分低于模型组,差异均有统计学意义(P<0.05)。
2.3 各组肝细胞凋亡情况的比较
为了研究氨磷汀预处理对缺血再灌注损伤后肝细胞凋亡情况的影响,采用TUNEL 染色评估肝细胞凋亡情况,结果如图2B、图2D 所示。假手术组、模型组、氨磷汀预处理组TUNEL 染色阳性细胞比值分别为2.73%±1.05%、60.77%±7.40%、41.92%±4.38%。假手术组基本上未见凋亡细胞,模型组出现大量凋亡细胞,氨磷汀预处理组凋亡细胞则较模型组减少;差异均具有统计学意义(P<0.05)。

图2 各组小鼠肝组织HE 染色和TUNEL 染色(,n=10)
2.4 各 组Cytochrome C、Bcl-2、Bax 和Caspase-3 蛋白相对表达情况的比较
为了初步研究氨磷汀预处理抑制缺血再灌注损伤后肝细胞凋亡的分子机制,采用Western blotting 检测Cytochrome C、Bcl-2、Bax 和Caspase-3 蛋白相对表达情况,结果如图3 所示。与假手术组相比,模型组的Cytochrome C、Bax 和Caspase-3 蛋白表达均升高(P<0.05),而Bcl-2 蛋白表达降低(P<0.05);氨磷汀预处理组的Cytochrome C、Bax 和Caspase-3 蛋白表达较模型组降低(P<0.05),Bcl-2蛋白表达升高(P<0.05)。
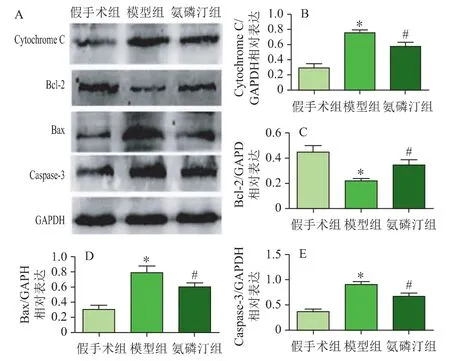
图3 各组Bcl-2、Bax、Caspase-3 和Cytochrome C 蛋白相对表达(,n=8)
3 讨论
氨磷汀是一种无活性的化合物,被与细胞膜结合的碱性磷酸酶去磷酸后成为具有活性的代谢产物—WR-1065。当其进入细胞后,具有清除自由基、保护细胞膜和DNA 免受损伤的作用。目前氨磷汀是临床上应用广泛、效果确切的细胞保护剂[7]。在此通过阻断小鼠70%血流入肝,成功构建了小鼠肝脏IRI 模型,并通过尾静脉注入氨磷汀证实其可以降低肝脏缺血再灌注损伤。虽然之前的研究表明,氨磷汀可以减轻脊髓、肾脏、肺、心脏和脑等器官缺血再灌注损伤,但是本研究首次阐明了氨磷汀对肝脏缺血再灌注损伤的保护作用以及潜在的分子机制。
缺血再灌注损伤的机制比较复杂,主要涉及氧化应激、细胞内钙离子超载、线粒体能量障碍、细胞凋亡、细胞自噬和炎症反应等多个方面[8]。大量研究证实,细胞凋亡是一种程序性死亡过程,在肝脏缺血再灌注损伤过程中起着重要的作用[9]。有实验显示,肝脏经过缺血再灌注后50%~70%的肝窦内皮细胞和40%~60%肝细胞出现凋亡[10]。本研究显示,小鼠肝脏组织经过45 min 缺血180 min 再灌注后,约60%的肝细胞发生凋亡;但是经过氨磷汀预处理后,可以显著降低缺血再灌注损伤诱导的肝细胞凋亡。
目前研究表明,多条途径参与细胞凋亡[11],比如线粒体途径,细胞色素C 的释放是此途径的关键之一,线粒体膜破裂会释放出细胞色素C(Cytochrome C)到细胞质中,与凋亡蛋白活化因子1 结合形成多聚体,该多聚体与凋亡起始分子caspase-9 结合形成凋亡小体,再激活下游的凋亡执行分子caspase-3等,进而启动凋亡蛋白酶的级联反应,最终诱导细胞凋亡[12]。本研究显示,持续肝脏血流阻断,细胞色素C 蛋白表达升高,而经过氨磷汀预处理后,细胞色素C 蛋白表达会降低,这说明氨磷汀预处理可以通过降低线粒体的损伤、抑制细胞色素C 的释放,来阻止缺血再灌注对肝细胞的损伤。
除此之外,Bcl-2 家族也在线粒体途径中发挥着重要的作用,包括抗凋亡蛋白(Bcl-2、Bcl-xl 和Bcl-w)和促凋亡蛋白(Bax、Bak)[13]。Wu SZ 等[5]研究发现,氨磷汀预处理可以减轻心脏缺血再灌注损伤,减少心肌细胞凋亡和心脏梗死面积,其保护机制主要通过提高Bcl2 蛋白表达、降低Bax 蛋白和caspase-3 蛋白表达,最终减少TUNEL 阳性细胞产生。Cheng H 等[6]在研究氨磷汀预防脑缺血再灌注损伤的实验中发现,氨磷汀预处理可通过下调Bax、caspase-9 和caspase-3 蛋白表达,以及上调Bcl-2蛋白表达,来抑制缺血再灌注损伤诱导的神经细胞凋亡。本研究构建的肝脏缺血再灌注损伤模型实验表明,氨磷汀预处理可以通过提高Bcl-2 蛋白表达和降低Bax,Caspase-3 蛋白表达等机制来减轻缺血再灌注对肝细胞的损伤。
综上所述,本实验显示,氨磷汀可以阻止缺血再灌注损伤诱导的Cytochrome C 的释放,上调Bcl-2 蛋白表达和下调Bax 蛋白表达,最终通过抑制肝细胞凋亡来减轻肝脏缺血再灌注损伤。
