胡桃叶色素的提取工艺优化及其抗氧化活性研究
2022-05-06王涵艾合买提江艾海提
王涵,艾合买提江·艾海提
(新疆大学 生命科学与技术学院,乌鲁木齐 830046)
胡桃又叫核桃,被誉为“万岁子”、“长寿果”[1],是一种营养和经济价值都很高的珍贵果木[2]。胡桃叶含有多种营养物质,如维生素B、维生素C及胡萝卜素等,也含有丰富的生物活性物质,如核桃醌、核桃甙等。胡桃叶的药理功能在我国民间早有记载,其制剂能改善新陈代谢,促进机体强壮,对患维生素缺乏症、皮肤病等均有较好疗效[3-4]。随着胡桃的生产,胡桃叶在短时间内大量堆积,通常处理方法是堆砌焚烧,造成严重的环境污染和资源的极大浪费。为了使这一巨大自然资源得到更合理的利用,需对胡桃叶资源进行深度开发研究。目前国内外对胡桃叶的研究有Abbasi Z等[5]和Jelodar G等[6]表明胡桃叶色素的药理功能,Vieira V等[7]表明葡萄牙东北部胡桃叶具有抑菌活性,翟梅枝等[8]研究胡桃叶的化学组成,而对胡桃叶色素的相关研究相对较少。
植物色素的提取方法有很多:溶剂提取法、超临界流体萃取法、超声辅助提取法等。溶剂提取法是植物色素提取常用的方法,但仍存在效率低、提取效果不佳等弊端;超临界流体萃取法设备复杂、价格昂贵,而超声辅助提取法能缩短提取时间,易操作。目前多见于提取黑玉米色素、青花椒色素和洋葱色素等,用于胡桃叶色素的提取还未见报道[9-10]。
胡桃叶中含有多种酚类化合物如萘醌类及其衍生物、黄酮类、鞣质等[11]。表明胡桃叶色素具有强大的抗氧化性。为更好开发胡桃叶色素提供理论依据,通过单因素试验和响应面分析法,对胡桃叶色素的提取条件进行优化,同时对得到的胡桃叶色素抗氧化活性进行分析。
1 材料与方法
1.1 材料与仪器
胡桃叶:采自于新疆阿克苏地区;无水乙醇、柠檬酸、氢氧化钠(粒)、甲醇、石油醚、硫酸亚铁、30% H2O2、水杨酸、1,1-二苯基-2-三硝基苯肼(DPPH)标准品:以上试剂除注明外均为分析纯。
RHP-1000A型高速多功能粉碎机 吴哲食品机械厂;SB-3200DTD型超声波清洗机 宁波新芝生物科技股份有限公司;FA1004B型电子天平 上海越平科学仪器(苏州)制造有限公司;RE-3000型旋转蒸发器 上海亚荣生化仪器厂;Multiskan Sky酶标仪 ThermoFisher Scientific公司;101型电热鼓风干燥箱、XMTD-4000型电热恒温水浴锅 北京市永光明医疗仪器有限公司。
1.2 试验内容
1.2.1 原料预处理
将清净的胡桃叶放置于50 ℃的恒温干燥箱内,干燥至恒重,粉碎,过80目筛,在干燥器中保存待用。
1.2.2 最佳提取溶剂及最佳吸收波长的确定
准确称取2.0 g胡桃叶粉6份,置于6个50 mL离心管中,分别加入20 mL蒸馏水、0.5%柠檬酸、3%氢氧化钠、50%乙醇、甲醇、石油醚,然后于室温振荡50 min,抽滤,观察色泽差异与溶解性。抽滤,取滤液1 mL定容至100 mL,进行全波长扫描,确定最佳提取溶剂及最佳吸收波长。
1.2.3 单因素试验设计
1.2.3.1 乙醇浓度对色素提取效果的影响
准确称取2.0 g胡桃叶粉共5份,分别置于5个50 mL离心管中,分别加入30%、40%、50%、60%、70%的乙醇溶液,液固比5∶1(mL/g),超声时间50 min,超声功率108 W,抽滤,取1 mL稀释100倍,在231 nm处测其吸光度。
1.2.3.2 超声时间对色素提取效果的影响
准确称取2.0 g胡桃叶粉共5份,分别置于5个50 mL离心管中,在50%乙醇浓度条件下,液固比5∶1(mL/g),分别超声30,40,50,60,70 min,超声功率108 W,抽滤,取1 mL稀释100倍,在231 nm处测其吸光度。
1.2.3.3 液固比对色素提取效果的影响
准确称取2.0 g胡桃叶粉共5份,分别置于5个50 mL离心管中,在50%乙醇浓度和超声时间50 min的条件下,液固比分别为3∶1、4∶1、5∶1、6∶1、7∶1(mL/g),超声功率108 W,抽滤,取1 mL稀释100倍,在231 nm处测其吸光度。
1.2.3.4 超声功率
准确称取2.0 g胡桃叶粉共5份,分别置于5个50 mL离心管中,在50%乙醇浓度、超声时间50 min和液固比5∶1(mL/g)的条件下,超声功率分别为72,90,108,126,144 W,抽滤,取1 mL稀释100倍,在231 nm处测其吸光度。
1.2.4 响应面优化试验
对单因素试验结果进行分析,在此基础上,选取色素提取试验中的乙醇浓度、超声时间、液固比和超声功率4个因素为自变量,以提取色素的吸光度值为响应值R,采用Design Expert 8.0.6软件对试验数据进行回归分析, 预测胡桃叶色素提取最佳工艺,具体因素水平表见表1。

表1 响应面优化超声辅助提取试验的因素与水平值Table 1 The factors and levels of response surface optimization for ultrasonic-assisted extraction test
1.3 胡桃叶色素提取物的抗氧化活性分析
1.3.1 胡桃叶色素提取物对羟自由基(·OH)清除能力的测定
羟自由基(·OH)清除能力的测定参考王玢[12]的方法,将胡桃叶色素浓缩液用超纯水稀释,配制成25,50,75,100,125,150,175,200 mg/L的待测溶液。向25 mL比色管中加入2 mol/L FeSO43 mL,1 mol/L H2O23 mL摇匀;其中H2O2是最后加入并启动整个反应,接着加入6 mol/L水杨酸3 mL,摇匀,于37 ℃水浴加热15 min后取出,在510 nm处测其吸光度A0。然后加入待测液1.0 mL摇匀,继续水浴加热15 min,取出测其吸光度AX。为消除后加的1.0 mL待测液所造成的体系吸光度值的降低,方法同上。恒温15 min后测其吸光度值A00,加1 mL蒸馏水,摇匀后再测一次其吸光度AXX,A降低=A00-AXX。按照下式计算羟自由基清除率。
羟自由基清除率(%)=(A0-AX-A降低)/A0×100%。
1.3.2 胡桃叶色素对DPPH自由基清除能力的测定
DPPH自由基清除能力的测定参考郑岚等[13]的方法。将胡桃叶色素浓缩液用超纯水稀释,配制成25,50,75,100,125,150,175,200 mg/L的待测溶液。用移液枪抽取不同浓度的待测样品液2 mL与DPPH溶液2 mL,把它们加入同一试管中,混匀后避光反应30 min,于波长517 nm处测定其吸光度A。用移液枪抽取不同浓度的待测样品液2 mL与2 mL乙醇溶液,把它们加入同一试管中,混匀后避光反应30 min,测定其吸光度A0。用移液枪抽取2 mL去离子水与2 mL DPPH乙醇溶液,把它们加入同一试管中,混匀后避光反应30 min,测定其吸光度A1。按照下式计算DPPH自由基清除率。
DPPH自由基清除率(%)=[1-(A-A0)/A1]×100%。
2 结果与分析
2.1 提取溶剂的选择和最大波长的确定
不同种类溶剂对胡桃叶色素的溶解性见表2。

表2 不同种类溶剂对胡桃叶色素的溶解性Table 2 The solubility of different kinds of solvents on pigments from walnut leaves
由表2可知,0.5%柠檬酸、3%氢氧化钠、50%乙醇的萃取效果较好,因此,选用0.5%柠檬酸、50%乙醇、3%氢氧化钠的提取液进行全波长扫描。
选用0.5%柠檬酸、50%乙醇、3%氢氧化钠的提取液进行全波长扫描,见图1。

图1 胡桃叶色素最佳吸收波长的确定Fig.1 The determination of optimum absorption wavelength of pigments from walnut leaves
由图1可知,3种溶剂的提取液均在231 nm处有明显的吸收峰,50%乙醇的提取液在最大波长处的吸光值大于其他溶剂。因此,选取50%乙醇为胡桃叶色素的提取溶剂,231 nm作为提取色素的定量波长。
2.2 单因素试验结果
2.2.1 乙醇浓度对色素提取的影响
由图2可知,胡桃叶色素的吸光度开始随着乙醇浓度的增大而明显增加,当浓度达到50%时,胡桃叶色素的吸光度最大;当乙醇浓度继续增加时,吸光度反而下降。可能是由于乙醇浓度越大时,胡桃叶中的其他醇溶性、脂溶性杂质溶出增加,竞争性地减少了提取剂中色素的含量,从而使胡桃叶色素提取液的吸光值呈逐渐下降的趋势。因此,乙醇浓度控制在50%为宜[14]。

图2 乙醇浓度对胡桃叶色素提取的影响Fig.2 Effect of the ethanol concentration on the extraction of pigments from walnut leaves注:不同小写字母表示存在显著性差异(P<0.05),下图同。
2.2.2 超声时间对色素提取的影响
由图3可知,超声时间在30~50 min范围内,吸光值随着时间的增加而显著变大,50 min时达到最大值,随后吸光值明显下降。这可能是由于随着时间的延长,有效物质不断从细胞内向细胞外溶解,50 min时基本达到浓度平衡;随后吸光值开始减小,可能是由于高温下提取时间过长,导致色素在空气中被氧化,成分被破坏[15]。故超声时间选择50 min比较适宜。

图3 超声时间对胡桃叶色素提取的影响Fig.3 Effect of the ultrasonic time on the extraction of pigments from walnut leaves
2.2.3 液固比对色素提取的影响
由图4可知,液固比在3∶1~4∶1(mL/g)时,吸光度随着液固比的增大呈上升趋势,液固比增加到5∶1(mL/g)时,色素提取液的吸光度达到最大,液固比大于5∶1(mL/g)时,色素提取的吸光度随着液固比的增加而明显下降,这是由于当物料一定时,增加提取溶剂的用量,能够增加有效成分的溶出,当提取溶剂增加到一定程度后,大部分有效成分已基本溶出[16],继续增加溶剂用量对提取效果没有提高的效果,造成提取溶剂的浪费[17]。所以,本试验选择液固比为5∶1(mL/g)。

图4 液固比对胡桃叶色素提取的影响Fig.4 Effect of the liquid-solid ratio on the extraction of pigments from walnut leaves
2.2.4 超声功率对色素提取的影响
由图5可知,随着超声功率从72 W开始增加,色素的吸光度也开始显著增加,当超声功率为108 W时,色素的吸光度值达到了最大;继续增大超声功率,提取胡桃叶色素的溶液吸光度反而下降。对胡桃叶色素提取的这种影响可能是由于超声功率过高,超声波对胡桃叶的组织结构产生了破坏作用[18],所以本试验选择超声功率为108 W。

图5 超声功率对胡桃叶色素提取的影响Fig.5 Effect of the ultrasonic power on the extraction of pigments from walnut leaves
2.3 响应面试验结果
根据单因素试验结果和考虑综合因素确定最佳条件,决定用乙醇浓度、超声时间、液固比、超声功率4个因素(分别用A、B、C、D表示),以胡桃叶色素吸光度为响应值R设计四因素三水平共29个试验点的组合试验,利用Design Expert 8.0.6软件进行处理,试验结果见表3。

表3 响应面试验结果Table 3 Response surface experimental results

续 表
2.3.1 模型的建立及方差分析
利用统计分析软件Design Expert 8.0.6对表3的试验数据进行回归拟合后,得到乙醇浓度(A)、超声时间(B)、液固比(C)、超声功率(D)与吸光度值(R)之间的二次多元回归方程为:R=0.51-0.9583E-003A+0.022B-7.000E-003C+0.013D-0.017AB-0.026AC+0.022AD-0.018BC+0.015BD+3.750E-003CD-0.038A2-0.071B2-0.026C2+0.012D2。
由表4可知,模型极显著(P<0.01),失拟项的P为0.0981,差异不显著,说明该模型对优化胡桃叶色素超声提取工艺有实际应用意义。对回归方程系数进行F检验和方差分析,结果表明B、D、AC、AD、A2、B2、C2对吸光值的影响极显著(P<0.01);A、AB、BC、BD、D2对吸光值的影响显著(P<0.05);影响因素的主次顺序为超声时间>超声功率>乙醇浓度>液固比。

表4 回归方程方差分析Table 4 Analysis of variance of regression equation

续 表
2.3.2 响应面分析
各因素交互作用对胡桃叶色素吸光度的影响见图6。




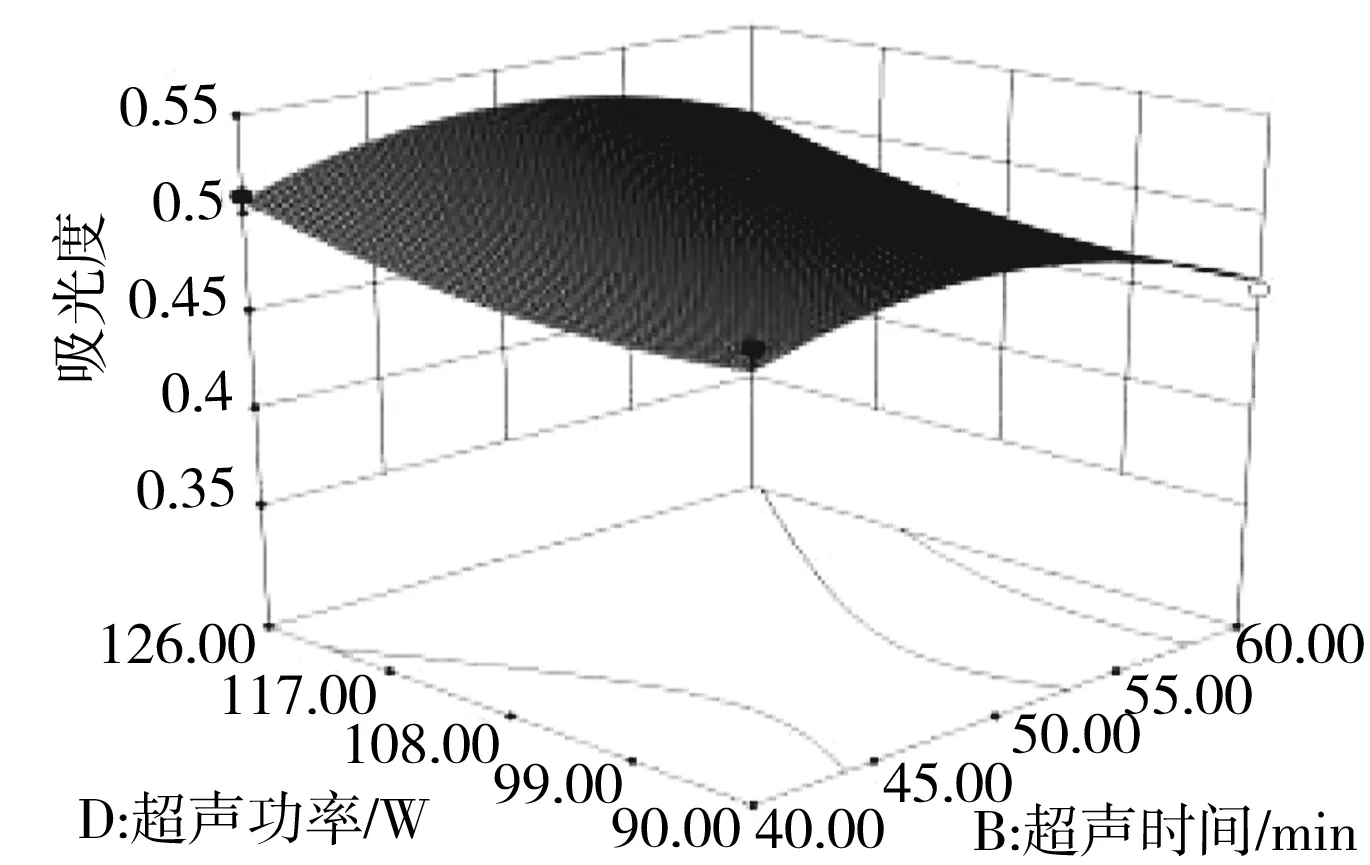

图6 各因素交互作用对胡桃叶色素吸光度影响的响应面图Fig.6 Response surface diagrams of interaction of various factors on the absorbance of pigments from walnut leaves
由图6可知乙醇浓度和超声时间、乙醇浓度和液固比、乙醇浓度和超声功率、超声时间和液固比两两因素间的交互作用。响应图中曲线越陡峭,说明该因素对吸光度的影响越大,反之越小[19]。由图6可知,乙醇浓度和超声时间、乙醇浓度和液固比、乙醇浓度和超声功率、超声时间和液固比的交互作用比较好,而超声时间和超声功率的交互作用比较弱,与之前方差分析结果一致[20]。
2.3.3 验证试验
通过上述试验分析,得到最佳提取条件为:乙醇浓度60.69%,液固比5.22∶1(mL/g),超声时间43.19 min,超声功率126 W,此时吸光度理论值为0.513。综合考虑实际操作性,将条件修正为:乙醇浓度60%,液固比5∶1(mL/g),超声时间43 min,超声功率126 W。在此优化工艺下进行3次平行试验,实际测得平均吸光值为0.506,与模型预测值相对误差为1.36%,表明采用响应面优化得到的工艺可行[21]。
2.4 胡桃叶色素提取物的抗氧化活性分析
2.4.1 胡桃叶色素提取物对羟自由基(·OH)清除能力的测定
羟自由基是一种氧化能力很强的自由基,可以发生电子转移,夺取氢原子和羟基化等反应。按照前述公式计算清除率,不同浓度的胡桃叶色素样品对羟自由基的清除率见图7。
由图7可知,浓度为25,50,75,100,125,150,175,200 mg/L胡桃叶色素对羟自由基有一定的清除作用,其清除效果与胡桃叶色素浓度在一定范围内呈一定的量效关系。随着胡桃叶色素浓度的不断增加,清除率也随之不断增加。胡桃叶色素浓度为200 mg/L时清除作用达到最大值64.0%。胡桃叶色素的半数清除率EC50为135.46 mg/L。
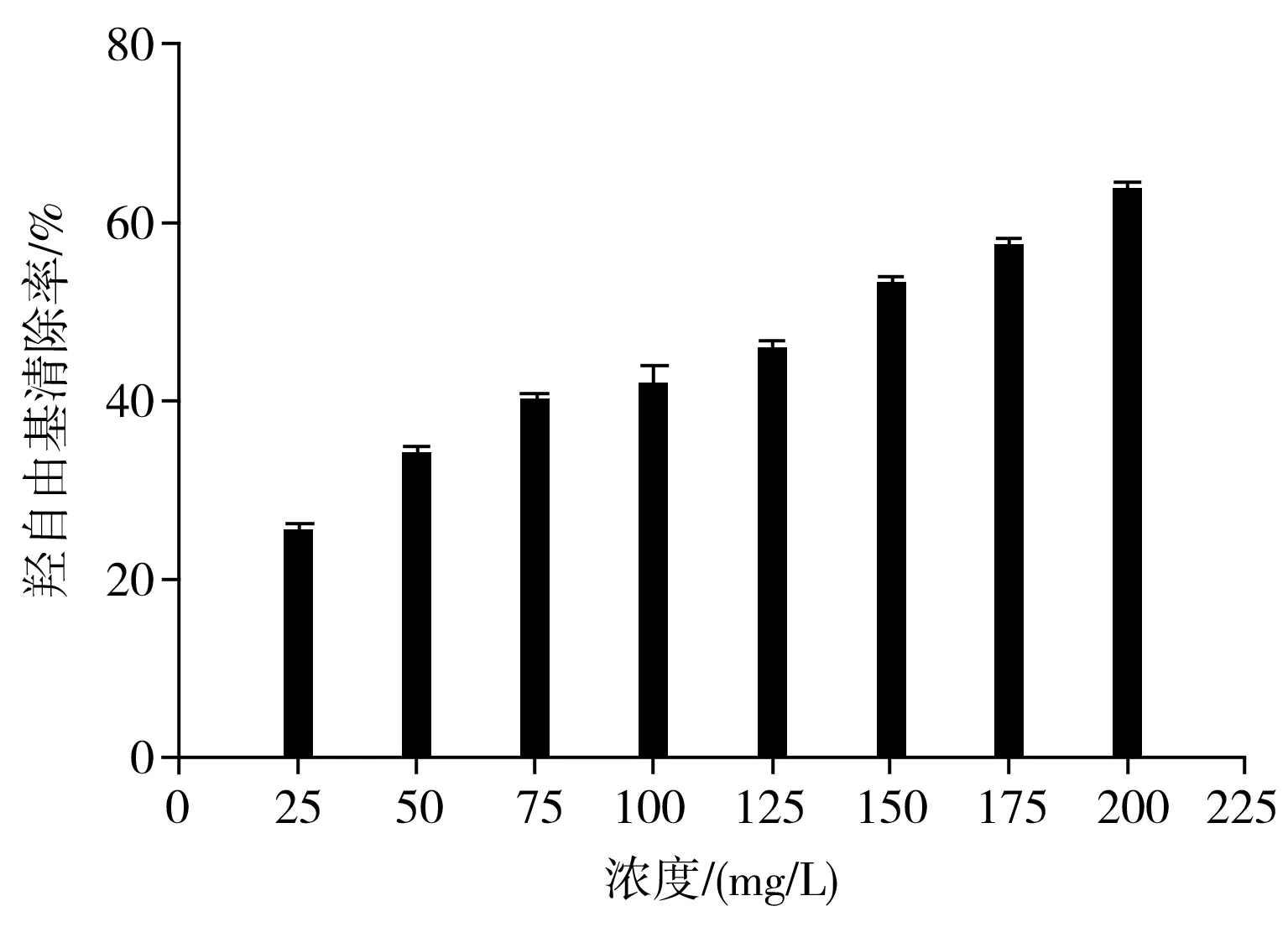
图7 胡桃叶色素对·OH清除能力的测定Fig.7 Determination of the scavenging ability of pigments from walnut leaves on ·OH
2.4.2 胡桃叶色素对DPPH自由基清除能力的测定
当自由基清除剂存在时,DPPH自由基接受一个电子或氢原子,形成稳定的化合物,使其溶液从深紫色变为淡黄色,变色程度与其接受的电子数量成定量关系,因而可通过吸光度大小来判断清除能力[22]。由图8可知,胡桃叶色素对DPPH自由基都有清除能力,且随着样品浓度的增加,DPPH自由基的清除能力增强。胡桃叶色素浓度为200 mg/L时清除作用达到最大值95.7%。胡桃叶色素浓度>175 mg/L时,胡桃叶色素清除DPPH自由基的能力趋于稳定。胡桃叶色素的半数清除率EC50为49.17 mg/L。

图8 胡桃叶色素对DPPH自由基清除能力的测定Fig.8 Determination of the scavenging ability of pigments from walnut leaves on DPPH radicals
3 结论
以胡桃叶为原料提取色素,并对其提取工艺和抗氧化活性进行相关研究。由响应面法得到最佳提取条件为乙醇浓度60%,液固比5∶1(mL/g),超声时间43 min,超声功率126 W,预测最大吸光度为0.513,实际吸光度的平均值为0.506。在一定浓度范围内,胡桃叶色素提取物有较好的抗氧化活性,羟自由基、DPPH自由基的EC50分别为135.46,49.17 mg/L。胡桃叶色素提取物对羟自由基的清除能力强于DPPH自由基。因此,作为天然抗氧化剂在实际生产应用时,应选择适宜的剂量范围,以使其达到最佳的抗氧化效果。
