基于功能磁共振图像转换在阿尔茨海默症分类中的应用
2022-05-06贾洪飞王瑜肖洪兵邢素霞
贾洪飞,王瑜,肖洪兵,邢素霞
北京工商大学人工智能学院,北京100048
前言
阿尔茨海默症(Alzheimer's Disease,AD)是老年痴呆最常见的一种类型,以记忆和认知功能损害为特征的一系列综合症状群[1],严重损害患者的日常生活能力和工作能力。根据我国第6 次人口普查数据中60 岁及以上的人口占13.26%,第7 次人口普查数据中60 岁及以上的人口占18.70%,由此可以看出我国人口老龄化程度加深,AD 成为老年人健康的重大隐患[1-2]。AD 患者在临床上常表现为记忆力丧失、丧失时间和地点的概念、视觉和空间感觉上出现障碍、说话和写字上存在障碍、判断力变差等。由于AD 无法治愈,并且对大脑造成的损害是不可逆的,所以在AD 早期阶段进行诊断和治疗是目前延缓AD 疾病发展最有效的方法[3]。
随着近几年神经影像技术的迅速发展,为脑部疾病的研究提供了新的思路[4-6]。功能磁共振成像(functional Magnetic Resonance Imaging, fMRI)[7]是一种新兴的神经影像学图像,其原理是利用磁共振造影来测量神经元活动所引发血液动力的改变。周琼等[8]结合支持向量机递-归特征消除算法(Support Vector Machine-Recursive Feature Elimination, SVMREF)和最小冗余最大相关性(Maximum Redundancy Minimum Relevance, MRMR)对结构磁共振成像(structure Magnetic Resonance Imaging, sMRI)[9-11]数据进行特征提取,最后使用SVM 实现对AD 患者分类,其中SVM-REF与MRMR相结合很难提取图像的非线性特征。李书通等[12]使用3DPCANet对sMRI图像进行特征提取,支持向量机(Support Vector Machine, SVM)[13]分类,区分AD、正常对照组(Normal Control, NC)和轻度认知障碍(Mild Cognitive Impairment, MCI)[14]。由 于3DPCANet 具有提取图像特征冗余且不能提取图像的非线性特征等缺点。因此,本文对3DPCANet 网络进行改进,在卷积层后添加最大池化层和激活函数层,最大池化层用来学习图像的纹理信息并减少特征冗余,激活函数层用来增加模型对提取非线性特征的能力,使改进的3DPCANet 能够提取更加具有区别性的分类特征。
李慧卓等[15]使用Adaboost 集成分类器结合sMRI 和fMRI 数据,对AD、MCI 和NC 分类,取得了较好的分类结果。Dai 等[16]对fMRI 图像进行局部一致性(Regional Homogeneity, ReHo)[17]转换,并使用多分类器的多层次表征对AD 和NC 进行分类,获得了很好的结果。由于NC转换成AD 期间还包括主观记忆衰退(Subjective Memory Decline,SMD)[18-20]、早期轻度认知障碍(Early Mild Cognitive Impairment,EMCI)和晚期轻度认知障碍(Late Early Mild Cognitive Impairment, LMCI)[21-23],上述文章未能诊断出AD 早期阶段。因此,本文会对患者进行更加细致的分类。
综上所述,本文提出一种基于fMRI 图像转换结合改进3DPCANet 模型对AD 不同阶段患者进行分类,首先预处理被试患者的fMRI 图像,并进行ReHo图像转换,然后使用改进3DPCANet 进行特征提取,最后使用SVM进行分类。
1 数据预处理
fMRI 数据是四维数据,目前的特征提取算法很难直接提取fMRI 数据特征,本文对fMRI 数据进行ReHo转换,将高维数据转换为低维数据,然后进行后续操作。
1.1 数据信息统计分析与预处理
本文共采集了202 例被试者的fMRI 图像,其中EMCI 患者57 例,SMD 患者26 例,AD 患者34 例,NC对照组50 例,LMCI 患者35 例。按照7:3 划分训练集和测试集。上述图像均来自阿尔茨海默症神经成像组织(Alzheimer's Disease Neuroimaging Initiative,ADNI)数据库,每个被试者数据包括140 个时间点,每个时间点包含48层扫描图像。数据详细信息如表1所示。
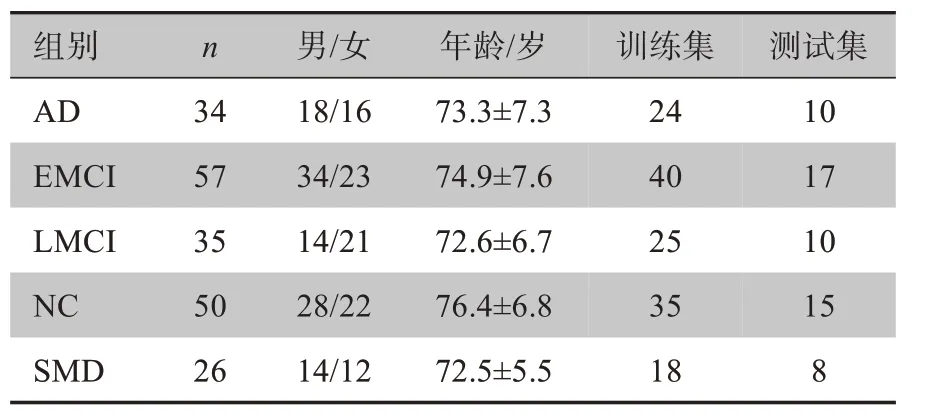
表1 被试者信息统计分析Table 1 Statistical analysis of the basic information of subjects
由于被试者脑部形状,大小存在差异,并且原始fMRI 图像中存在噪声。本文预处理fMRI 数据使用Data Processing & Analysis for Brain Imaging(DPABI)[24]实现。实验环境为个人服务器,处理器:因特尔E5-2643,内存为三星2400M,24 GB,软件版本为Matlab2019A。fMRI预处理流程图如图1 所示,处理流程如下:首先剔除前10个时间点,因为机器刚启动成像会带来一些误差;以第48 层图像为参考层进行时间层校正;头动校正,将不同大脑位置校正到图像中心位置上;空间标准化,将所有被试者的脑部图像映射到标准空间中,消除不同被试者之间的脑部结构差异;去线性飘移,消除机器长时间工作对图像产生的噪音。fMRI 预处理前后的图像对比如图2所示。

图1 fMRI预处理流程图Figure 1 Flowchart of fMRI preprocessing
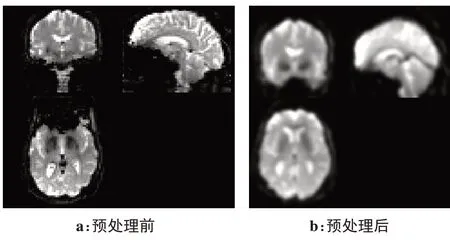
图2 fMRI预处理前后对比图Figure 2 Comparison before and after fMRI preprocessing
1.2 ReHo图像转换
ReHo方法最初是由Jiang等提出,用来测量fMRI时间过程的区域同步程度,ReHo假设所选择的体素与相邻的体素存在暂时的相似性,使用肯德尔和谐系数度量。用f(M1,N1,O1,T1)表示一个fMRI数据,其中M1为行数,N1为列数,O1为层数,T为每个体素的时间点数(时间序列的长度),数据中包含M1×N1×O1个体素,对于其中第j1个体素Vj1(m1,n1,o1)(1 ≤m1≤M1,1 ≤n1≤N1,1 ≤o1≤O1),其体素的时间序列和它的K1(一般K1为6、18、26)个最近邻域体素时间序列的局部一致性计算如下:(1)将K1+ 1个体素的时间序列表示成大小为T1×(K1+ 1)的矩阵X1,其中X1(i,j)表示第j1个体素的第i1个时间点;(2)将第j1列的元素用其所在列中的秩(即该元素的值在第j1列中大小的序号)来代替,得到大小为T1×(K1+ 1)的矩阵R1,其中R1(i,j)表示第j1个体素第i1个时间点的秩;(3)计算K1+ 1个体素的时间序列肯德尔和谐系数,如下式所示:
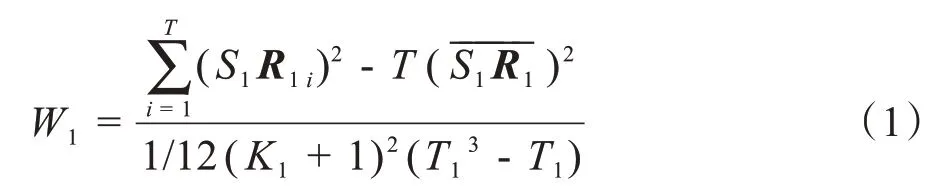
ReHo变换图像中的体素在同一时间序列中呈现相似的变化,肯德尔和谐系数越大,代表这些时间序列越相似,用每一个体素的ReHo 除以全脑平均的ReHo 值,可以得到平均ReHo 图像(Mean ReHo,mReHo),再进行平滑处理,处理后的图像如图3所示。
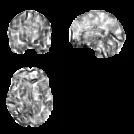
图3 mReHo样本图像Figure 3 mReHo image sample
2 实验方法
2.1 改进3DPCANet
3DPCANet是利用PCA学习通道卷积核,二进制哈希和分块直方图用于索引和池化的深度学习模型,模型流程如下。
第 一 步:模型输入大小为L×H×W的N幅mReHo图像,在第j幅图像上的每个像素周围都截取k1×k2×k3大小的体素块,得到其中表示第j幅训练图像中的第i块的列向量,并进行去中心化处理。按顺序将取出的块列向量排列成新的矩阵将所有N幅原始图像进行上述处理,并按顺序排列成新的矩阵X,得到如下矩阵:
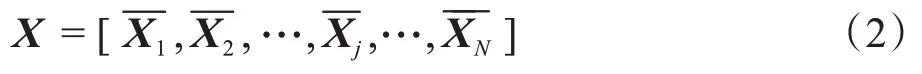
对上述矩阵X进行PCA 处理,PCA 在一组标准正交滤波器中最小化重构误差为:
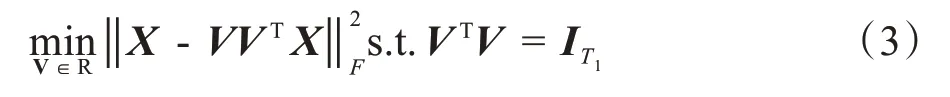
PCA滤波器的表达式如下所示:
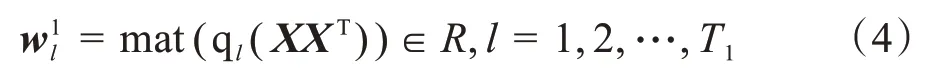
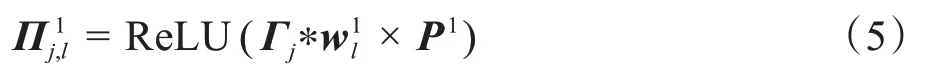
其中,符号“*”表示卷积,符号“×”表示最大池化操作,P1表示第一步最大池化层,Π1j,l表示进行最大池化层和激活函数操作后的图像。
第二步:与第一步处理方法相似,N幅原始图像经过第一步生成T1×N幅图像,以其中第l 幅图像的每个体素为中心,取k4×k5×k6大小的图像块,并进行去中心化处理得到按顺序将取出的块列向量排列成新的矩阵----Yj,l,将所有图像进行上述处理,并按顺序排列成新的矩阵Y,得到如下矩阵:
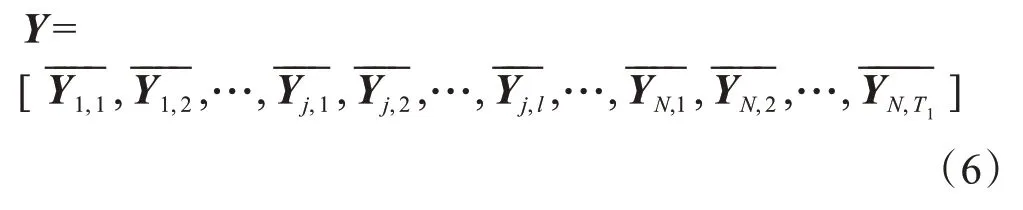
对所得矩阵Y,进行PCA 处理,生成第二步PCA滤波器同样对第一步中式(5)生成的图像进行卷积,最大池化,激活函数操作,如式(7)所示:
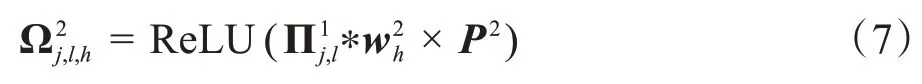
第三步:对第二步生成的图像进行二进制哈希处理,处理后如式(8)所示:
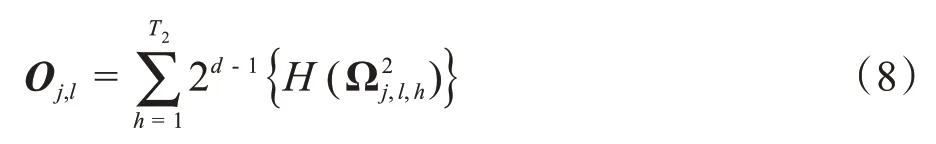
其中,H(·)的功能是二进制哈希,对哈希处理后图像进行取块处理,每个块像素大小为k7×k8×k9,统计每个块的直方图,并将图像中取出块的直方图进行串联处理,得到一维特征向量Fj:
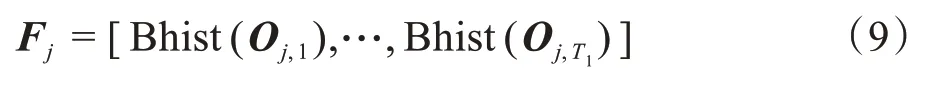
其中,Bhist(Oj,l)是对Oj,l进行取块,直方图统计和串联的功能,N幅原始图像中的每一幅图像均可得到一个一维的特征向量。
2.2 模型指标
为了更加全面评估模型性能,本文中使用5种模型评价指标作为评测指标,分别为准确率(Accurary,ACC)、敏感度(Sensitivity,SEN)、特异性(Specificity,SPE)、F1 值和受试者工作特征(Receiver Operating Characteristic, ROC)曲线下与坐标轴围成的面积(Area Under Curve,AUC),计算公式如下所示:

3 实验结果分析
本文设计了两组对照实验分别验证ReHo 图像以及本文改进3DPCANet 对AD 早期诊断的有效性。对比实验1:本文使用改进和未改进的3DPCANet 分别对ReHo 图像进行特征提取,使用SVM 分类,来验证改进PCANet 的有效性,实验结果如表2 所示。从表2 的实验结果可以看出,改进后的3DPCANet,对AD 不同阶段之间的分类性能显著提升,例如在EMCI 与AD 分类中,改进后的3DPCANet 与未改进的3DPCANet 相比ACC 提升3.71%,SPE 提升20%,F1值提升1.79%,AUC提升7.06%。
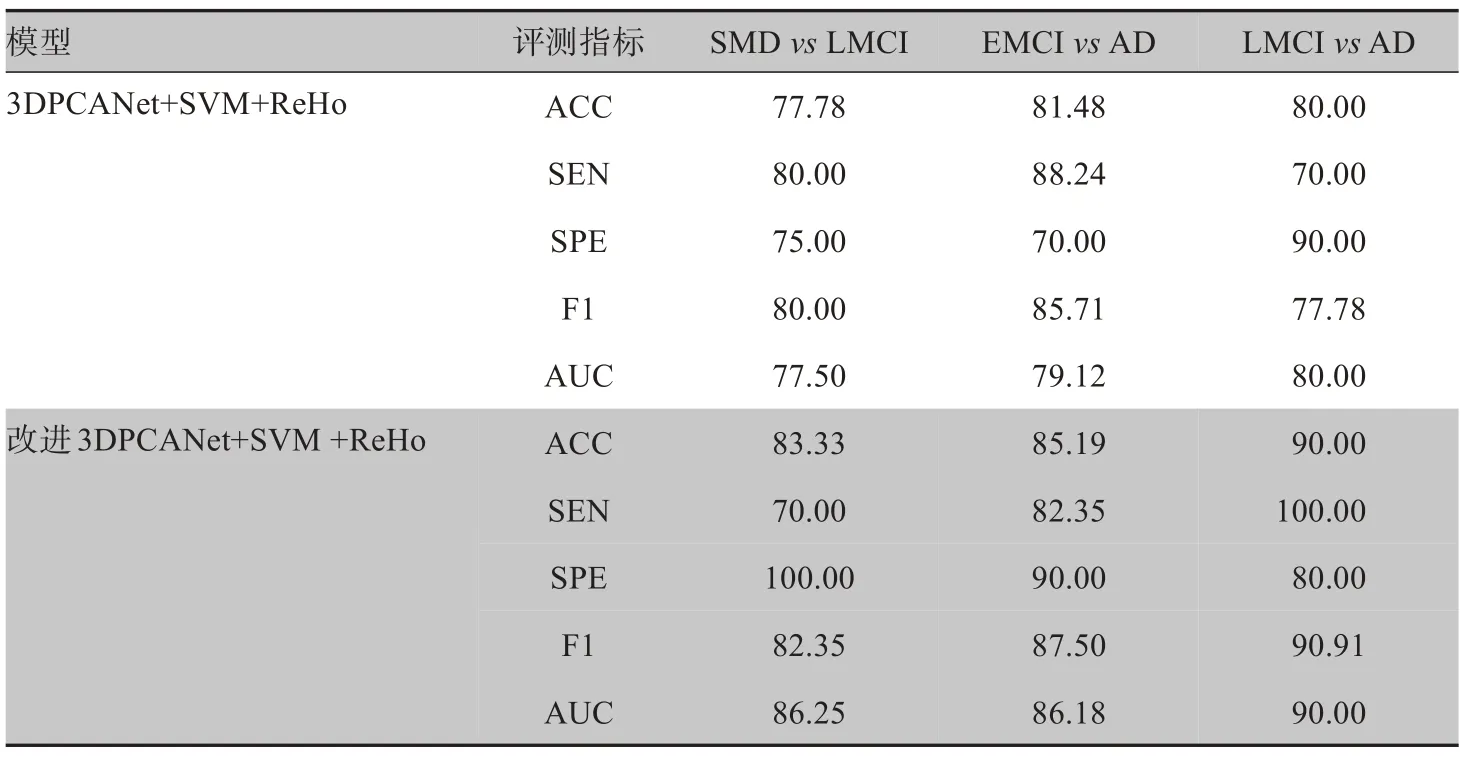
表2 对比实验1结果(%)Table 2 Comparison of results of experiment 1(%)
对比实验2:为了验证ReHo图像转换对AD早期诊断的有效性,本文提出方法与文献[25]进行了对比,实验结果如表3 所示。从表3 的实验结果可以看出,本文提出的方法改进3DPCANet+SVM+ReHo 方法与文献[25]的方法相比,EMCIvsNC、LMCIvsNC的ACC、SPE 均有所提升,主要是因为ReHo 假设所选择的体素与相邻的体素存在暂时的相似性,AD 不同阶段患者脑部体素之间的相似性不同,所以可以根据ReHo 图像区分AD 患者。与文献[25]相比,本文使用的数据较少取得了比较好的实验结果,并且多个评测指标能够多方面反映模型性能,可以证明ReHo图像在AD分类中的应用。
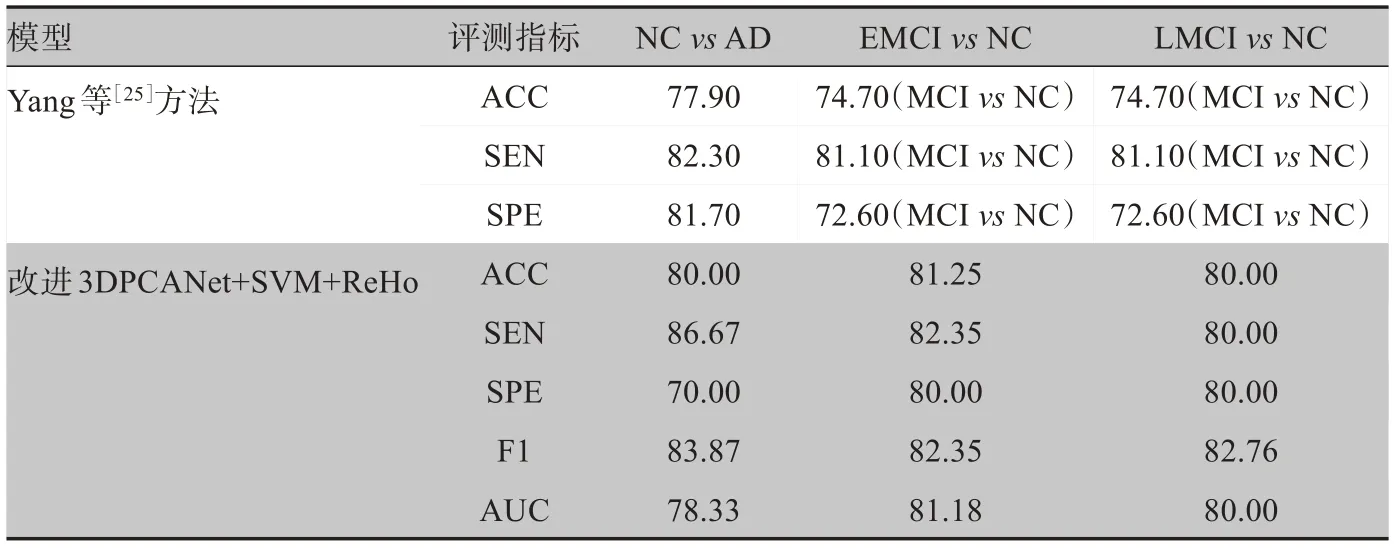
表3 对比实验2结果(%)Table 3 Comparison of results of experiment 2(%)
此外,本文对不同阶段的AD 患者也进行了分类实验,实验结果如表4 所示。由表4 中的实验结果可以看出,NC、SMD、EMCI和LMCI是相邻疾病发展阶段,在相邻疾病发展阶段的分类中大脑结构相似,分类困难,但改进后的3DPCANet结合ReHo图像对NC与SMD、SMD 与EMCI、EMCI 与LMCI 分类同样取得了较好的分类结果,其中准确率分别为82.61%、88.00%、77.78%,F1值分别为87.50%、91.89%、83.33%,AUC 分别为77.92%、89.71%、74.12%,实验结果证明改进后的3DPCANet结合ReHo图像更适合AD早期诊断。
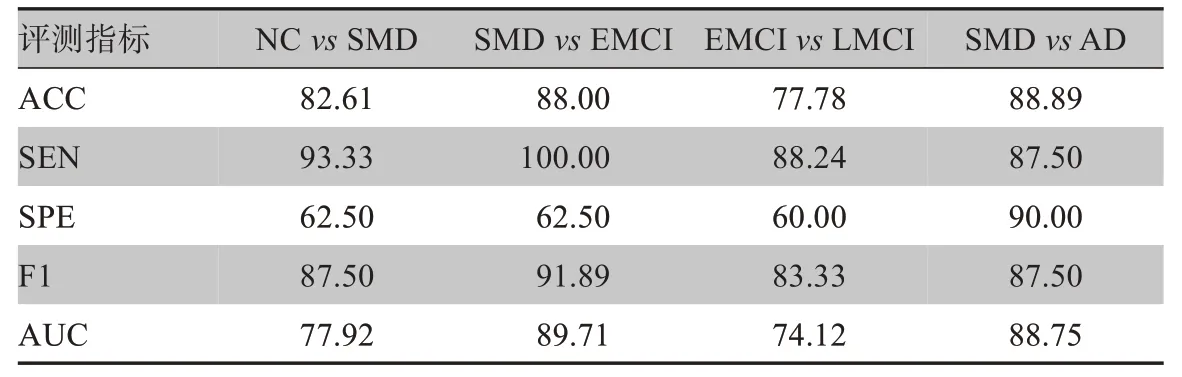
表4 AD不同阶段患者分类(%)Table 4 Classification of patients at different stages of AD(%)
4 结语
本文提出一种基于深度学习的AD 诊断方法,对fMRI 数据预处理,并进行ReHo 图像转换,作为改进3DPCANet网络输入。此外,对3DPCANet卷积层后增加最大池化层和激活函数层进行改进,使特征图中的冗余信息减少,增加网络对纹理特征的学习能力和提取非线性特征的能力,最后使用线性SVM分类器进行分类。在不同阶段AD与NC对照组数据集中的实验结果显示,LMCI与AD、SMD与AD、SMD与EMCI的分类ACC分别达到90.00%、88.89%、88.00%。综上所述,本文提出的方法能够有效分类AD不同阶段患者,为AD的辅助诊断与治疗提供理论依据和指导性建议。