新型胃癌评分和京都胃炎评分在胃癌筛查风险评估中的应用价值
2022-05-06周乐盈潘杰周晴接黄春伟林介军
周乐盈,潘杰,周晴接,黄春伟,林介军
据2018年全球癌症年报所示,胃癌发病率及病死率在恶性中均高居第3位。胃癌的预后与分期密切相关,早期胃癌的治愈率可达到90%以上[1]。因此,准确筛查出胃癌高危个体是改善预后及减少经济负担的关键[2]。为此,国内外学者针对不同筛查指标研制出多种评分系统,例如应用较多的结合血清胃蛋白及胃泌素17(G17)水平的“ABC法”[3],但这些评分系统均采用国外标准,不完全适用于我国。2017年,由国家消化病临床研究中心牵头定制了“中国早期胃癌筛查流程专家共识意见”,从中提出新型胃癌筛查风险评分系统,将其作为我国早癌筛查的风险分层管理办法[4]。多项研究表示新型胃癌筛查评分系统在胃癌及癌前病变筛查中与“ABC法”有高度一致性,尤其在低风险人群识别及内镜随访人群界定方面更有优势[5]。京都胃炎评分可更准确地判断幽门螺杆菌感染状态及胃癌风险评估较广泛地应用在临床[6]。然而,在日常临床研究中的有效性尤其对于胃癌风险评估的实践应用并没有得到充分的评价。本研究的旨在验证新型胃癌评分系统和京都胃炎评分系统在胃癌风险评估中的应用价值,现报道如下。
1 资料与方法
1.1 一般资料 收集2019年1—12月间因各种消化系统症状如腹痛、腹胀、腹部不适、恶心、黑便及嗳气等在浙江省温州市中心医院消化内科就诊,并完成血清蛋白酶原、G17及幽门螺杆菌抗体检测等血清学筛查及行胃镜检测并取组织活检获得病理结果的患者。纳入标准:属于新型胃癌筛查目标人群的患者,即年龄≥40岁,且符合下列任一条者:(1)胃癌高发地区人群;(2)幽门螺杆菌感染者;(3)既往患有慢性萎缩性胃炎、胃溃疡、胃息肉、肥厚性胃炎、恶性贫血等胃的癌前病变;(4)胃癌患者一级亲属;(5)存在胃癌其他风险因素(如摄入高盐、腌制饮食、吸烟、重度饮酒等)。排除标准:(1)胃镜检查前1个月内曾服用过H2受体阻滞剂、质子泵抑制剂等抑酸药;(2)既往有胃或十二指肠手术史;(3)有严重心肺功能障碍或长期服用抗凝等药物无法进行组织活检。
1.2 方法
1.2.1 京都胃炎评分 京都胃炎评分系统是根据内镜下萎缩、肠上皮化生、弥漫性发红、棘皮样改变及皱襞粗大等5种表现进行评分,总分为0~8分,见表1。

表1 京都胃炎评分表
1.2.2 新型胃癌筛查评分 按时间先后顺序收集所有符合标准的患者相关资料,确保病例资料收集的连续性,包括性别、年龄、胃血清学检查数据、胃镜检查及病理活检结果等,所有数据由2名以上高年资内镜医师及病理医师确认审核,再参照新型胃癌筛查评分系统对所有患者进行评分,见表2。
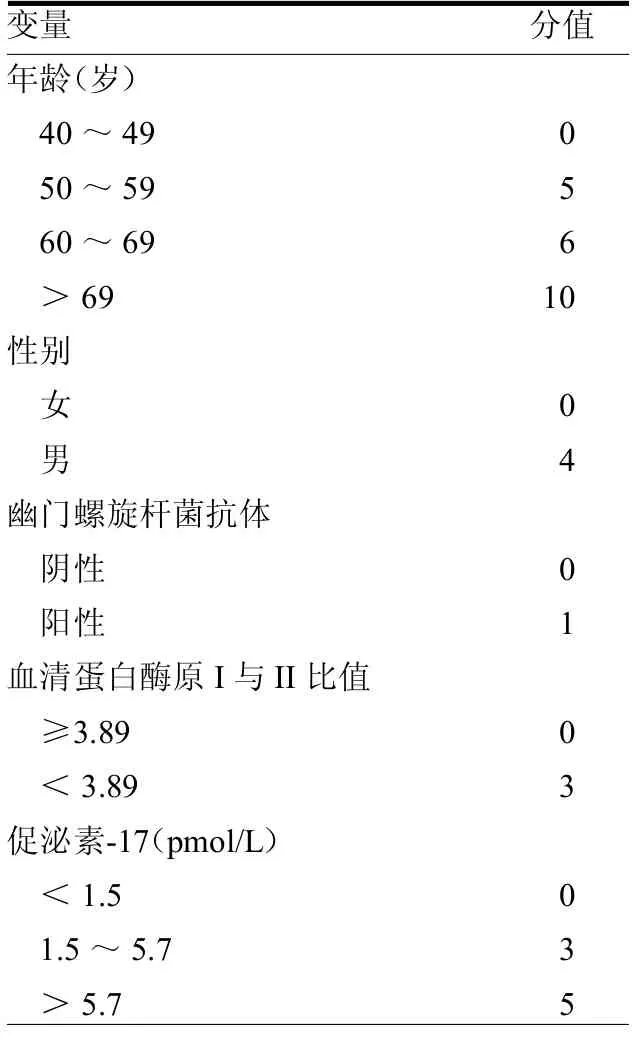
表2 新型胃癌筛查评分系统
1.3 统计方法 采用SPSS 23.0统计学软件进行分析。计量资料以均数±标准差表示,采用t检验;计数资料采用2检验或秩和检验;绘制两种评分系统的ROC曲线,以曲线下面积(AUC)评价诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共纳入2 501例患者,其中男1 284例,女1 217例;年龄40~93岁,平均(56.0±14.1)岁;京都胃炎评分(2.39±1.88)分,新 型 胃 癌 评 分(10.24±4.49)分。按胃镜活检组织病理学分类,胃癌包括高级别上皮内瘤变79例,癌前状态包括癌前病变(低级别上皮内瘤变)与癌前疾病(萎缩性胃炎、胃息肉、良性胃溃疡)1 267例,非萎缩性胃炎1 155例。按京都胃炎评分分组,其中低危组801例(32%),中危组949例(37.9%),高危组751例(30.1%)。按照新型胃癌评分系统分组,低危组1 574例(62.9%),中风险773例(30.9%),高风险154例(6.2%)。
2.2 两种评分风险分层结果及胃癌检出率比较 按照京都胃炎评分分组,胃癌检出率随着风险的等级增加逐步升高(Z=69.079,P<0.05),高危组胃癌检出率明显高于中危组、低危组(2=28.089、53.160,均P<0.05)。按照新型胃癌评分分组,胃癌检出率随着风险的等级增加逐步升高(Z=62.582,P<0.05),高危组胃癌检出率明显高于中危组、低危组(2=14.957、67.389,均P<0.05)。两种评分在高危组胃癌检出率上差异无统计学意义(2=3.765,P=0.052)。见表3。
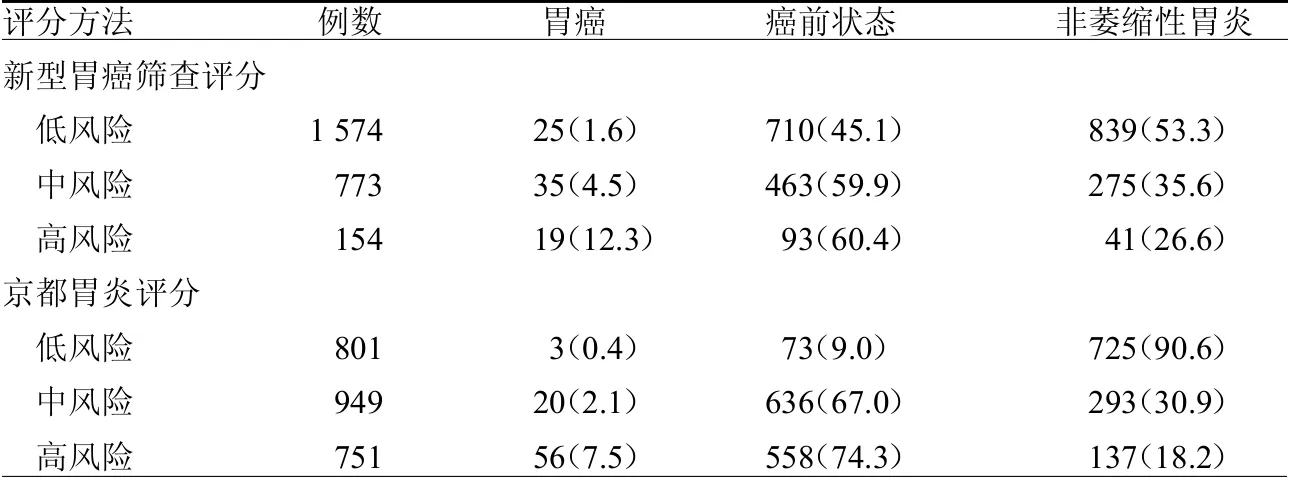
表3 两种评分危险分层结果和胃癌检出率比较 例(%)
2.3 两种评分对胃癌的诊断价值分析 京都胃炎评分系统诊断胃癌的AUC为0.781(95%CI 0.734~0.828),最佳诊断临界值为3.5,敏感度为0.722,特异度为0.713。新型胃癌筛查评分系统诊断胃癌的AUC为0.726(95%CI 0.668~0.784),最佳诊断临界值为10.5,敏感度为0.797,特异度为0.554。见图1。
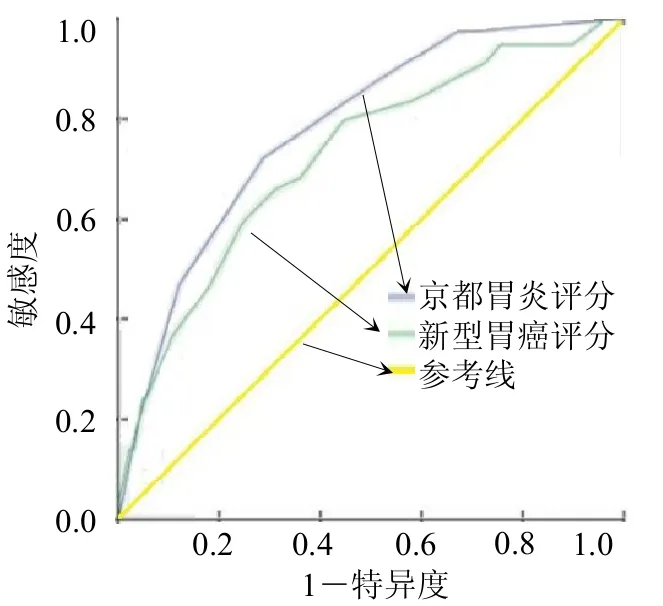
图1 京都胃炎评分系统和新型胃癌筛查评分系统ROC曲线
3 讨论
胃癌的发生、发展是一个逐渐进展的过程,而对胃癌高风险人群的筛选和个性化的动态随访,是提高胃癌早诊早治的关键。2017年我国提出的新型胃癌筛查评分,对不同风险人群采用针对性的随访方案,已有不少研究证实它的筛查效能[7]。随着内镜技术的发展,胃镜检查及精准的组织活检已经在胃癌诊断中起到越来越重要的作用,而京都胃炎评分的提出,简单及客观地根据胃黏膜状态判断幽门螺杆菌感染状况,评估胃癌风险[6]。
目前多项研究表明年龄和性别是胃癌的高风险因素,Karimi等[8]报道胃癌发生率随年龄增大而升高,同时,男性相较于女性来说,发生贲门癌(5倍)和非贲门癌(2倍)的风险均较高。血清中低PGI水平或低PGI/II水平都是预测萎缩性胃炎的良好指标,有研究表明,PGI/II比值低水平与胃癌发生有密切相关,是胃癌高风险的预测因子,但是PGI本身并不是相关预测因子[9]。G17是由胃窦G细胞合成和分泌,组要负责调节胃酸和胃蛋白酶原的合成和分泌,是目前一种重要的癌前病变的预测指标[10]。本研究结果显示新型胃癌评分诊断胃癌的AUC为0.726(95%CI 0.668~0.784),最佳诊断临界值为10.5,敏感度为0.797,特异度为0.554。
在内镜检查中,同样已经有多项研究指出了胃癌发生风险随着萎缩的进展逐渐升高。Takeda等[11]报道了萎缩性胃炎与胃癌发生相关,是与萎缩性胃炎的高甲基化有关。Sugimoto等[12]报道了肠上皮化生增加了早癌风险发生的风险,OR值为5,主要与肠型胃癌发生相关。Nishibayashi等[13]研究指出在幽门螺杆菌阳性的胃癌患者皱襞宽度分布呈上升趋势,若皱襞宽度大于7 mm,风险OR值可达到35.5,并与弥漫性胃癌有关。同样对于棘皮样改变,有报道指出也与弥漫性胃癌相关,在Nishikawa的[14]研究中发现在29岁以下幽门螺杆菌阳性患者中,棘皮样改变对于胃癌发生的OR值可达64.2。京都胃炎评分系统不止观察萎缩及肠上皮化生等情况,它同时纳入了内镜下萎缩、肠上皮化生、弥漫性发红、棘皮样改变、皱襞粗大等5种表现并进行量化,有研究对比了268例胃癌患者及932例胃炎患者的京都胃炎评分发现胃癌组评分显著高于胃炎评分[12],与本研究结果相一致。Sugimoto等[12]研究了京都胃炎评分和胃癌风险之间的关系,在他们的横断面研究中,胃癌患者和非胃癌患者京都评分分别为4.8分和3.8分,提示京都胃炎评分≥4可能提示胃癌风险,这与本研究结果相一致。这提示京都胃炎评分对于有胃癌筛查有诊断意义,尤其对于内镜下风险评估有重大意义,本研究中京都胃炎评分=3.5为最佳临界值,可能与研究设计、地域不同等因素相关,需要搜集更多更大范围数据进一步进行验证。
本研究存在局限性,首先这是一项单一研究所进行的回顾性研究;其次,此次研究的京都胃炎评分是由4位经过培训的内镜医生进行评分,可重复性尚未得到充分验证。
