烤烟感病苗与健康苗根围基质微生物群落结构及其多样性
2022-05-06刘亭亭李文红汪汉成蔡刘体张长青
刘亭亭, 李文红, 汪汉成, 蔡刘体, 张长青, 穆 青
(1.长江大学 农学院, 湖北 荆州 434025; 2.贵州省植物保护研究所, 贵州 贵阳 550006; 3.贵州省烟草科学研究院, 贵州 贵阳 550081; 4.贵州省烟草公司 黔西南州公司, 贵州 兴义 562400)
0 引言
【研究意义】烟草是我国主要的经济作物之一,在我国云南、贵州、四川、湖南、湖北等省均有种植[1],集约化育苗是我国烟草的主要育苗方式,以漂浮育苗和托盘育苗为主[2]。在环境条件适宜时,基质土壤中的病原菌侵染烟苗导致发病,烟苗罹病后其烟苗各部位微生物群落结构与多样性改变,因此,了解烟苗患感病前后微生物群落的变化情况,对烟草苗期病害的防控具有重要的研究意义。【前人研究进展】在育苗期我国大部分烟草种植区长期低温寡照、多阴雨,导致苗床滋生多种病害,其中报道较多的病害有烟草猝倒病[3-5]、烟草立枯病[6]、烟草黑胫病[7]、烟草枯萎病[8]、烟草灰霉病[9]等。大部分苗期病害为根茎性病害,其病原菌来源于育苗基质、漂盘、烟草种子、育苗用水等育苗物资或环境,其中育苗基质为主要来源。关于苗期基质病原菌的检测虽有报道,但主要集中在单个病原菌的检测上[10]。随着高通量测序技术的发展,不同生境下的微生物群落结构被逐渐认知,包括烟草根围[11-12]、大田期烟叶叶际[13]、种子[14]及烘烤期烟叶叶际[15-16]的微生物。【研究切入点】关于苗期烟株患感病前后根围基质的微生物群落结构与多样性变化却鲜有报道。【拟解决的关键问题】因此,采用高通量测序技术对烤烟苗期患感病及健康烟苗根围基质进行微生物群落结构及多样性分析,旨在揭示烟苗患感病前后微生物群落的变化情况,为指导烟草苗期病害的防控提供参考。
1 材料与方法
1.1 材料
1.1.1 烟草 供试烟草品种为云烟87,是贵州省主栽烤烟品种。该品种于2021年2月15日播种于贵州省兴义市烟草育苗工厂,烟株田间管理按照标准化生产方式进行管理。
1.1.2 主要试剂 基质基因组DNA提取试剂盒购,购自天根生化科技有限公司;GeneJET胶回收试剂盒和Ion Plus Fragment Library Kit 48 rxns建库试剂盒,均购自Thermo Scientific公司。
1.2 样品采集
2021年4月在贵州省兴义市烟草基地进行样品采集。随机选取5株感病烟苗(茎基部有褐色病斑且边缘明显,受害部有干枯缢缩的现象)和5株健康烟苗,将烟苗整株拔起,轻轻抖落并收集须根周围的基质,两组样品分别编号JZT(感病)和JZCK(健康)感病样品依次编号为JZT1、JZT2、JZT3、JZT4和JZT5,健康样品依次编号为JZCK1、JZCK2、JZCK3、JZCK4和JZCK5。样品收集后放入低温保存箱,并迅速带回实验室放置于-80℃超低温冰箱保存,备用。
1.3 感病烟苗与健康烟苗根围基质微生物群落结构及多样性分析
采用基质基因组DNA提取试剂盒进行基质微生物基因组DNA的提取,用琼脂糖凝胶电泳检测样品DNA的质量。将提取的DNA置于离心管中,并用无菌水稀释至浓度为1 ng/μL,以此为模板,使用引物ITS1-5F-F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS1-1F-R(5′-GCTGCGTTCTTCATCGATGC-3′)、515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)分别对基质真菌ITS1区域与细菌V4区域进行扩增。PCR扩增体系:Phusion®高保真酶(New England Biolabs)15 μL,上游、下游引物各0.2 μmol/L,模板DNA 10 ng。PCR扩增程序:98℃预变性1 min;98℃变性10 s,50℃退火30 s,72℃延伸30 s,30个循环;最后72℃延伸5 min。用2%琼脂糖凝胶对PCR产物进行电泳检测,使用GeneJET胶回收试剂盒回收纯化产物,之后将扩增产物送至北京诺禾致源科技股份有限公司,使用Ion Plus Fragment Library Kit 48 rxns建库试剂盒构建文库,文库经Qubit定量和文库检测合格后在Thermofisher的Ion S5TMXL进行上机测序。
1.4 数据处理
参照刘畅等[13,17]的方法对后续数据进行分析,包括样品的Alpha多样性分析、Beta多样性分析(PCA分析[18]、ANOSIM分析)、物种组成、功能预测分析等,此过程均在北京诺禾致源科技股份有限公司完成。
2 结果与分析
2.1 测序深度
如图1所示,在序列数达到30 000个时,所有样品的稀释曲线开始趋于平缓。当序列数达到40 000个时,稀释曲线已趋于饱和,表明此次测序深度已经覆盖样品绝大多数物种,足以反映样品的物种多样性。
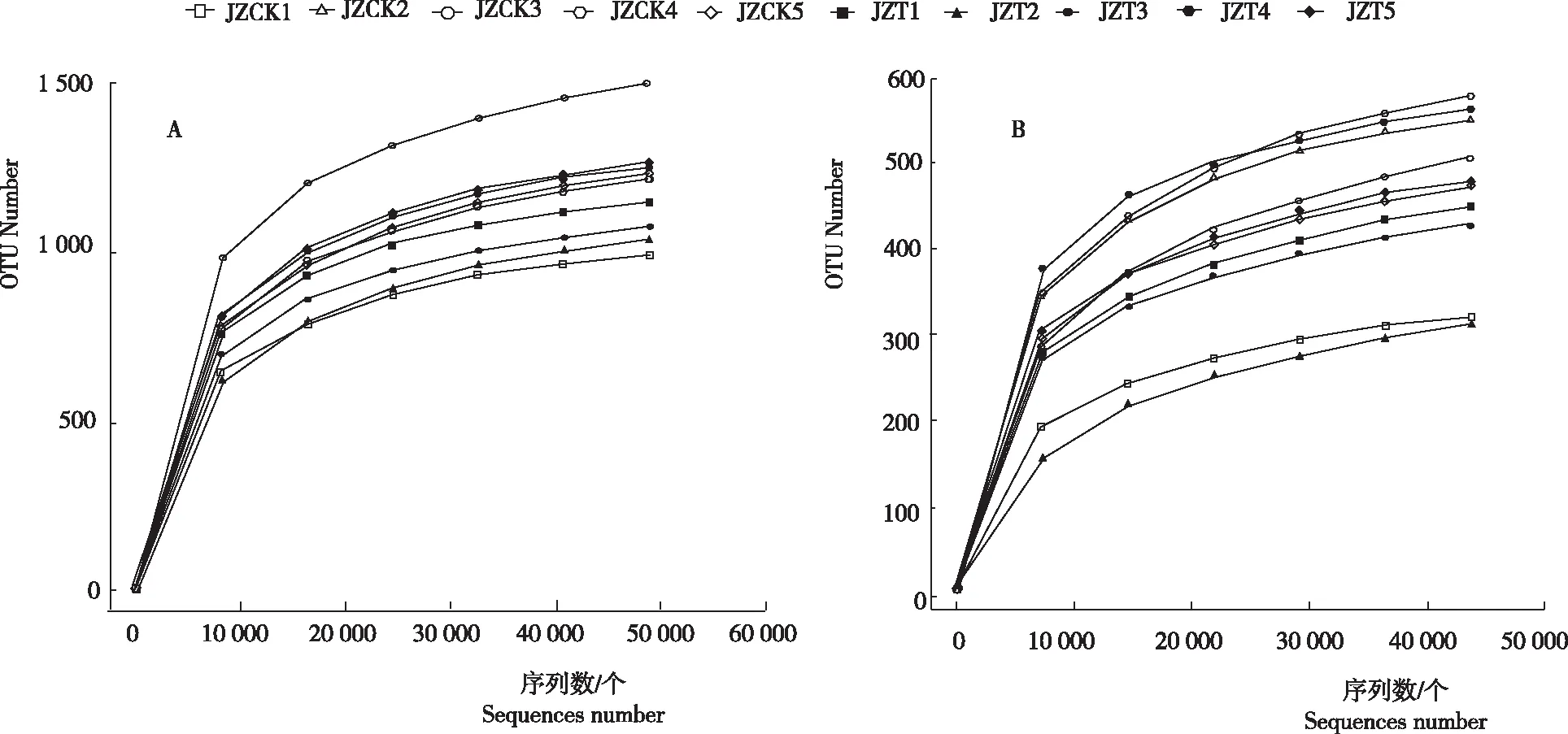
图1 感病烟苗与健康烟苗根围基质细菌(A)和真菌(B)扩增子测序稀释曲线
2.2 数据质控
通过对Reads剪切过滤,对于细菌群落来说,平均每个样品测得82 091条原始数据,经过质控平均得到77 890条有效数据,质控有效率达95.2%。通过与数据库Silva132比对,进行物种注释,并对不同分类层级统计发现:共有2 057个OTUs,其中,能够注释到数据库的OTUs数目为2 057个(100.0%),注释到界、门、纲、目、科、属和种水平的比例分别为100.0%、96.3%、91.5%、81.8%、72.6%、51.5%和11.4%。对于真菌群落,平均每样品测得74 614条reads,经过质控平均得到72 881条有效数据,质控有效率达97.7%。通过与数据库UNITE比对发现:共有998个OTUs,其中,能够注释到数据库的OTUs数目为927(92.9%),注释到界、门、纲、目、科、属和种水平的比例分别为92.9%、44.3%、37.3%、36.1%、32.2%、28.2%和17.5%。
2.3 感病苗与健康苗根围基质微生物群落Alpha多样性
如表1所示,根围基质微生物群落的覆盖度指数为0.996~0.998,表明本次测序的数据合理,能真实、合理地反映微生物群落的多样性。健康苗根围基质(JZCK)微生物群落的Alpha多样性指数(Shannon、Chao1、ACE指数)均高于感病苗根围基质(JZT),经LSD检测感病苗与健康苗根围基质的细菌与真菌群落的Alpha多样性指数间均无显著性差异。
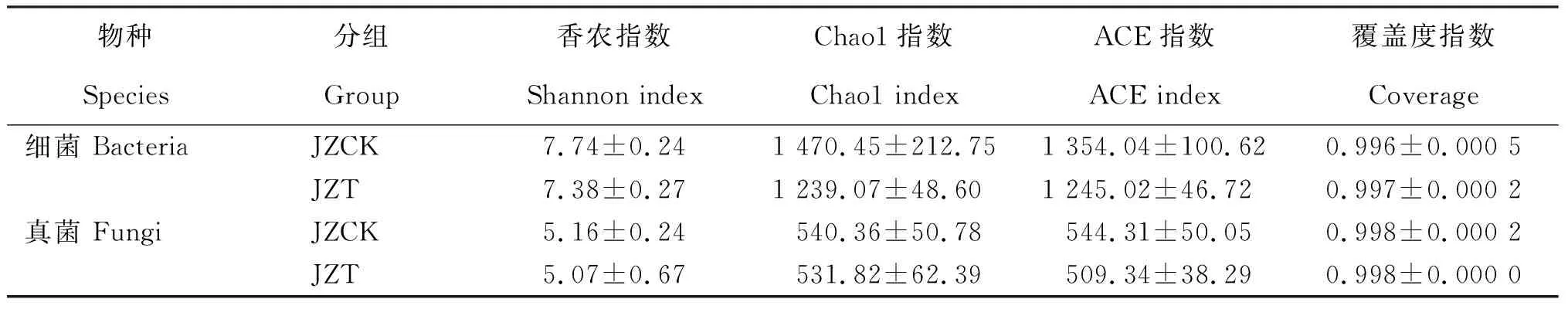
表1 感病烟苗与健康烟苗根围基质微生物Alpha多样性指数(种水平)
2.4 感病烟苗与健康烟苗根围基质微生物群落特征
由图2可见,在门水平,所有样品的细菌主要分布在变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria),其中,JZT的变形菌门相对丰度显著高于JZCK,JZCK的拟杆菌门相对丰度显著高于JZT。在属水平,感病(JZT)与健康(JZCK)烟苗根围基质相对丰度排名前10的优势属(相对丰度>1%)为未分类的蓝细菌(unidentified Cyanobacteria)、德沃斯氏菌属(Devosia)、假单胞菌属(Pseudomonas)、鞘脂单胞菌属(Sphingopyxis)、寡养单胞菌属(Stenotrophomonas)、柄杆菌属(Caulobacter)、罗河杆菌属(Rhodanobacter)、Pseudolabrys、噬氢菌属(Hydrogenophaga)和Reyranella,其中JZCK的地杆菌属(Pedobacter)和Terrimons相对丰度显著高于JZT。感病烟苗根围基质(JZT)特有的优势细菌属(>1%)为Dongia、慢生根瘤菌属(Bradyrhizobium)和纤维菌属(Cellulomonas),健康烟苗根围基质(JZCK)特有的优势细菌属(>1%)为Terrimonas、地杆菌属(Pedobacter)和Romboutsia。原始测序数据均上传至GenBank(BioProject ID:PRJNA752815;Biosample accession:SUB10169531)。
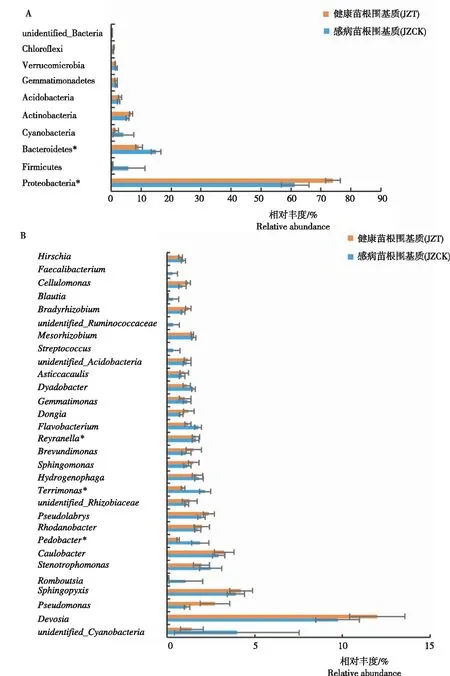
注:表示感病与健康烟苗基质微生物在P<0.05水平的差异显著性。下同。
由图3A可见,在门水平,所有样品的真菌主要分布于子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和隐真菌门(Rozellomycota),其中JZT2中的担子菌门相对丰度远高于其他样品。由图3B可见,在属水平,感病(JZT)与健康(JZCK)烟苗根围基质均有的优势属(丰度>1%)为金孢子菌属(Chrysosporium)和假裸囊菌属(Pseudogymnoascus),其中JZCK的Psiloglonium相对丰度显著高于JZT。感病烟苗根围基质(JZT)特有的优势属为锥毛壳属(Coniochaeta)、螺菌属(Neobulgaria)、丝衣霉属(Byssochlamys)、曲霉属(Aspergillus)和Pseudeurotium,其中JZT2的亡革菌属(Thanatephorus)的相对丰度可达91.9%,亡革菌属属于担子菌门,健康烟苗根围基质(JZCK)特有的优势真菌属(>1%)为节丛孢属(Arthrobotrys)。原始测序数据均上传至GenBank(BioProject ID:PRJNA752729;Biosample accession:SUB10
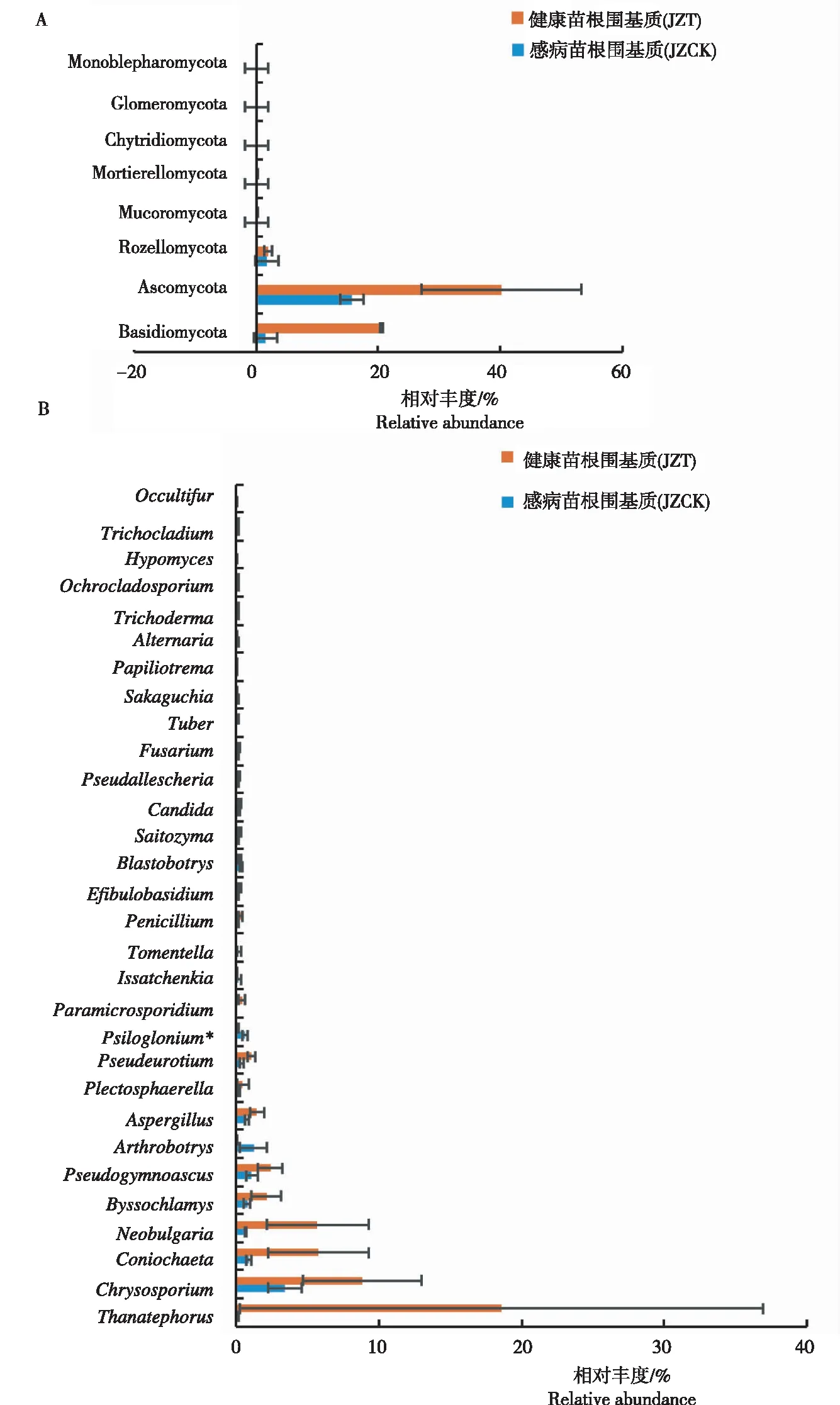
图3 感病与健康烟苗根围基质中真菌在门(A)、属(B)水平的群落组成
2.5 感病与健康烟苗根围基质微生物群落结构差异
如图4所示,经PCA分析,在细菌群落方面,感病(JZT)与健康(JZCK)烟苗根围基质细菌分布相对紧密,表明感病(JZT)与健康(JZCK)样品的微生物群落结构相似,PC1和PC2对群落结构的贡献值分别为26.38%和15.96%。在真菌群落方面,感病(JZT)与健康(JZCK)分布相对分散,表明罹病(JZT)与健康(JZCK)样品的微生物群落结构差异较大,PC1和PC2群落结构的贡献值分别为20.09%和17.2%。
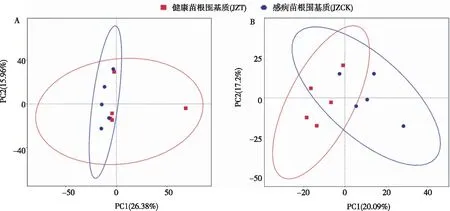
图4 罹病与健康烟苗根围基质细菌(A)和真菌(B)的PCA分析
2.6 真菌与细菌群落差异
如图5所示,真菌与细菌群落的R值均大于0,说明组内差异小于组间差异。在细菌群落中,P值大于0.05,JZCK与JZT间无显著差异;在真菌群落中,P值小于0.05,表明JZCK与JZT分组间存在显著性差异。
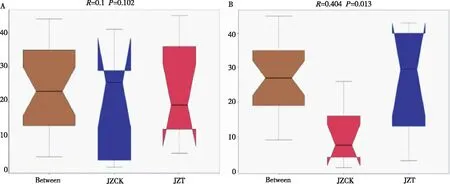
图5 感病与健康烟苗根围基质中细菌(A)和真菌(B)的ANOSIM分析
2.7 代谢功能
如图6A所示,感病与健康烟苗根围基质中细菌在一级代谢功能层主要分布于6类代谢通路:代谢类(Metabolism)、环境信息处理类(Environmental information processing)、遗传信息处理类(Genetic information processing)、细胞过程类(Cellular processes)、人类疾病类(Human diseases)和有机系统类(Organismal systems),其中代谢类在感病(JZT)与健康(JZCK)烟苗根围基质细菌群落中相对丰度最高,其次为环境信息处理类和遗传信息处理类,有机系统类丰度最低。
在二级代谢功能层上(图6B),整体来说,感病(JZT)与健康(JZCK)烟苗根围基质细菌主要分布于35类代谢通路,其中两者分布于新陈代谢类的细菌种类最多,功能从强到弱(>1%)的依次为氨基酸代谢(Amino acid metabolism,10.5%~11.0%)、碳水化合物代谢(Carbohydrate metabolism,9.8%~10.3%)、能量代谢(Energy metabolism,5.1%~6.1%)、异生素代谢和降解(Xenobiotics biodegradation and metabolism,3.7%~4.6%)、辅酶和维生素代谢(Metabolism of cofactors and vitamins,3.9%~4.3%)、脂质代谢(Lipid metabolism,3.6%~4.0%)、核苷酸代谢(Nucleotide metabolism,2.9%~3.3%)、代谢(Metabolism,2.4%~2.5%)、萜类化合物和聚酮化合物代谢(Metabolism of terpenoids and polyketides,2.0%~2.2%)、其他氨基酸代谢(Metabolism of other amino acids,2.0%~2.2%)、酶家族(Enzyme families,1.6%~1.9%)和聚糖生物合成和代谢(Glycan biosynthesis and metabolism,1.6%~1.8%)。
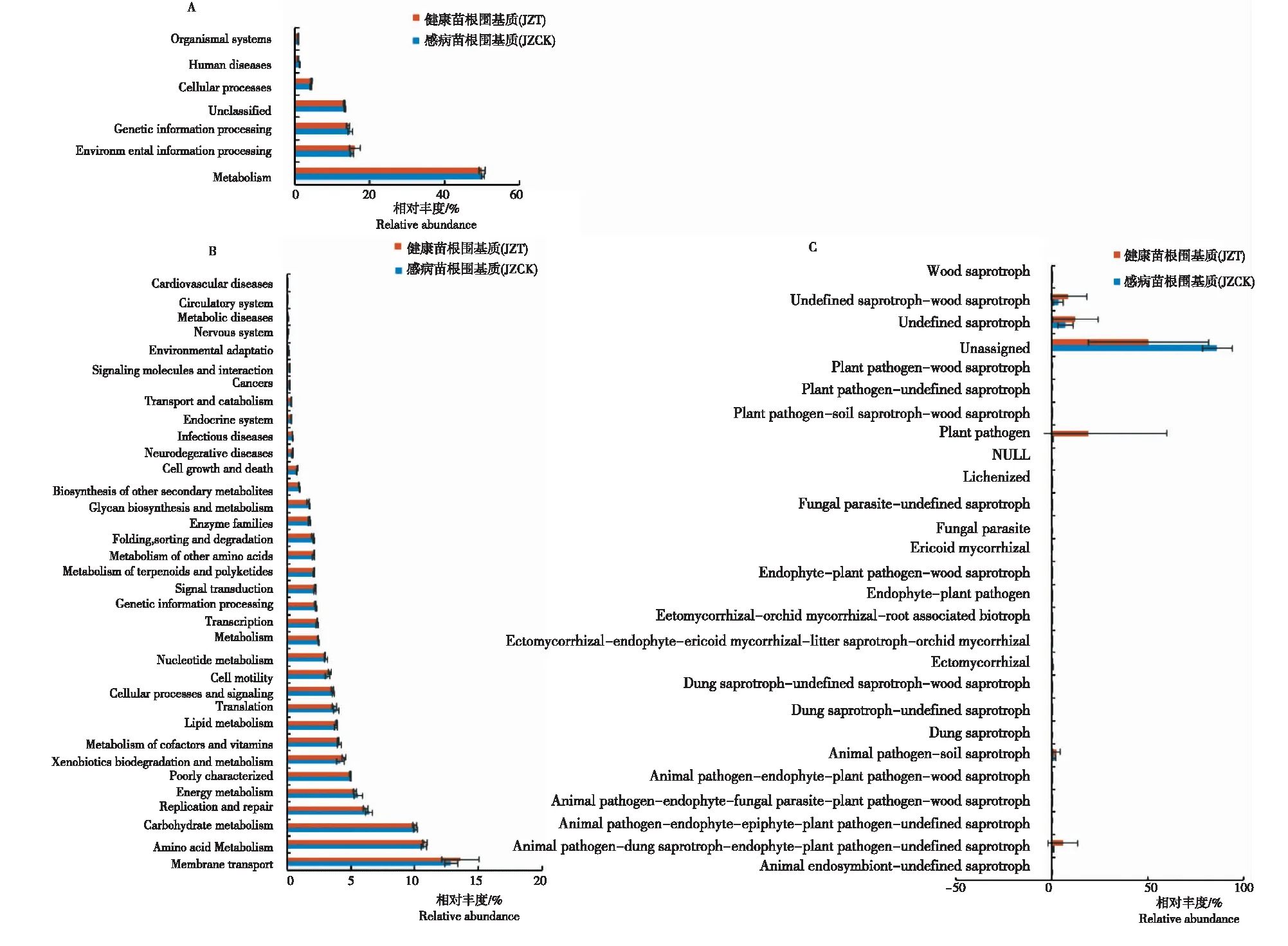
注:A, L1水平的KEGG功能相对丰度。B, L2水平的KEGG功能聚类热图。C, FUNGuild功能相对丰度。
苗期基质真菌经FUNGuild功能预测分析(图6C),感病(JZT)与健康(JZCK)烟苗根围基质真菌主要分布于25个生态功能群,不同样品之间功能组成相似,但优势功能群所占比例有所差异。健康烟苗根围基质(JZCK)中未定义腐生菌(Undefined saprotroph,7.1%)相对丰度最高,其次为未定义腐生-木腐生菌(Undefined saprotroph-wood saprotroph,3.4%)和动物病原-基质腐生菌(Animal pathogen-substrate saprotroph,1.1%)。感病烟苗根围基质(JZT)中植物病原菌(Plant pathogen,19.2%)相对丰度最高,其次为未定义腐生菌(Undefined saprotroph,12.4%)、未定义腐生-木腐生菌(Undefined saprotroph-wood saprotroph,8.8%)、动物病原-粪腐生-内生-植物病原-未定义腐生菌(Animal pathogen-dung saprotroph-endophyte-plant pathogen-undefined saprotroph,5.8%)和动物病原-基质腐生菌(Animal pathogen-substrate saprotroph,2.4%)。
3 讨论
在物种组成上,感病与健康烟苗根围基质微生物的组成和丰度具有明显差异。在细菌群落方面,在门水平上,感病(JZT)与健康(JZCK)烟苗基质优势细菌门为变形菌门、拟杆菌门和放线菌门,与向立刚等[12]对健康与感染黑胫病烟株根际基质细菌群落研究的优势细菌门结果类似。感病后,变形菌门丰度显著上升,变形菌门中包含大量的动植物病原菌[19],其相对丰度的显著升高,可能引起植株的抗逆性减弱,发病率上升的情况。在属水平上,感病与健康烟苗基质优势细菌属均为未分类的蓝细菌、德沃斯氏菌属、假单胞菌属等,与向立刚等[12]对健康与感染黑胫病烟株根际基质细菌群落研究的优势细菌属结果差异较大,可能原因是两者取样基质来源不同引起。感病烟苗根围基质中德沃斯氏菌属和假单胞菌属丰度分别高出2.3%和1.6%。德沃斯氏菌属为固氮共生菌[20],假单胞菌属的Pseudomonassyringaepv.tabaci和Pseudomonassyringaepv.angulata分别为烟草野火病和细菌性角斑病的致病菌[7],苗期基质发现的假单胞菌属中是否含有上述2种烟草致病菌有待进一步研究。在真菌群落方面,在门水平上,感病与健康烟苗基质优势真菌门为子囊菌门、担子菌门和罗兹菌门,与向立刚等[11]黑胫病感染对根际基质真菌群落研究的优势菌门基本一致。在属水平上,感病烟苗根围基质金孢子属与假裸囊菌属明显偏高,金孢子属为基质常见的腐生真菌[21],推测烟苗发病后,其生长环境和营养条件适宜菌群定殖及生长。此外,在感病烟苗根围基质上发现了特有的优势真菌曲霉属和亡革菌属(JZT2中占比达91.9%),曲霉属为基质和土壤中广泛存在的腐生菌,亡革菌属的Thanatephoruscucumeris为苗期烟草立枯病的病原菌,推测该研究取样的感病烟苗中可能存在感立枯病的烟苗,同时烟苗发病后,环境中的曲霉菌在罹病组织上获得繁殖。基于16s RNA和ITS的高通量测序技术能够较好的分析育苗基质中的细菌和真菌群落结构与多样性,然而,该技术不能扩增包括烟草腐霉、黑胫病菌在内的多种卵菌病原菌。为此,针对烟草育苗期常出现的卵菌病害,下一步有待采用卵菌选择性培养基或开发基于高通量测序的卵菌群落结构分析技术进行苗期卵菌病害的检测。
高通量测序技术既可揭示苗期微生物的群落结构,同时也可根据获得微生物的相对丰度对其环境微生物的功能进行预测。该研究发现,感病与健康烟苗根围细菌主要分布于代谢类,据报道寡养单胞菌属可以产生生长激素,促进根的生长发育[22],德沃斯氏菌属和柄杆菌属可以进行固氮作用[20,23],含鞘氨醇盒菌可以促进基质的降解[24]。这可能与苗期基质含腐熟或未腐熟的营养物质有关,需要通过细菌的降解转化为烟苗生长能利用的营养物质。真菌FUNGuild预测发现,感病与健康烟苗根围基质中均含有大量的腐生菌,腐生菌为基质中的常见菌属,结果与李朋发等[25]的研究结果一致。
4 结论
采用第二代高通量测序技术对感病与健康烟苗根围基质微生物群落结构及多样性分析发现,根围基质微生物群落结构复杂,其类群组成与烟苗感病与否密切相关。健康烟苗根围基质真菌和细菌的Alpha多样性指数均高于感病烟苗根围基质;感病基质的植物病原菌类群较健康基质多。
