二次谐波光谱和布鲁斯特角显微镜研究二棕榈酰磷脂酰胆碱和维生素B2的相互作用
2022-05-05刘江清于长卉雷圣宾
刘江清, 于长卉, 郭 源, 雷圣宾*, 张 贞*
1. 天津大学理学院化学系, 天津 300072
2. 北京分子科学国家研究中心, 中国科学院化学研究所, 北京 100190
3. 中国科学院大学, 北京 100049
引 言
界面手性是当今物理化学及相关学科研究的重点科学问题。 其对于药物特异性设计、 手性传感器的开发以及手性分离技术的发展具有重要意义[1]。 其中, 磷脂Langmuir单层膜因为常常作为研究生物膜的模型体系而倍受青睐[2]。 二二棕榈酰磷脂酰胆碱(dipalmitoyl-sn-glycero-3-phosphocholine, DPPC)是Langmuir单层膜研究最多地分子。 其在界面的手性结构及其与其他分子的相互作用一直是这方面研究的前沿问题。 磷脂荧光显微镜和布鲁斯特角显微镜已经发现L-DPPC, D-DPPC能在气液界面形成手性相反的两种手性微畴结构[3]。 如何从分子水平解释这两种相反手性微畴结构的形成机理及外来物质对此的影响, 一直是一个有待解决的科学问题, 需要联合应用具有界面选择性和灵敏性的谱学方法和成像技术进行深入研究。
维生素B2(VB2)作为一种针对组织脂质沉积疾病的有效药物, 已经被证明可以显著改善乙酰-CoA脱氢酶缺乏症(riboflavin-reactive multiple acyl-CoA dehydrogenase deficiency, RR-MADD)的临床症状, 甚至减少或去除某些患者肌肉纤维中的脂质聚集体[4]。 VB2作为一种药物分子, 它和磷脂手性的选择性相互作用可能有助于理解VB2如何在膜生物事件中起到关键性作用。
二次谐波-线二色谱(second harmonic generation linear dichroism, SHG-LD)也已经成为单层膜手性研究中一种重要的手性识别原位方法之一, 可以通过表面手性过量值(degree of chiral excess, DCE)值的大小和方向判别界面是否具有手性结构, 为描绘界面微畴组织中分子骨架的扭转排列提供依据[5]。
布鲁斯特角显微镜(Brewster angle microscopy, BAM)是一种实时原位监测脂质单层膜形貌和相变过程的技术[6]。 其最大优势是可以给出共存相上微畴的位置、 密度、 形状、 大小和数目及分子之间的相互作用[7]。
本工作利用二次谐波光谱、 Langmuir膜天平和布鲁斯特角显微镜研究了L-DPPC, D-DPPC以及race-DPPC三者与VB2分子间相互作用, 发现VB2既可以调控界面DPPC微畴尺寸, 也能诱导race-DPPC Langmuir单层膜出现手性相分离。
1 实验部分
1.1 材料和样品制备
本研究中使用的L-DPPC, D-DPPC, race-DPPC购买于Sigma-Aldrich 公司(>99.5%), 甲醇和氯仿(98%)购自Fisher Scientific公司, VB2购买于Sigma-Aldrich公司(纯度>99.5%)。 L-DPPC, D-DPPC和VB2分子结构式如图1所示, 以上试剂均未经进一步处理直接使用。 实验所用纯水为超纯水仪(Millipore company, 18.2 MΩ·cm)处理过的去离子水。 所有实验均在室温(23 ℃)和常压下进行。 L-DPPC, D-DPPC, race-DPPC溶于氯仿/甲醇混合物(体积比: 3∶1V/V), 配制成0.5 mmol·L-1浓度的溶液。 为了研究VB2分子对DPPC单层膜微畴的影响, 本实验将该DPPC溶液用微量进样器铺展在纯水界面和亚相为VB2溶液(0.085 mmol·L-1)上形成Langmuir单层膜。

图1 (a) L-DPPC分子结构式; (b) D-DPPC结构式;(c) VB2分子结构式
1.2 表面压力面积-等温线(等温线)
等温线研究是在Langmuir膜天平中进行测量的。 该天平配备了一个324 mm×75 mm特氟龙样品槽(KSV, 芬兰)、 两个滑障(Delrin)用来提供对称的薄膜压缩和平衡。 采用Wilhelmy吊片法(铂片)对薄膜压缩过程中的表面压力和平均分子面积进行实时监测。 使用微量进样器将60 μL的溶液均匀铺展在界面上, 等待10 min使有机溶剂完全挥发。 滑障的平均压缩速率为10 mm·min-1。 所有的等温线经过多次重复。 通过对每个单独的和混合的DPPC单层膜进行多次Langmuir膜平衡和BAM显微镜实验, 并确保每条等温线都在误差范围内, 确定其可重复性。 所有实验均在常温常压下进行。
1.3 二次谐波-线二色谱法
二次谐波-线二色谱(SHG-LD)研究界面单层膜手性的实验描述已经在以往的研究报导过[8]。 本研究所用的SHG-LD仪器简要描述如下, 脉冲宽度为80 fs、 重复频率为82 MHz的宽带可调谐锁模飞秒钛宝石激光器(Tsunami 3960C, SpectraPhysics)产生中心波长为800 nm的基频光作为入射光, 入射光通过偏振器和半波片, 最后通过光学透镜(f=100 mm)聚焦在空气/水界面上, 入射光强度为600 mW·cm-2。 界面上产生的二次谐波(SH)信号光通过短通滤波片过滤, 由单色仪(WDG10, 北京精工成机电设备有限公司)收集, 然后经过前置放大器(SR445A, Stanford research system)、 单光子计数器(SR400, Stanford research system)及光电倍增管(R585, Hamamatsu)检测。 通过自动旋转半波片, 在不同的入射偏振角下进行S偏振检测, 得到偏振曲线, 由此偏振曲线确定体系的DCE值。 样品池直径为7 cm, 通过检查H2O界面手性信号, 确定其DCE=0, 表明实验中手性检测不存在系统误差。 使用微量进样器将浓度为0.5 mmol·L-1的L-DPPC, D-DPPC和race-DPPC的溶液以体积分别为25, 28和30 μL铺展在界面上, 形成Langmuir单层膜。
1.4 布鲁斯特角显微镜
布鲁斯特角显微镜(BAM)是基于KSV Langmuir膜天平由本实验室自行搭建的。 该装置使用He-Ne激光(HNL210LB, Thorlabs)作为入射光源。 该光源波长为632.8 nm, 输出功率为21 mW的平行光, 以53.1°的角度入射到气液界面, 经过半波片和格兰棱镜衰减和起偏后入射到气液界面。 反射光通过无穷远校正的20×Nikon物镜和半消色差透镜(f=200 mm)进入到CCD(Retiga R6TM, Teledyne Photometrics), 收集BAM成像信息。 研究中全幅图像的视野大小为648 μm×400 μm, 使用ImageJ软件对BAM捕获的图像进行处理。 图像仅进行裁剪以及图片增强, 未对图像进行其他处理。
2 结果与讨论
2.1 π-A等温线
如图2所示, 在VB2分子的影响下, L-DPPC单层膜起始单分子面积右移了约10 Å2。 分析认为VB2分子趋向于与L-DPPC酰基之间相互作用, 使DPPC分子亲水基团与水的接触面积变大[9]。 从纯水界面上的L-DPPC和D-DPPC π-A等温线中可以观察到当单分子面积减小到约86 Å2时, 液态扩展相(liquid expand phase, LE相)开始向凝聚相(liquid condensed phase, LC相)转变。 表1为DPPC单层膜的不同相变点(πt1表示LE/LC共存相的初始膜压和终止膜压), 从图2和表1中可以看出LE/LC相都处于3~10 mN·m-1的膜压范围。 纯水界面外消旋单层膜的LE/LC共相阶段的平均分子面积位置和膜压区域发生变化, 说明在相同的膜压下外消旋单层膜上分子的空间排列和取向发生了变化[10], 而VB2水溶液上race-DPPC单层膜的LE/LC共存相的平台区域消失。 两种亚相下L-DPPC和D-DPPC单层膜LE-LC阶段的膜压几乎不发生变化。 然而, 仅通过模压并不能推断在3~10 mN·m-1内, VB2对L-DPPC和D-DPPC的分子间排列没有影响, 因为可能存在着烷基链异构化的二级相变[11]。 此外, 水溶性VB2结构中存在大量的亲水基团, 其表面活性非常低, VB2不可能通过渗透作用取代H2O分子, 更不可能可能替代高表面活性的DPPC分子, 因此VB2与DPPC分子发生相互作用的区域主要在脂质分子的亲水头基。
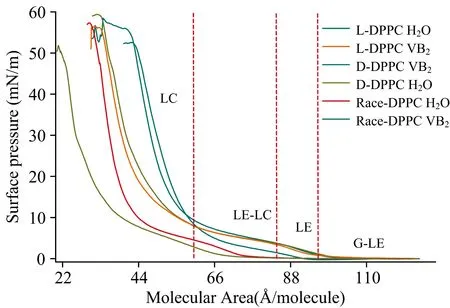
图2 在超纯水和VB2水溶液界面上扩散的L-DPPC, D-DPPC和race-DPPC单层膜的π-A等温线

表1 L-DPPC, D-DPPC, race-DPPC的相变点和LC相的极限单分子面积
VB2溶液界面DPPC单层膜的LC相线段都向左移动, 从表1中L-DPPC分别在纯水与VB2表面上AC差值(≈9)来看, VB2的这种诱导似乎没有手性选择性。 因此, 在LC相时纯水界面上race-DPPC单层膜内自发的非单一手性(heterochiral interaction,EL-D)相互作用和VB2分子的诱导都使可压缩面积减小, 这种自发的非单一手性相互作用大于单一手性(homochiral interaction,EL,L,ED,D)相互作用, 即L-D>L-L≈D-D。 VB2也影响了单层膜内DPPC分子之间横向的单一手性相互作用和非单一手性相互作用, 其强弱关系为L-D≈L-L≈D-D。 从表1中的崩溃膜压(collapse pressure)πc来看, VB2分子的存在导致了L-DPPC和D-DPPC单层膜的崩溃膜压升高, 说明VB2比水更有利于DPPC头基的自由能最小化[12], 使DPPC头基的空间结构体积变小。 相反, VB2诱导race-DPPC的塌缩膜压降低, 破坏了这种较强的非单一手性相互作用, 导致崩溃压降低。
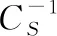
式中, π为单分子层的表面压力,A为单分子面积。
如图3所示, 在单层膜处于LE/LC相时, 表面张力处于5~15 mN·m-1, 由于VB2的存在, L-DPPC弹性模量升高, L-DPPC的单层膜的分子排列得更紧密, L-DPPC烷基链相对界面法线的取向变得有序。 当膜压为15~35 mN·m-1时, VB2仍然使L-DPPC烷基链变得更有序, 诱导D-DPPC和race-DPPC烷基链变得更无序。 为了进一步理解这种相互作用的微观细节, 利用SHG-LD方法研究DPPC分子在界面上的手性变化。
图3 在超纯水和VB2水溶液界面上L-DPPC, D-DPP和Crace-DPPC单层膜的表面张力分别为5, 15, 25和35 mN·m-1时的弹性模量
2.2 SHG-LD光谱
不同手性的DPPC分子单分子膜在VB2溶液界面相互作用不同, 因此有必要从分子水平研究界面L-DPPC, D-DPPC和race-DPPC分子的手性变化。 采用SHG-LD方法来检测膜压为13 mN·m-1时, L-DPPC, D-DPPC和race-DPPC的手性, 图4为膜压13 nN·m-1时L-DPPC, D-DPPC和race-DPPC的SH强度随入射偏振化曲线。 从图4(a, c)可以看出, 在纯水界面上, L-DPPC和D-DPPC的SH信号强度相近(~60 counts)。 而在VB2水溶液亚相, D-DPPC与SH信号强度相近(~40 counts), L-DPPC信号强度有所提升(~55 counts), 表明此时分子取向更加有序; D-DPPC信号强度有所下降(~40 counts); 表明此时分子取向变得较为无序。 从图4(e, f)中可见, race-DPPC在两种亚相上的SH信号强度大致相等(~73 counts), 说明VB2对race-的DPPC微畴在界面上的分子结构没有影响。 如表2所示, L-DPPC和D-DPPC在纯水界面的DCE值表明, 这两种DPPC分子的自组装微畴具有微弱的手性[15]; 当亚相为VB2水溶液, D-DPPC的DCE增大, 表明D-DPPC单层膜内的宏观微畴也具有一定的手性结构。 为了形象说明VB2对DPPC Langmuir 膜的影响, 对此体系进行了布鲁斯特显微镜测量。
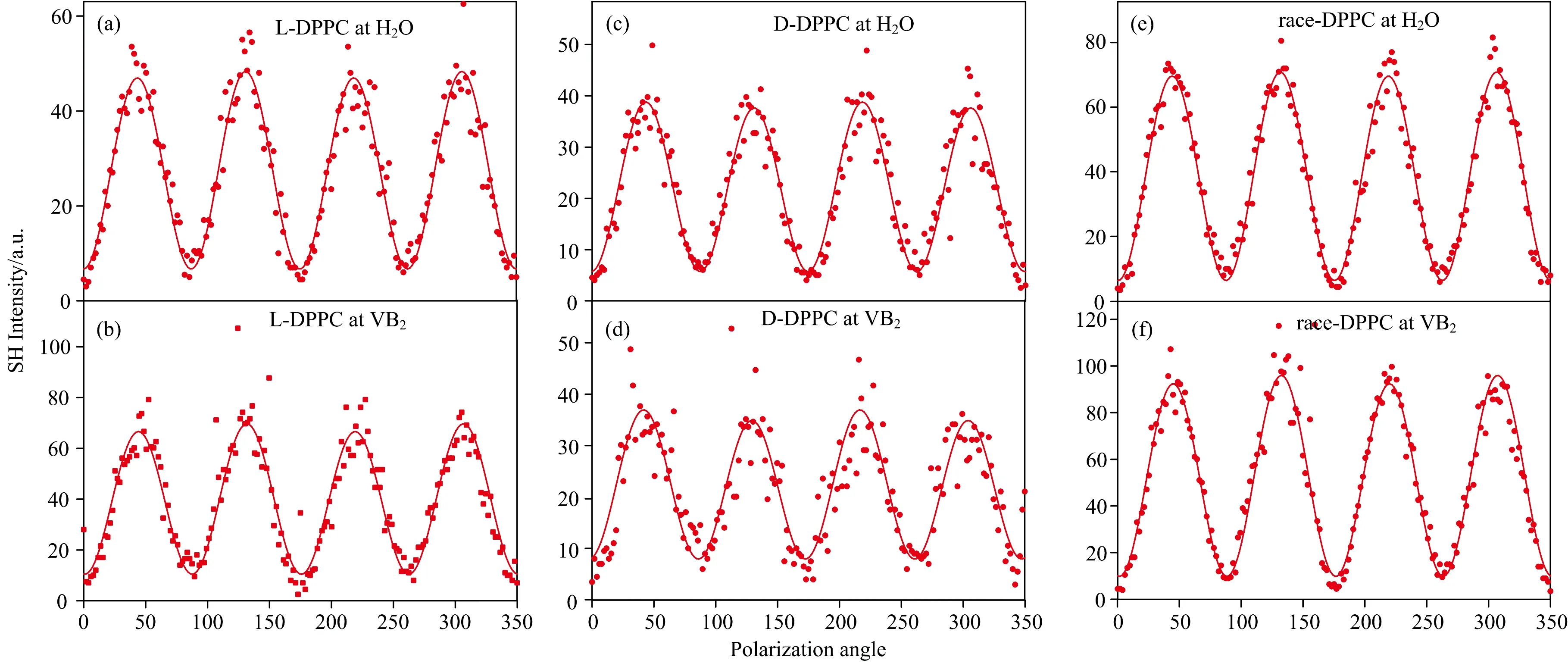
图4 单层膜处于13 mN·m-1, (a), (b)为L-DPPC在纯水和VB2水溶液表面的SH强度和DCE值; (c), (d)为D-DPPC在纯水和VB2水溶液表面的SH强度和DCE值; (e), (f)为race-DPPC在纯水和VB2水溶液表面的SH强度和DCE值

表2 单层膜处于13 mN·m-1, L-DPPC, D-DPPC和race-DPPC单层膜的DCE值
2.3 BAM观察横向微畴
如图5(a)和(c)所示, 纯水界面上的L-DPPC和D-DPPC单层膜上都经历了成核和生长过程。 当膜压升高至13 mN·m-1, 微畴会长出伸展臂以逆时针或者顺时针方式弯曲, L-DPPC和D-DPPC形成直径大小为15~30 μm的左旋和右旋的螺旋三叶草形状的手性微畴, 与文献报道一致[16]。 这种三叶草形成的条件与有机溶液中初始的DPPC的分子手性有关[16]。 此外, 压缩速率和温度均对最后形成微畴的大小有影响, 但是不会改变L-DPPC和D-DPPC相反的宏观手性[17-18]。 从物理角度分析, 微畴的形状是微畴之间静电排斥和线张力之间竞争作用的结果, 脂质分子垂直偶极距之间的静电排斥使畴变长, 而线张力将畴拉成紧凑的形状[19]。
如图5(d)所示, 在VB2水溶液界面上D-DPPC微畴在13 mN·m-1处长成直径大小约为40 μm的大三叶草结构, 类似的这种左旋和右旋三叶草微畴对应的DCE分别为正值和负值, 与本研究的SHG-LD的结果相符合。 与纯水亚相相比, 微畴与微畴之间的距离增大, 微畴的面积增大了1~2倍。 VB2分子诱导微畴变大的原因, 可能来源于VB2在弱酸性条件下质子化。 质子化后的VB2与DPPC的磷脂头基发生静电相互作用, 使得微畴之间相互吸引。

图5 单层膜处于13 mN·m-1, (a), (b)分别为在纯水和VB2水溶液表面上的L-DPPC微畴; (c), (d)分别为在纯水和VB2水溶液表面上的D-DPPC微畴; (e), (f)分别为在纯水和VB2水溶液表面上的race-DPPC微畴, 每张图像大小为150 μm×50 μm
如图5(b)所示, VB2水溶液上的L-DPPC的BAM图像除了三叶草微畴外, 还出现了四叶草微畴, 其枝臂曲率的方向没有统一的指向, 而且其微畴枝臂上的手性状态也不一致。 L-DPPC和D-DPPC单层膜在VB2水溶液界面上出现了镜像的心脏型微畴, 这种不同于三叶草形状微畴的出现可能是由DPPC不同水解位点产生的两个对映体产物的分离。 此外, 还观察到DPPC分子在界面上不同位置碰撞成核生长的速率也不尽相同。 导致图5(b)和(d)中夹杂着其他心脏型结构的微畴。 另外, 在图5(b)中也发现了四叶草微畴结构, 可能因L-DPPC的水解产物聚集而形成。 图5(e)展示了VB2和race-DPPC的相互作用。 从图中可见, race-DPPC单层膜的微畴的密度较大, 最后长成直径为10 μm大小的圆形微畴, 非单一手性相互作用使微畴的密度增大, 畴与畴之间的斥力较大, 在纯水界面上的race-DPPC的微畴圆形有被拉长的趋势。 SHG-LD也表明其DCE不等于零[图4(f)]。 这是一个有趣的新现象。 其原因可能有两种, 一是微畴内对映体过剩, 存在着手性相分离; 二是DPPC的水解产物聚集引起的。 这种现象从图5(f)可以看得更清楚。 VB2溶液的界面race-DPPC微畴密度降低, 脂质分子聚集体中垂直偶极矩的斥力相互作用使圆形的微畴周围出现了枝臂, 存在着手性相分离, 导致了非零值的DCE。 由二次谐波光谱测量的DCE的绝对值的大小反映了微畴结构的不对称度, 表明了微畴内对映体的相对剩余量。 微畴中某一种对映结构的相对剩余量越多, 就会在宏观上表现出相应的宏观手性。
图6(a)—(f)为VB2水溶液上L-DPPC结构随膜压变化的BAM图。 从此图能够实时观察到了在VB2水溶液上的L-DPPC的成核生长过程。 因此可以推断L-DPPC在VB2溶液界面自组装过程。 首先DPPC界面上成核生长至心脏型微畴, 然后心脏型微畴之间相互识别, 心脏型的尖端边缘的分子密度很大, 心脏尖端与尖端之间进行组装, 形成了S型的微畴结构, 最后这些S型的微畴结构, 组装成了左旋的三叶草。

图6 L-DPPC单层膜处于13~15 mN·m-1处在VB2水溶液界面三叶草生长过程(a—f)的BAM图片, 每张图像大小为150 μm×50 μm
3 结 论
通过二次谐波-线二色(SHG-LD)光谱、 布鲁斯特角显微镜(BAM)及膜压曲线研究了维生素B2(VB2)与二棕榈酰磷脂酰胆碱(DPPC)气液界面Langmuir膜的相互作用。
(1) 膜压曲线表明, VB2可与DPPC分子发生明显的相互作用。 VB2可以提高L-DPPC单层膜的稳定性。
(2) SHG-LD测量表明, VB2对于L/D-DPPC手性的形成具有促进作用, 并且诱导race-DPPC也形成手性结构。
(3) BAM研究表明, VB2可使 D-DPPC三叶草形状的大小增长1~2倍, 且不改变分枝数。 VB2可诱导race-DPPC发生手性相分离。
