钛铁矿和辉石浮选分离试验研究及抑制剂作用机理
2022-05-05高虎林刘建罗德强董文超于云龙郝佳美秦晓艳
高虎林,刘建,罗德强,董文超,于云龙,郝佳美,秦晓艳
1.昆明理工大学 国土资源工程学院,云南 昆明 650093;2.攀钢集团矿业有限公司设计研究院,四川 攀枝花 617063
引 言
钛是一种重要的稀有金属材料,具有密度小、比强度高、抗蚀性强等优点,在航空航天、交通运输、石油化工等领域得到广泛应用,享有“太空金属” “智能金属”等美誉[1-2]。21世纪以来,我国钛工业高速发展,成为世界钛工业的生产主体与消费主体。目前,我国主要回收利用的钛资源为钛铁矿和少量的金红石[3],而随着金红石储量的不断减少,钛铁矿逐渐成为提取钛与二氧化钛的主要矿物。钛铁矿的化学成分为(FeO·TiO2),是一种三方晶系氧化物矿物,由于类质同象的代替,常会混入Ca、Mg、Mn、V等成分[4]。晶体结构如图1(a)所示,钛和铁是钛铁矿晶格中的阳离子,空间群为R3形态[5]。钛铁矿选别方法较多,主要有重选、磁选、浮选、电选等。近年来,由于钛铁矿开采力度加大,矿石性质变得复杂化,产生大量的微细粒级钛铁矿,使得矿物在选矿力场中所受捕捉力差异减小,基于物理性质的选别方法分选效果不佳,需要通过浮选药剂来调控矿物表面性质的差异,以获得良好的分选效果。浮选因此成为钛铁矿主要选别方法之一[6]。
在钛铁矿浮选过程中辉石是主要脉石矿物,是一种常见的链状结构的硅酸盐矿物,以硅氧四面体形成的分子链为主要构架,主要分子式为XY(Si,Al)2O6,其中X为Ca2+、Mg2+、Fe2+、Na+等,Y为Mn2+、Mg2+、Fe2+、Cr3+、Ti4+[7-9]。常见晶体结构如图1(b)所示,晶格中主要含有钙、镁、硅等阳离子。综上所述,钛铁矿与辉石表面分布的金属元素种类接近,浮选过程中二者表面会暴露出相似的活性位点,使得药剂吸附的选择性降低,浮选分离效果差。因此寻找高效、选择性强的抑制剂,以及研究药剂抑制机理具有重要意义[10]。邓传宏等[11]研究认为,弱酸性条件下以水玻璃为抑制剂、油酸钠为捕收剂可实现钛铁矿和钛辉石的分离,这是由于水玻璃可以选择性吸附在钛辉石表面,并且水玻璃可以减弱这两种矿粒间的异相凝聚,以促进矿粒分散。Liu等[12]在钛铁矿和钛辉石浮选分离试验中使用草酸选择性抑制钛辉石。研究结果表明抑制机理是草酸与钛辉石表面金属离子反应形成不溶性金属配合物,从而抑制钛辉石。
本试验主要在以MOH为捕收剂的浮选体系中,研究了水玻璃、草酸、LD-C分别为抑制剂对钛铁矿与辉石单矿物浮选分离性能,并结合溶液化学分析、Zeta电位测试、红外光谱测试对药剂与矿物的作用机理进行深入分析。

图1 钛铁矿和辉石晶体结构示意图:(a)钛铁矿;(b)辉石
1 试验
1.1 试样制备与试剂
钛铁矿与辉石的单矿物分别来自伊朗某钛铁矿的磁选钛精矿与尾矿,将磁选后的钛精矿与尾矿,经过多次的摇床重选和磁选进行提纯,最终获得了TiO2品位为49.5%的钛铁矿单矿物,钛铁矿纯度达到94%;辉石纯度约为92%。钛铁矿、辉石的XRD图谱如图2中(a)、(b)所示,图谱中出现的衍射峰分别为钛铁矿、辉石的衍射峰,因此二者均可作为试验研究样品。对提纯后的钛铁矿与辉石单矿物进行预选筛分,将筛分出-0.074+0.038 mm粒级的矿物贮存,用作浮选试验;+0.074 mm粒级的矿物通过玛瑙材质的三头研磨机研磨后筛分,取-0.038 mm粒级的矿物密封保存,用于红外光谱(FT-IR)测试和动电位测试。
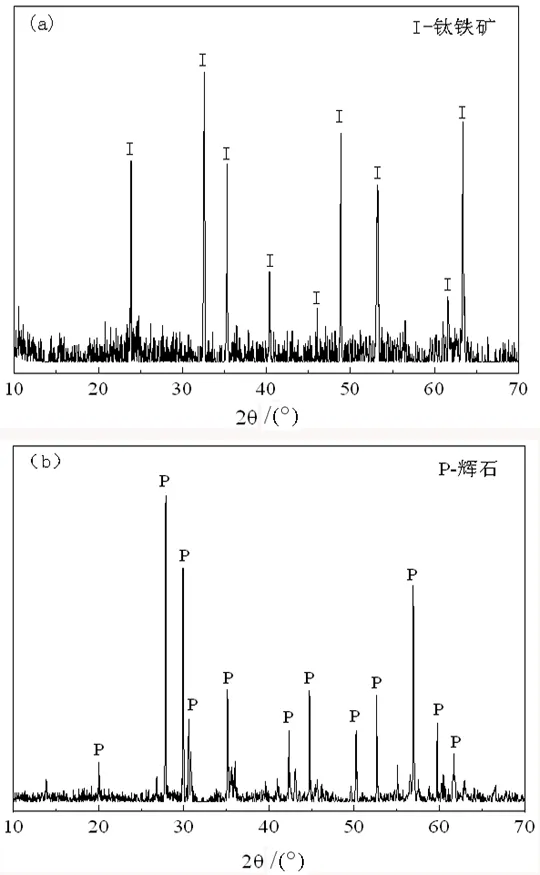
图2 钛铁矿和辉石的X射线衍射图:(a)钛铁矿;(b)辉石
浮选试验使用的捕收剂MOH与柴油为工业纯。药剂MOH是一种复配的新型钛铁矿捕收剂[13]。pH调整剂中硫酸为工业纯,盐酸为分析纯。抑制剂为水玻璃和草酸分析纯。药剂LD-C是一种合成的有机高分子抑制剂(多糖类),主要基团有羧基(-COOH)、羟基(-OH)和醚基(C-O-C)。试验用水为去离子水。
1.2 浮选试验
浮选设备采用RK/FGC挂槽浮选机。试验每次称取2 g纯矿物,加入到注加40 mL去离子水的浮选槽中。流程及药剂制度如下:首先搅拌调浆1 min,随后加入pH调整剂搅拌3 min,抑制剂作用3 min,捕收剂作用3 min,浮选时间为3 min。纯矿物浮选结束后,将上浮产品过滤、烘干、称重,最后计算回收率。
1.3 傅里叶变换红外光谱(FT-IR)测定
红外光谱测定使用傅立叶变换红外光谱仪(Nicolet iS 50),在800~4 000 cm-1范围内记录FT-IR光谱,表征抑制剂与矿物质之间的相互作用。称取粒度为-5 μm矿物样品1.0 g添加到40 mL含或不含LD-C的pH为5.5的溶液中。调节30 min后将样品过滤,洗涤,然后在50 ℃下真空干燥,称取约1 mg已干燥矿样与100 mg光谱级KBr混合,压制圆盘沉淀进行红外光谱测试。
1.4 Zeta电位测试
使用Zetasizer Nan-ZS90电位分析仪测量矿物颗粒的Zeta电位。首先称取0.1 g的-5 μm试验矿样加入到放有40 mL去离子水的烧杯中,然后在烧杯中加入0.01 mol/L的NaCl作为电解质,随后将该样品置于磁力搅拌器下调节2 min。矿浆调节结束后,按照单矿物浮选时最佳药剂制度进行加药,作用完成后,关闭磁力搅拌器,将样品静置1 min。样品静置结束后吸取上清液注入到样品池中用于电位测量。每个样品进行三次测试,最后将三次结果的平均值作为Zeta电位的最终结果。
2 结果与讨论
2.1 捕收剂用量对矿物可浮性的影响
首先在目前钛铁矿浮选中广泛应用的pH=5.0~6.0条件下[14],考察了捕收剂MOH用量对钛铁矿和辉石可浮性影响,试验结果如图3所示。
从图3可以看出,在pH为5.0~6.0的区间内,随着捕收剂用量增加,钛铁矿与辉石的回收率都随之增加;当捕收剂用量为160 mg/L时,钛铁矿的回收率达到 85%,辉石回收率为 24.5%,此时两者回收率差距最大;继续增加捕收剂用量,钛铁矿的回收率增加幅度有限,而辉石的回收率显著增加,因此适合的捕收剂用量为160 mg/L。

图3 捕收剂用量对钛铁矿和辉石可浮性的影响(柴油用量:10mg/L; pH:5~6)
2.2 不同抑制剂对矿物可浮性的影响
在捕收剂MOH用量为160 mg/L、pH=5.0~6.0时,对钛铁矿与辉石进行不同的抑制剂试验。抑制剂选用LD-C以及在钛铁矿浮选中应用广泛的水玻璃、草酸[15]。
水玻璃、草酸、LD-C药剂用量对钛铁矿与辉石浮选性能的影响分别如图4 ~图6所示。由图4可知,随着水玻璃用量的逐渐增加,钛铁矿与辉石的回收率逐渐降低,表明水玻璃对钛铁矿和辉石皆有一定的抑制作用,若要强烈抑制辉石需要较大的药剂用量,但钛铁矿回收率也可能因此大幅度降低,因此以水玻璃作抑制剂的浮选分离效果较差。由图5可以看出,草酸对钛铁矿与辉石都具有较为明显的抑制作用,草酸用量为20 mg/L时,钛铁矿、辉石回收率分别为72%、10%;而当草酸用量为40 mg/L时,辉石的回收率降低至4%,但此时钛铁矿的回收率仅有38%。因此以草酸为抑制剂时,在较低的药剂用量水平下可以达到一定的分离效果,但效果并不显著。
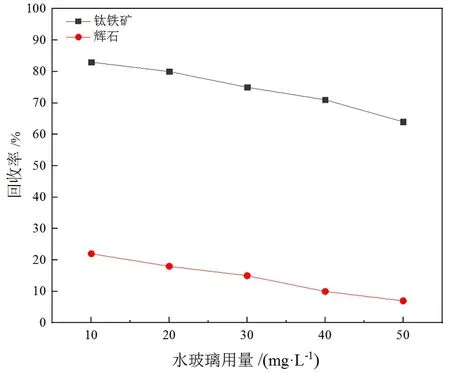
图4 水玻璃用量与矿物可浮性的关系(捕收剂用量:160 mg/L;柴油用量:10 mg/L; pH:5~6)
从图6可以看出,在LD-C用量为2 mg/L时,钛铁矿回收率为80%,辉石回收率为9%,二者获得良好的分离效果,此时LD-C的抑制效果表现出较强的选择性。当继续增加药剂用量时,辉石愈发被抑制,但钛铁矿也明显地被抑制,回收率急剧下降,此时的药剂用量不再适宜。这表明LD-C最佳药剂用量为2 mg/L,此时钛铁矿、辉石浮选分离效果最好。
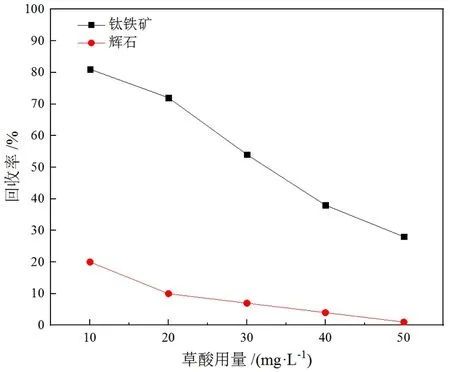
图5 草酸用量与矿物可浮性的关系(捕收剂用量:160 mg/L;柴油10 mg/L;pH:5~6)
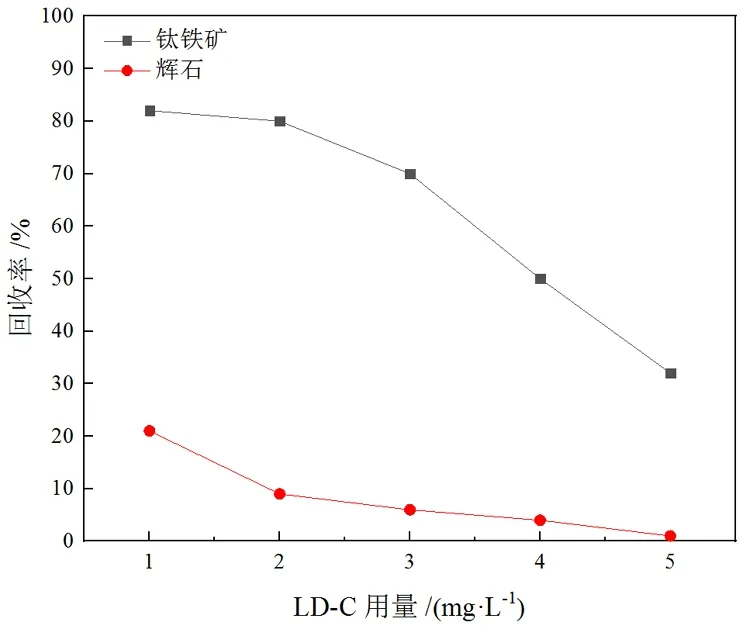
图6 LD-C用量与矿物可浮性的关系(捕收剂用量:160mg/L;柴油用量:10mg/L;pH:5~6)
2.3 钛铁矿溶液化学分析
钛铁矿(FeO·TiO2)的浮选溶液化学计算可以分别通过计算FeO和TiO2的溶液化学计算表示。在水溶液中,FeO和TiO2与水溶液平衡关系表示如下[16]:
FeO水溶液的平衡关系:
FeO+H2OFe2++2OH-K1=10-15.1
(1)
Fe2++OH-Fe(OH)+K1=104.5
(2)
Fe2++2OH-Fe(OH)2K1=107.4
(3)
Fe2++3OH-Fe(OH)3-K1=1010.0
(4)
TiO2水溶液的平衡关系:
TiO2+2H2OTi4++4OH-K1=10-58.3
(5)
Ti4++OH-Ti(OH)3+K1=1014.15
(6)
Ti4++2OH-Ti(OH)22+K1= 1027.88
(7)
Ti4++3OH-Ti(OH)3+K1= 1041.27
(8)
Ti4++4OH-Ti(OH)4K1=1054.33
(9)
根据上述平衡关系,计算出各组分浓度的pH,并绘制钛铁矿的浮选溶液浓度对数图于图7。

图7 钛铁矿浮选溶液浓度对数图
从图7可以看出,在浮选试验的pH=5~6时,钛铁矿表面主要以Ti(OH)4、Fe2+、Fe(OH)+、Fe(OH)2的形式存在,其中Fe2+和Fe(OH)+的性质较为活泼,Ti(OH)4性质较稳定,所以在该pH范围内,亚铁离子及其羟基络合物为捕收剂主要作用位点,此时矿物表面显正电。
2.4 钛铁矿与辉石的Zeta电位测试
对钛铁矿与辉石在不同药剂作用条件下的Zeta电位进行了测试,所得结果如图8、图9所示。由图8可知,钛铁矿的等电点约出现在pH=6,这与Yang等[17]的研究相符合。在添加抑制剂LD-C后,钛铁矿的动电位发生较小程度的负移,表明LD-C作用于钛铁矿表面,且LD-C在溶液中显负电性。在加入LD-C后继续添加捕收剂MOH,此时钛铁矿表面的动电位进一步负移,且负移程度较大,说明钛铁矿在吸附一定的LD-C后仍能与MOH发生较强作用,从而使得在浮选中添加LD-C的情况下,钛铁矿依然能够表现出良好的可浮性。在pH=5~6时,结合溶液化学分析可知,钛铁矿此时显正电,与LD-C的作用形式可能以静电吸附为主,使得捕收剂MOH仍可与钛铁矿表面主要存在的亚铁离子及其羟基络合物作用,因此此时药剂作用前后的动电位变化最大,捕收剂作用效果最佳。

图8 钛铁矿、钛铁矿+LD-C、钛铁矿+LD-C+MOH在不同pH下的Zeta电位(MOH用量:160 mg/L;LD-C用量:20 mg/L)
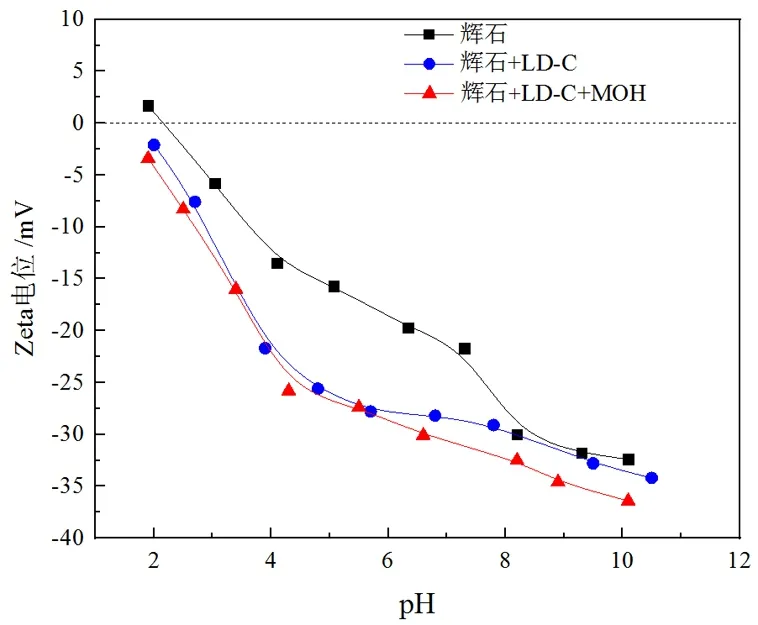
图9 辉石、辉石+LD-C、辉石+LD-C+MOH在不同pH下的Zeta电位(MOH用量:160 mg/L;LD-C用量:20 mg/L)
由图9可知,随着pH的升高,辉石表面的动电位呈现下降趋势,辉石表面动电位的零电点出现在pH为2.2左右,这与魏志聪等[18]的研究相符。在添加LD-C后,辉石表面动电位发生负移,在pH为5~6时最为明显,此时荷负电的辉石表面可以与同样显负电的LD-C作用,表明在此pH范围内,LD-C在辉石表面发生了显著吸附,且可能以化学吸附为主。 但在该pH范围内,进一步加入捕收剂MOH后,辉石表面动电位变化很小,说明此时MOH与吸附LD-C后的辉石表面几乎未作用,这可能是由于LD-C吸附后阻碍了MOH与辉石的作用,这一结果与辉石的单矿物浮选试验相一致。
2.5 钛铁矿、辉石和浮选药剂的红外光谱(FT-IR)测试
2.5.1 LD-C与钛铁矿作用的红外光谱分析
根据浮选试验的研究结果,本试验选择LD-C作为钛铁矿与辉石分离的抑制剂,在波数为800~4 000 cm-1记录样品的红外光谱,以研究LD-C在钛铁矿与辉石表面的吸附作用机理。药剂LD-C与钛铁矿作用的红外光谱分析如图10所示,抑制剂LD-C在1 029 cm-1处为C-O-C的伸缩振动吸收峰,1 418 cm-1处为-COO-的对称伸缩振动吸收峰,1 617 cm-1处为-COO-的反对称伸缩振动吸收峰,2 925 cm-1,3 432 cm-1处为-OH的伸缩振动吸收峰[19-20]。在钛铁矿的红外光谱中,并无明显的特征峰出现[21]。经LD-C作用后,钛铁矿的红外光谱在1 627 cm-1处出现-COO-特征峰,说明LD-C分子被吸附于钛铁矿表面。但由于LD-C吸附在钛铁矿表面后出现的新峰强度很弱,且未明显观测到其他新特征峰,说明LD-C在钛铁矿表面的化学吸附作用十分微弱。
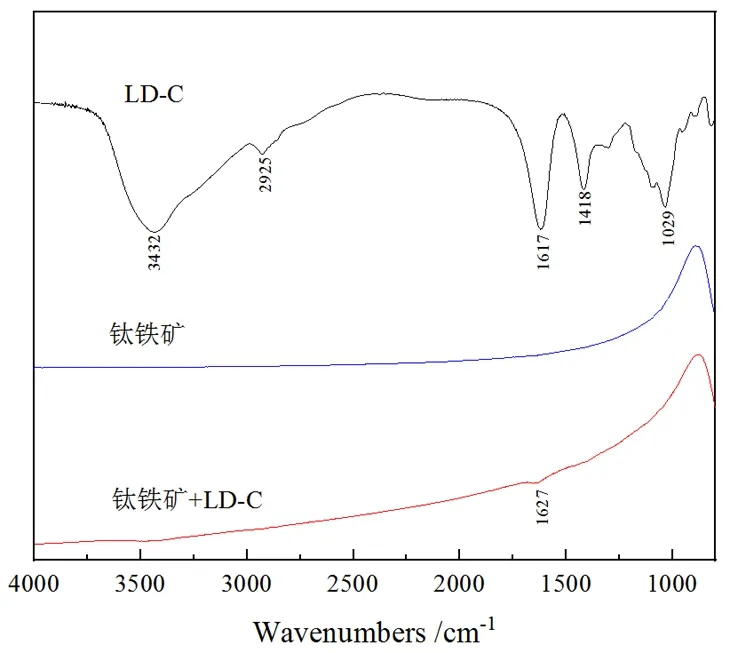
图10 LD-C与钛铁矿作用的红外光谱
2.5.2 LD-C与辉石作用的红外光谱分析
LD-C与辉石作用的红外光谱如图11所示,辉石的红外光谱中,波数为884 cm-1处是Mg-O的弯曲振动吸收峰,波数为1 065 cm-1处是Si-O的伸缩振动吸收峰[22],波数为3 447 cm-1处是-OH的伸缩振动吸收峰。在辉石与LD-C作用后的红外光谱图中可以观察到在波数为2 930 cm-1、2 856 cm-1、1 624 cm-1、1 403 cm-1处出现了新的吸收峰,在2 930 cm-1和2 856 cm-1处归因于羧酸中的-OH的伸缩振动。在波数为1 624 cm-1和1 403 cm-1处出现的新吸收峰分别对应于LD-C中-COO-的反对称伸缩振动与对称伸缩振动峰;以上结果说明LD-C与辉石发生了强烈的化学吸附,这与动电位分析结果一致。由辉石晶体结构得出,辉石中由硅氧四面体形成的单链间连接有大量的钙镁阳离子,连接形式为离子键。因此,辉石易在矿浆中溶解暴露出大量钙镁活性位点[13],使得LD-C基团中的-OH、-COO-与辉石表面发生作用,导致辉石被选择性抑制。
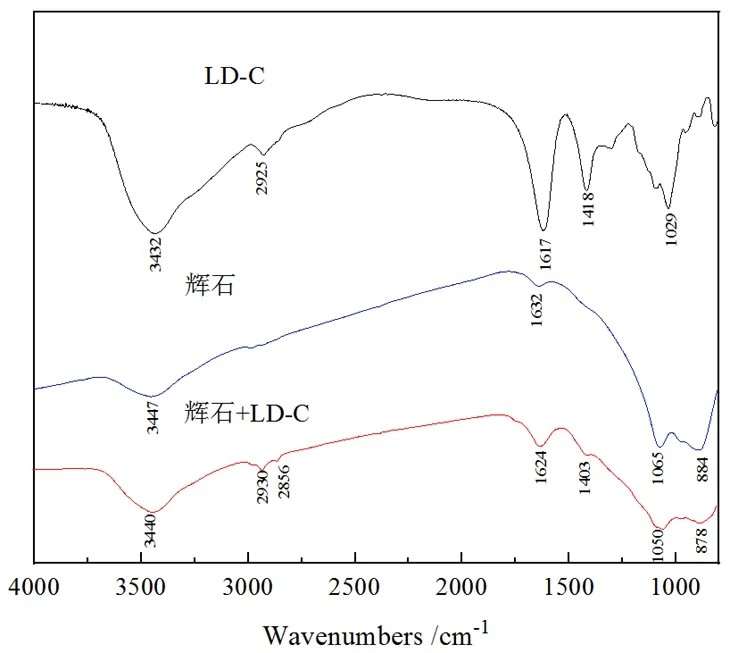
图11 LD-C与辉石作用的红外光谱
3 结论
(1)单矿物浮选试验结果表明,LD-C作为抑制剂对钛铁矿与辉石的分离效果最佳。在捕收剂MOH用量为160 mg/L、LD-C用量为2 mg/L的条件下,钛铁矿回收率为80%,辉石回收率为9%,表明LD-C是实现钛铁矿与辉石浮选分离的高效抑制剂。
(2)由钛铁矿浮选溶液化学结合Zeta电位测试结果分析可知,在pH为5~6时,钛铁矿和辉石与药剂作用效果最佳,此时钛铁矿表面主要药剂作用位点为亚铁离子及其羟基络合物,LD-C与钛铁矿表面的吸附形式可能以静电吸附为主,且捕收剂MOH可以与LD-C在钛铁矿表面发生共吸附。LD-C在辉石表面吸附形式可能主要为化学吸附,辉石在吸附LD-C后会阻碍捕收剂MOH的吸附。
(3)红外光谱分析研究发现,LD-C在钛铁矿表面发生微弱的化学吸附。LD-C中-OH、-COO-可与辉石表面暴露的钙镁位点发生作用,从而使得LD-C在辉石表面发生化学吸附,因此LD-C对辉石有明显的选择性抑制作用。
