心脏磁共振T1 mapping技术评估肥厚型心肌病心肌纤维化
2022-05-05李志明韩丹杞天付李丽莉邓洁高薇陈海燕陈伟
李志明,韩丹,杞天付,李丽莉,邓洁,高薇,陈海燕,陈伟
昆明医科大学第一附属医院医学影像科,云南 昆明 650032;*通信作者 陈伟 chenwin2008@163.com
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)表现为左心室肥厚,患病率约为2‰,是最常见的遗传性心肌病,属于常染色体显性遗传性疾病,由多个编码心肌肌节蛋白的基因突变引起,其潜在的特异性突变尚未确定[1]。HCM是年轻人猝死最常见的原因,常表现为呼吸困难、心律异常、舒张功能受限等,病情严重时可引起心力衰竭、猝死等[2]。HCM的主要病理学改变包括心肌细胞异常肥大、核大深染、心肌细胞排列紊乱和心肌间质不同程度纤维化[3]。纤维化的存在及程度与心律失常和心脏性猝死相关[2-3],近年,心脏磁共振(cardiac magnetic resonance,CMR)越来越多地应用于心肌病的诊断和鉴别诊断,可以“一站式”评价心脏的形态、结构、功能和组织特征。CMR延迟强化(late gadolinium enhancement,LGE)成像通过与正常心肌信号强度对比反映局部心肌纤维化,但无法有效识别弥漫性心肌纤维化[4-5]。CMR T1 mapping技术结合细胞外对比剂可以定量检测细胞外容积分数(extracellular volume fraction,ECV),ECV与病理学量化的胶原容积分数具有良好的相关性,可以定量评估弥漫性心肌纤维化[6]。本研究基于CMR T1 mapping技术定量评估HCM患者心肌纤维化,并与对照组比较,探讨HCM患者早期心肌组织特征改变,提供HCM早期诊断及预后评估等的新技术。
1 资料与方法
1.1 研究对象 回顾性分析2019年6月—2021年7月昆明医科大学第一附属医院收治的HCM 45例,纳入标准:CMR或超声心动图显示舒张末期左心室壁心肌厚度≥15 mm,或有HCM家族史的患者左心室壁心肌厚度≥13 mm;并排除其他可引起心肌肥厚的疾病,如高血压、主动脉狭窄、淀粉样变性等[7]。收集同期CMR检查结果正常的44例患者作为对照组,纳入标准:既往无心血管疾病史或心脏手术史;无高血压、糖尿病;心电图正常;无心肌LGE。收集两组患者一般临床资料,包括体重指数、体表面积、血压等。本研究通过医院伦理委员会批准[批准号:(2022)伦理L第8号],所有受试者均签署知情同意书。
1.2 仪器与方法 采用西门子1.5T MR仪,扫描前向患者讲解注意事项,并训练其憋气吸气过程,采用心电门控加18通道心脏线圈扫描。先进行心脏常规轴位、冠状位、矢状位扫描,再对标准两腔、四腔心、左心室短轴位层面扫描,短轴位扫描约6~8层。注射对比剂前,利用改良Look-Locke反转恢复序列在左心室短轴(心尖、中段、基底段)行增强前T1 mapping序列扫描,扫描模式为5(3)3,扫描参数:TR 3.4 ms,TE 1.3 ms,层厚8 mm,视野360 mm×270 mm,矩阵160×200,翻转角35°。经肘静脉注射对比剂钆酸胺,注射剂量0.2 mmol/kg,流速2 ml/s,13~15 min后,在左心室短轴相同层面采集增强后T1 mapping序列扫描,扫描参数与增强前保持一致。注射对比剂10 min后,行LGE序列扫描评估心肌局灶性纤维化,扫描参数:TE 1.55 ms,TR 700~1 000 ms,层厚8 mm,视野360 mm×300 mm,矩阵256×140。在CMR检查前抽取患者静脉血测量血细胞比容(hematocrit,HCT)。
1.3 CMR图像分析
1.3.1 心功能、结构分析测量 所有CMR图像传至Cvi42后处理软件分析。通过勾画左心室短轴位电影图像心肌的心内膜和心外膜边界(不包含乳头肌),计算左心室心功能参数,包括左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左心室收缩末期容积(left ventricular end-systolic volume,LVESV)、每搏输出量(stroke volume,SV)、左心室射血分数(left ventricular ejection fraction,LVEF)、心肌质量、左心室舒张末期容积指数(LVESVI)、左心室收缩末期容积指数(LVEDVI)、每搏输出量指数(SVI)、心肌质量指数(myocardial mass index,MMI)。测量最大室壁厚度、最大间隔壁厚度及有无延迟强化等。
1.3.2 心肌增强前T1值及ECV值测量与计算 根据美国心脏协会心肌17段分法[8],在后处理工作站上通过勾画感兴趣区,并避开血池及心内外膜,分别测量HCM组和对照组1~16段心肌增强前T1值及增强后T1值,并获得心肌整体增强前T1值及增强后T1值。结合受试者近期HCT,计算相应左心室心肌段及整体的ECV值[9]。
1.4 统计学方法 采用SPSS 22.0软件,所有数据的正态性采用Kolmogorov-Smirnov检验,正态分布的计量资料表示为±s,两连续性变量间的比较采用独立样本t检验。计数资料以例(%)表示,采用χ2检验或Fisher确切概率法比较。用受试者工作特征(ROC)曲线分析不同CMR参数对HCM的诊断效能。P<0.05表示差异有统计学意义。
2 结果
2.1 HCM组与对照组一般资料 HCM组中,男35例,女10例。对照组中,男27例,女17例。HCM组与对照组心率、体重指数、体表面积、收缩压、舒张压及HCT差异均无统计学意义(P均>0.05)。HCM组中根据左心室流出道梗阻与否分为梗阻型14例(31.11%),非梗阻型31例(68.88%),非梗阻型中包括8例心尖HCM。HCM组中伴有高血压、冠心病、糖尿病者分别有16例(35.55%)、5例(11.11%)、3例(6.66%)。
2.2 HCM组与对照组T1值、心功能及结构参数比较HCM组SV、LVSVI均高于对照组(P<0.05),LVEF高于对照组(P<0.001);HCM组心肌质量、MMI、最大室壁厚度及最大间隔壁厚度大于对照组(P<0.001);两组LVEDV、LVESV等差异无统计学意义(P>0.05),见表1。HCM组肥厚段心肌(213段)分布:间隔壁79段(37.08%),前壁39段(18.31%)、下壁31段(14.55%)、侧壁27段(12.67%)、心尖37段(17.37%)。HCM组中26例(57.77%)LGE阳性,19例(42.22%)LGE阴性。
表1 HCM组与对照组一般资料及左心室心功能和结构参数比较(±s)
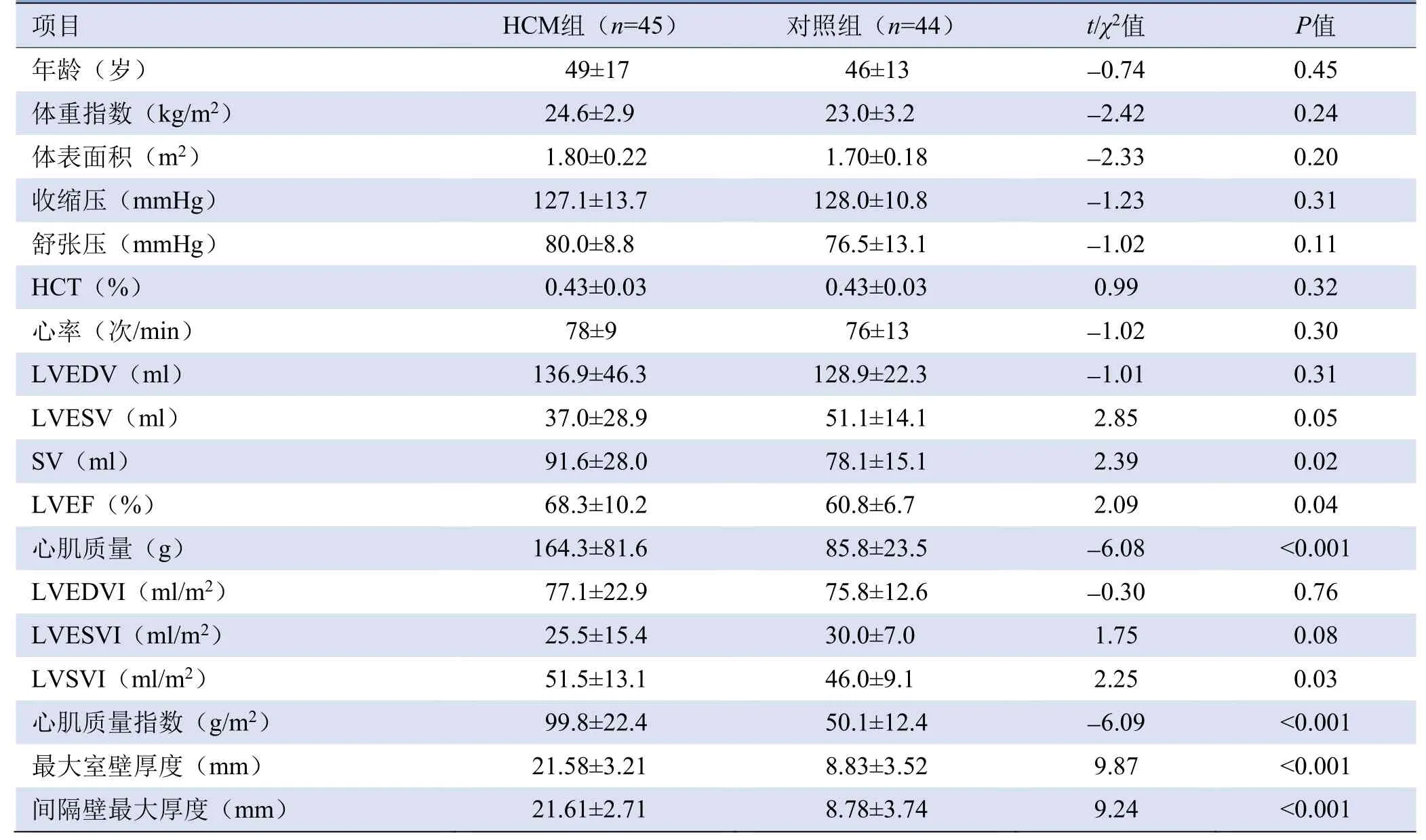
表1 HCM组与对照组一般资料及左心室心功能和结构参数比较(±s)
注:HCT为血细胞比容,LVEDV为左心室舒张末期容积,LVESV为左心室收缩末期容积,SV为每搏输出量,LVEF为左心室射血分数,LVESVI为左心室收缩末期容积指数,LVEDVI为左心室舒张末期容积指数,SVI为每搏出量指数
项目HCM组(n=45)对照组(n=44)t/χ2值P值年龄(岁) 49±17 46±13 -0.74 0.45体重指数(kg/m2)24.6±2.9 23.0±3.2-2.42 0.24体表面积(m2) 1.80±0.22 1.70±0.18 -2.33 0.20收缩压(mmHg)127.1±13.7 128.0±10.8-1.23 0.31舒张压(mmHg) 80.0±8.8 76.5±13.1 -1.02 0.11 HCT(%)0.43±0.03 0.43±0.03 0.99 0.32心率(次/min) 78±9 76±13 -1.02 0.30 LVEDV(ml)136.9±46.3 128.9±22.3-1.01 0.31 LVESV(ml) 37.0±28.9 51.1±14.1 2.85 0.05 SV(ml)91.6±28.0 78.1±15.1 2.39 0.02 LVEF(%) 68.3±10.2 60.8±6.7 2.09 0.04心肌质量(g)164.3±81.6 85.8±23.5-6.08 LVESVI(ml/m2)25.5±15.4 30.0±7.0 1.75 0.08 LVSVI(ml/m2) 51.5±13.1 46.0±9.1 2.25 0.03心肌质量指数(g/m2)99.8±22.4 50.1±12.4-6.09<0.001最大室壁厚度(mm) 21.58±3.21 8.83±3.52 9.87 <0.001间隔壁最大厚度(mm)21.61±2.71 8.78±3.74 9.24<0.001
2.3 HCM组与对照组T1值与ECV值比较 HCM组左心室整体增强前T1值和ECV均高于对照组(增强前T1值:t=2.83,P=0.035;ECV:t=2.63,P=0.019),整体心肌增强后T1值与对照组比较,差异无统计学意义(t=1.84,P=0.63)。HCM组中,肥厚段及非肥厚段心肌增强前T1值和ECV均高于对照组(增强前T1值:t=2.92,P=0.024;ECV:t=2.76,P=0.008);HCM组中肥厚段心肌增强前T1值和ECV均高于非肥厚段心肌(增强前T1值:t=2.74,P=0.041;ECV:t=2.54,P=0.033),见表2及图1。

图1 对照组、LGE阴性及LGE阳性HCM患者心肌LGE和T1 mapping图。A~D依次为28岁男性对照组LGE图(阴性)、增强前T1(998 ms)、增强后T1(458 ms)及ECV(22%)伪彩图;E~H依次为45岁女性HCM患者LGE图(阴性)、增强前T1(1 068 ms)、增强后T1(436 ms)及ECV(26%)伪彩图;I~L依次为46岁男性HCM患者LGE图(阳性)、增强前T1(1 148 ms)、增强后T1(336 ms)及ECV(36%)伪彩图,左心室基底段前间隔肥厚心肌中层斑片状延迟强化(箭),相应部位心肌增强前T1(1 293 ms)及ECV(46%)明显升高
表2 HCM组与对照组T1值、ECV值比较(±s)

表2 HCM组与对照组T1值、ECV值比较(±s)
注:HCM为肥厚型心肌病,ECV为细胞外容积分数;a与对照组比较,P<0.05;b与HCM组肥厚段比较,P<0.05
项目HCM组(n=45)对照组(n=44)总体肥厚段非肥厚心肌节段数 720 213 507 704增强前T1值(ms)1 075±67a 1 098±82a 1 067±41ab 1 035±27增强后T1值(ms) 454±61 440±57 435±54 455±61 ECV(%)31.1±5.2a 31.9±6.7a 26.5±6.1ab 23.7±5.1
2.4 HCM组LGE阳性及LGE阴性患者T1值与ECV值比较 HCM组LGE阳性患者左心室整体增强前T1值为(1 083±40)ms、ECV为(32.2±5.1)%,均高于LGE阴性患者的(1 056±43)ms、(28.3±4.8)%,差异有统计学意义(t=2.70,P=0.044);两者整体心肌增强后T1值分别为(438±51)ms、(447±68)ms,差异无统计学意义(t=1.62,P=0.56)。
LGE阳性患者肥厚段心肌154段(37.02%),非肥厚段心肌262段(62.98%);LGE阴性患者肥厚段心肌59段(19.41%),非肥厚段心肌245段(80.59%)。LGE阳性患者肥厚段及非肥厚段心肌增强前T1值和ECV均高于对照组(增强前T1值:t=3.14,P=0.037;ECV:t=2.27,P=0.021);LGE阳性患者肥厚段心肌ECV高于非肥厚段(t=2.95,P=0.024)。LGE阴性患者仅肥厚段心肌增强前T1值和ECV均高于对照组(增强前T1值:t=3.08,P=0.037;ECV:t=2.51,P=0.035);LGE阴性患者肥厚段心肌ECV高于非肥厚段(t=2.65,P=0.028),见表3。
表3 HCM患者LGE阳性及LGE阴性心肌肥厚段及非肥厚段T1值及ECV值比较(±s)
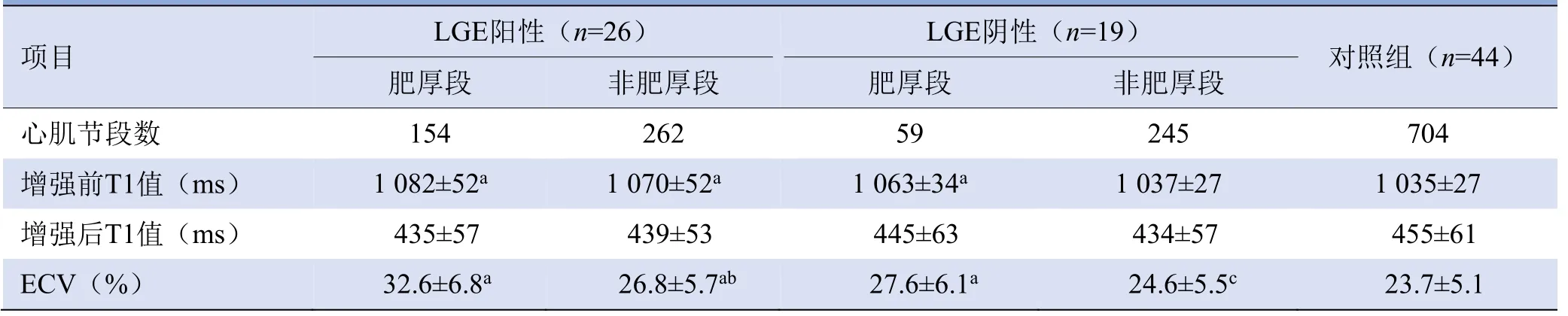
表3 HCM患者LGE阳性及LGE阴性心肌肥厚段及非肥厚段T1值及ECV值比较(±s)
注:HCM为肥厚型心肌病,LGE为延迟强化,ECV为细胞外容积分数;a与对照组比较,P<0.05;b与LGE阳性患者肥厚段比较,P<0.05;c与LGE阴性患者肥厚段比较,P<0.05
项目LGE阳性(n=26)LGE阴性(n=19)对照组(n=44)肥厚段非肥厚段肥厚段非肥厚段心肌节段数 154 262 59 245 704增强前T1值(ms)1 082±52a 1 070±52a 1 063±34a 1 037±27 1 035±27增强后T1值(ms) 435±57 439±53 445±63 434±57 455±61 ECV(%)32.6±6.8a 26.8±5.7ab 27.6±6.1a 24.6±5.5c 23.7±5.1
2.5 ROC曲线评估不同CMR参数对HCM的诊断效能 LGE、增强前T1值和ECV对鉴别HCM与对照组的ROC曲线下面积(AUC)分别为0.692、0.767、0.800,以上参数联合心肌质量后的AUC分别为0.845、0.877、0.879,其中ECV联合心肌质量诊断效能最佳,敏感度为73.52%,特异度为95.45%(图2)。

图2 不同CMR参数诊断HCM的ROC曲线
3 讨论
一项多中心研究显示,HCM引起的心脏不良事件(如死亡、心力衰竭、卒中、室性心律失常、心房颤动)的风险可能在具有致病性基因变异患者中更高,然而HCM相关基因变异复杂繁多,无法使用特定的基因型预测个体患者的预期结果[10]。作为多种心脏病的共同病理特征,心肌纤维化与疾病的临床病程和预后相关[11-12]。心肌纤维化是HCM不良结局的独立危险因素,HCM患者常伴有收缩功能障碍和非持续性室性心动过速,甚至心脏性猝死,而纤维化的严重程度也是主要心律失常事件的预测因素[12-14]。传统的LGE技术能成功识别缺血性心脏病的心肌纤维化。然而,对于非缺血性心肌疾病引起的纤维化,尤其是弥漫性心肌纤维化,传统的LGE并非可靠的成像工具[15]。CMR T1 mapping 技术可以反映心肌各像素的T1值,从而对心肌进行定量分析,主要包括增强前T1 mapping及增强后T1 mapping[16]。尽管不同扫描仪的增强前T1值存在差异,但多项研究均表明在脂肪浸润和铁过载等疾病中增强前T1值降低,而纤维化、水肿、淀粉样变则使增强前T1值增高[15,17]。HCT联合T1 mapping对比增强前后心肌、血池T1值可计算心肌ECV,从而反映心肌细胞外基质扩张情况,并定量评估心肌间质弥漫性纤维化程度[9]。既往研究认为ECV与病理心肌纤维化定量指标胶原容积分数具有强相关性,作为无创评估量化心肌纤维化的生物学指标已得到广泛认定[16]。
3.1 T1 mapping评估HCM患者心肌纤维化 本研究发现,HCM患者左心室心肌增强前T1值及ECV明显高于对照组,提示HCM患者存在心肌纤维化(包括弥漫性纤维化)。另外,本研究分别测量并计算HCM患者肥厚段及非肥厚段心肌增强前T1值及ECV,结果显示肥厚段心肌纤维化程度较非肥厚段显著,而与对照组比较,非肥厚段也存在一定程度的心肌纤维化,与既往研究结果一致[18-19]。Thongsongsang等[19]通过分析1 188例患者的CMR结果显示,118例HCM患者中段间隔壁心肌增强前T1和ECV明显高于对照组,提示HCM患者心肌纤维化。一项对HCM患者心脏性猝死风险研究显示,增强前T1值与HCM患者主要不良心血管事件独立相关,提示增强前T1可以作为HCM患者主要不良心血管事件的有效预测因子[20]。
HCM动物模型的病理机制研究发现,参与细胞外基质合成的基因在早期显著上调[21],该基因通路在左心室肥厚或心肌纤维化发生前被激活,使细胞外基质增加成为HCM的最早改变。近期研究也表明,尚未出现左心室肥厚及LGE时,肌节突变携带者的心肌I型胶原合成显著增加[14,22],因而HCM最早发生的病理改变为细胞外基质增加。尽管LGE和T1 mapping均可以评估心肌纤维化,但T1 mapping技术的敏感度更高,且可以对纤维化进行定量评估。本研究结果显示,LGE阳性患者增强前T1值及ECV均大于LGE阴性患者;与对照组比较,LGE阴性患者心肌同样存在弥漫性纤维化,证实T1 mapping较常规LGE技术可以更早地检测和评估HCM患者心肌细胞外基质弥漫性扩张。以上结果与以往研究[23-25]相符。Wu等[26]对38例HCM患者的CMR进行研究,结果显示LGE阳性与LGE阴性患者增强前T1与ECV均高于对照组,且LGE阳性组ECV高于LGE阴性组,两组增强前T1无差异,提示与LGE相比,T1 mapping可以早期评估心肌纤维化。然而,既往部分研究未区分两组患者肥厚与非肥厚心肌节段。本研究根据两组患者心肌肥厚与否进一步分组,结果显示LGE阳性患者无论心肌肥厚与否,均出现不同程度的心肌纤维化(增强前T1和ECV升高);LGE阴性患者仅肥厚段心肌存在心肌纤维化,提示基于T1 mapping技术可以早期发现LGE阴性的HCM患者肥厚段心肌纤维化。本研究中LGE阴性患者非肥厚段心肌增强前T1值与ECV并无明显升高,可能与纳入LGE患者非肥厚节段数目相关,也提示尚未出现LGE的早期HCM患者非肥厚段心肌无明显弥漫性纤维化,该结果需要进一步扩大样本量进行验证。
3.2 CMR参数诊断HCM的效能 ROC曲线结果显示,基于CMR T1 mapping的增强前T1及ECV的AUC大于LGE,能有效诊断HCM,且ECV联合心肌质量后可以进一步提高诊断效能,其原因为增强前T1和ECV可以早期反映心肌细胞外胶原沉积,细胞外基质扩张,从而早期发现HCM患者心肌弥漫性纤维化[9]。另外,ECV的AUC大于增强前T1,其原因可能是增强前T1常受到设备场强和扫描参数的影响;并且增强前T1反映了心肌细胞和细胞外容积共同的T1弛豫时间,存在所测量增强前T1假阴性的可能:而心肌ECV是由T1弛豫时间衍生的生理学参数,与心肌细胞胶原容积分数有很好的一致性[27-28]。
3.3 本研究的局限性 首先,本研究纳入样本量有限,后续研究需继续增加样本、完善研究结果;其次,本研究未进一步研究CMR T1 mapping参数与临床不良事件的相关性,这些将是下一步研究的重点。
总之,基于CMR T1 mapping技术可以定量评估HCM患者的心肌纤维化。HCM患者心肌增强前T1和ECV升高,提示心肌纤维化,且肥厚段较非肥厚段心肌纤维化明显。此外,T1 mapping可以早于LGE发现HCM患者心肌纤维化,其中以ECV诊断效能较高,并且ECV联合心肌质量可以进一步提高HCM的诊断率。
