磷高效转基因水稻OsPT4根际高效解有机磷细菌的分离鉴定
2022-05-05张乐张思宇王亚露李刚杨殿林赵建宁
张乐,张思宇,王亚露,李刚,杨殿林,赵建宁 *
(1.农业农村部环境保护科研监测所,天津 300191;2.农业农村部产地环境污染防控重点实验室/天津市农业环境与农产品安全重点实验室,天津 300191)
磷是地球生命系统的主要营养元素之一,也是生态系统常见的营养限制因子。磷素是植物必需的大量无机营养元素,在植物体内的含量通常仅次于氮和钾,对于植物生长代谢有非常重要的作用。但是世界上绝大部分农田土壤严重缺乏作物可利用的有效态磷。据报道全世界13.19 亿hm的耕地中约有43%缺磷,我国1.07 亿hm农田中大约有2/3 严重缺磷。然而土壤总磷资源丰富,但其主要以无法直接被作物吸收利用的不溶态和难溶态形式存在,可供植株吸收利用的可溶性无机态磷酸盐含量严重缺少,因此提高作物对农田土壤中磷素的高效利用有重要的研究意义和价值。
为了解决大面积农田土壤有效磷缺失的现状,基于土壤中磷素的分布情况,当前主要从3个方面提高作物对农田土壤磷素的利用效率:第一个方面是施加磷肥,补充农田土壤中的磷素;第二方面是利用解磷微生物生产解磷菌剂,解磷微生物的发现为解磷肥料的生产奠定了基础;第三方面是培育磷高效作物品种,通过一些传统杂交育种手段及现代生物技术手段培育出对土壤磷素有更高吸收利用效率的品种。虽然施加磷肥在一定程度上缓解了大面积农田土壤有效磷缺失的现状,但是研究表明磷肥在施用农田后大部分会转化成溶解度较低的钙化态磷和闭蓄态磷,同时由于磷在土壤中的扩散系数很低且受土壤对磷的吸附和固化作用等因素的影响,土壤中的有效态磷含量依然很低,可供作物直接吸收利用的磷素十分有限,磷素水平依旧制约着农业生产。而且由于磷肥的消耗,可供生产的磷矿资源日益紧张。在未来的研究工作中,从提高土壤磷素的吸收效率出发,生产优质解磷菌剂和培育磷高效作物品种将更加具有现实意义。
土壤微生物是土壤中数量最大、种类最丰富的生物类群,在土壤养分转化和结构形成中发挥着重要的作用,其中有一类可以将植物无法吸收的有机磷转化为可吸收无机磷形态的功能微生物类群被称为解磷菌(Phosphate-solubilizing microorganisms,PSM)。解磷菌不仅种类繁多,而且在自然界中数量也十分庞大,是一项非常值得开发研究的资源。1903 年STALSTROM 发现土壤中存在的某些微生物具有解磷作用,目前已发现在自然界中存在着大量具有解磷作用的微生物,包括细菌、真菌、放线菌及蓝藻。世界上应用最早且最广的具有解磷作用的微生物是巨大芽孢杆菌,在后续的研究中,各类芽孢杆菌、假单胞菌和一些杆菌及部分真菌也被开发利用为菌剂菌肥,这些微生物在生物肥料的生产中得到了广泛的应用。
磷高效转基因水稻品种OsPT4,是利用生物技术手段将水稻高亲和磷酸盐转运蛋白基因导入受体而获得的磷高效吸收型水稻,由南京农业大学资源与环境学院培育。OsPT4通过编码磷高效转运蛋白编码基因合成磷高效转运蛋白,从而提高了其对土壤中有效磷的吸收消耗速率。在此基础上开发解磷菌剂增加土壤有机磷水解是否可以进一步提升其磷素利用效率?为此本研究以磷高效转基因水稻OsPT4为试验材料,利用改良的蒙金娜有机磷选择培养基分离OsPT4根际土壤中的高效解有机磷菌株,初步探究其解磷能力和溶磷特性,并通过与传统大田作物中分离获得的解磷菌资源进行比较判断,以其应用可行性和价值。
1 材料与方法
1.1 试验材料
1.1.1 样品采集
从2014 年开始在农业农村部环境保护科研监测所内的网室中进行磷高效转基因水稻OsPT4 连续种植实验,目前已连续种植7 年。土壤样品为2020 年9月采集的磷高效转基因水稻OsPT4根际土壤,使用直径3.5 cm 的土钻在距水稻主茎2 cm 处采集0~20 cm深的土壤。
1.1.2 培养基
改良的蒙金娜有机磷固体培养基:葡萄糖10 g,(NH)SO0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO·7HO 0.3 g,FeSO·7HO 0.03 g,MnSO·4HO 0.03 g,卵磷脂0.2 g,CaCO5.0 g,酵母膏 0.4 g,琼脂 20 g,ddHO 1 000 mL,pH为7.0~7.5(液体培养基不加琼脂)。
LB 培养基:胰蛋白胨 1 g,酵母 0.5 g,NaCl 1 g,ddHO 100 mL。
1.2 试验方法
1.2.1 解有机磷菌株的分离纯化
称取1.0 g根际土壤样品,加入9 mL无菌水,涡旋混匀30 s,静置10 min。吸取1 mL 土壤悬液,加入49 mL 配制好的蒙金娜有机磷液体培养基,30 ℃、160 r·min振荡培养24 h。吸取1 mL 培养好的菌液按照10~10进行连续10倍梯度稀释,分别涂布在蒙金娜有机磷固体培养基上,每个梯度设置3 个平行。在30 ℃恒温培养箱中培养5 d,确定10为最佳稀释倍数。按照上述方法和最佳稀释倍数将土壤样品进行解有机磷菌株的分离,挑取产生溶磷圈的单菌落进行划线纯化3~5 代获得纯菌株,将纯菌株在LB 培养基中扩增培养后使用甘油法保存。
1.2.2 解有机磷菌株的菌落特征观察和可溶性指数的测定
将分离得到的纯菌株点接到蒙金娜固体有机磷培养基上,30 ℃恒温培养3 d,观察菌落形态特征,参照《常见细菌系统鉴定手册》对菌株进行初步鉴定。分别测定菌落直径和溶磷圈直径以计算可溶性指数,初步判断解有机磷菌株的解磷能力。计算公式为:
可溶性指数=溶磷圈直径/菌落直径
1.2.3 解有机磷菌株24 h解磷量和溶磷特性的测定
挑选产生明显溶磷圈的解磷菌株进行解磷量、pH 和碱性磷酸酶的测定。将各菌株分别接种于LB液体培养基,37 ℃、180 r·min培养7 h,然后用分光光度计调整菌液浓度至OD=0.6。分别吸取750µL菌悬液加入到15 mL 蒙金娜液体培养基中,37 ℃、180 r·min振荡培养24 h(每个菌株3 组重复),取10 mL 培养液用酸度计测定pH,剩余培养液4 ℃、12 000 r·min离心 5 min 获得上清液。取 2 mL 上清液用钼锑抗显色法测定有效磷含量。另取0.5 mL 上清液用碱性磷酸酶活性检测试剂盒(BOXBIO)测定碱性磷酸酶活性。
1.2.4 解有机磷菌株生长曲线的测定
将解有机磷菌株分别接种到LB 液体培养基,37 ℃、180 r·min培养7 h,然后使用分光光度计调整菌液浓度至OD=0.1 用于接种。在100 mL LB 液体培养基中接种 5 mL OD=0.1 的菌液,30 ℃、180 r·min恒温振荡培养30 h,每隔2 h监测一次OD值并记录,观测菌株的生长状况并绘制生长曲线。
1.2.5 菌株的鉴定及其同源性分析
将纯化的单菌落挑入10 mL LB 液体培养基中,摇床培养至菌液浑浊后,吸取菌液2 mL进行DNA的提取。采用16S rDNA 通用引物27F 和1492R 进行16S rDNA基因序列的扩增,PCR产物使用1%的琼脂糖凝胶电泳进行质量检测后,送上海生工进行测序。
1.3 数据处理
试验数据使用Excel 进行初步整理后,用SPSS 软件(21.0版本)进行数据分析。对可溶性指数、24 h 菌株的解磷量、pH、碱性磷酸酶活性进行单因素方差分析和LSD 多重比较(<0.05 表示差异显著)。使用Origin 软件(2018 版本)绘制菌株24 h 解磷量、pH 和碱性磷酸酶图,并拟合6 株菌株的生长曲线。菌株鉴定测序结果通过Blast 程序与NCBI 数据库进行比对,下载同源性高的序列使用MEGA 软件(7.0 版本)构建系统发育进化树。
2 结果与分析
2.1 解有机磷菌株的筛选纯化
采用传统微生物分离培养方法,使用蒙金娜固体有机磷培养基对磷高效转基因水稻OsPT4 根际土壤中的解有机磷菌株进行分离,共获得15 株解有机磷菌株(图1a),分别命名为Y1~Y15。经过纯化培养3代后获得6 株解磷能力较强且生长稳定的菌株(图1b),分别是Y1、Y4、Y6、Y7、Y11、Y13,对其进行进一步解磷能力和溶磷特性的研究。
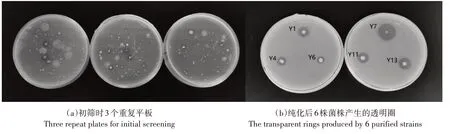
图1 解有机磷菌株的筛选Figure 1 Screening picture of solution organophosphorus hydrolyzing strains
2.2 菌株的菌落特征观察
从菌落的形状、大小、颜色等方面观察6 株解有机磷菌株单菌落的形态特征并记录,初步判断6 株菌株均为革兰氏阴性细菌(表1)。

表1 6株解有机磷菌株菌落形态特征Table 1 Colony morphological characteristics of 6 strains of organophosphorus hydrolyzing bacteria
2.3 解有机磷菌株的解磷能力
可溶性指数和24 h 解磷量常作为表征菌株解磷能力的指标。可溶性指数结果显示:6 株解有机磷菌株的解磷能力之间存在一定差异,可溶性指数由大到小排序为Y7>Y11>Y1>Y13>Y4>Y6,Y7 菌株的可溶性指数最高为6.33,其次的Y11 为3.81(表2)。另外,对6 株解有机磷菌株的解磷能力进行定量分析,结果表明Y7 培养24 h 后的菌液中的无机磷浓度达到87.43 mg·L(图2),显著高于其他5个菌株。

图2 6株解有机磷菌株培养24 h的解磷量Figure 2 Phosphorus solubility of the 6 organophosphorus hydrolyzing strains

表2 6株解有机磷菌株的可溶性指数Table 2 Disolving phosphate zone diameter to culture community zone diameter of organophosphorus hydrolyzing bacteria
2.4 解有机磷菌株的溶磷特性
酸化作用和碱性磷酸酶作用是解磷菌溶磷的主要机制。各菌液在培养24 h 后pH 均有所降低,表现为酸性,Y7 菌株的pH 下降最显著,为3.42,各菌株培养24 h 后菌液pH 由大到小的排序为Y11>Y6>Y1>Y13>Y4>Y7(图3a)。培养24 h 菌液中的碱性磷酸酶活性结果显示(图3b):6 株解有机磷菌株之间分泌碱性磷酸酶的能力存在一定的差异,Y11菌株分泌碱性磷酸酶的能力最强,为38.69 µg·mL·h,其次是Y7菌株,为36.20 µg·mL·h,碱性磷酸酶活性由大到小排序为Y11>Y7>Y4>Y13>Y6>Y1。

图3 6株解有机磷菌株培养24 h后菌液的pH和碱性磷酸酶活性Figure 3 The pH and alkaline phosphatase activity of the 6 organophosphorus hydrolyzing strains
2.5 解有机磷菌株的生长曲线
各菌株生长曲线均可分为3 个时期,即指数生长期、平稳增长期和缓慢衰落期。在培养的前8 h中,菌落环境和营养条件适宜,菌株以指数倍数快速增长,在8~26 h 内以平稳速度缓慢增长,在第26 h 达到顶峰,随后受营养条件的限制速度开始缓慢下降。其中Y1 和 Y4 增长稍缓慢,Y6、Y7、Y11 和 Y13 增长速度基本一致(图4)。

图4 6株解有机磷菌株的生长曲线Figure 4 Growth curve of 6 organophosphorus hydrolyzing strains
2.6 解有机磷菌株的鉴定
经16S rDNA扩增子基因序列测序分析(图5),结果发现:6 株菌株属于不动杆菌属()、假单胞菌属()、肠杆菌属()和泛菌属()4 个菌属。Y6 与 Y13 的亲缘关系较近,同属肠杆菌属;Y4 和Y11 的亲缘关系较近,同属假单胞菌属。

图5 6株解有机磷菌株的系统发育进化树Figure 5 Phylogenetic tree of established based on 16S rDNA sequences of 6 organophosphorus hydrolyzing strains
3 讨论
解磷微生物在土壤磷素循环中具有重要作用,解磷微生物的分布具有明显的根际效应,且受到土壤类型、环境因子和种植作物类型等多因素的影响。本研究从OsPT4根际土壤中共分离获得15株解有机磷菌株,在后续分离纯化过程中仅6株能在有机磷培养基上稳定生长且形成明显的透明圈。有研究发现,约60%初筛得到的有解磷能力的菌株在后续纯化培养过程中失去解磷能力,其原因可能是不同菌株对环境的适应性和对磷素的要求有一定差异。此外,6株菌株的生长特性和活性基本保持一致,生长曲线均符合微生物培养特点,即在有限资源的条件下培养阶段分为指数生长期、平稳增长期和缓慢衰落期3个阶段。
解磷能力是筛选解磷菌资源的基本标准。聂振等从我国南方水稻根际土中分离的24 株解磷菌株的发酵液的可溶性总磷含量为23.7~79.3µg·mL,张广志等从设施菜地土壤中分离获得的14 株解磷菌株的平均解磷量为48.7 mg·L,庄馥璐等从苹果根际分离获得的10株解磷菌株的可溶性指数在1.5~5.3之间,解磷量最高为104.125 mg·L。本研究OsPT4根际土中分离获得的6 株解磷菌的可溶性指数为1.50~6.33,培养24 h 后培养液中的有效磷含量为10.60~87.43 mg·L,解磷能力与上述研究中筛选得到的菌株相当,其中Y7 菌株在可溶性指数和解磷量上均表现最好,解磷能力在上述解磷菌株中也属于较高水平,为高效解磷菌资源。
不同菌株在不同培养条件下的解磷能力有差异,菌株之间的溶磷特性也不完全相同。目前,相关研究发现解磷菌解磷主要有两大机制:一是部分微生物可以分泌出有机酸、硫化物、H等酸性物质降低生长环境的pH,从而使难溶性磷酸盐溶解;二是在受到磷限制时,一些微生物可以分泌释放胞外磷酸酶水解有机磷。通过测定培养24 h 后菌液的pH 和碱性磷酸酶活性分析菌株的解磷特性发现,Y7 菌株的解磷机制主要为酸化作用和碱性磷酸酶作用,而Y11菌株解磷的主要机制是碱性磷酸酶作用,其他菌株在分泌碱性磷酸酶活性方面差异不显著,pH 降低量与解磷能力有一定的相关性。
从大田作物中筛选获得的常见解磷微生物种类主要有芽孢杆菌、不动杆菌、假单胞菌、埃希氏菌、欧文氏菌、沙雷氏菌和肠杆菌等菌属。从OsPT4根际土中筛选获得的6株高效解有机磷菌株在分类上,Y1属于不动杆菌属,Y6和Y13属于肠杆菌属,Y4和Y11为假单胞菌属,5 株菌株均为常见的解磷菌类别。特殊的是解有机磷能力最强的Y7菌株属于泛菌属,虽然目前从水稻土壤中分离获得高效解磷泛菌菌株的研究较少,但相关研究表明泛菌在自然界中分布广泛,可以从水中和土壤中分离获得,且在研究中其常作为水稻、大麦、萝卜等大田作物的种子内生菌核心类群,多个类型的泛菌都具有解磷能力和分泌IAA的能力,对植物具有促生作用和抵抗真菌性病害的功能。
4 结论
从磷高效转基因水稻根际土壤中分离获得15 株解有机磷菌株,纯化复筛后获得6 株可以在有机磷培养基上产生明显透明圈的解有机磷菌株。6 株菌株在解磷能力上与大田作物中分离获得的解磷菌解磷能力相当,其中Y7 菌株表现最好,可溶性指数高达6.33,在 24 h 内的解磷量达到87.43 mg·L,为高效解磷菌资源。除菌株Y7 外的5 株菌株均为大田土壤中可分离获得的常见解磷菌类别,Y7 属于水稻种子内生菌核心类群泛菌属(),酸化作用和碱性磷酸酶作用是其主要的解磷机制。另外,磷高效转基因水稻的种植对有效磷消耗效率的影响是否改变了根系土壤中的解磷菌群落结构,使泛菌等类群菌株的相对丰度增加则需要基于现代分子生物学方法对解磷微生物整体群落进行进一步研究。
