基于网络药理学探讨龙芩定眩颗粒治疗眩晕的作用机制
2022-05-05董晗硕高翔宇刘寅潘韦韦孙莉
董晗硕 高翔宇 刘寅 潘韦韦 孙莉




[摘要]目的運用网络药理学分析龙苓定眩颗粒治疗眩晕的具体作用机制。方法应用TCMSP数据库、PubChem及Swiss Target Prediction数据库筛选龙苓定眩颗粒有效活性成分及对应靶点。应用TTD、DrugBank数据库筛选眩晕疾病靶点,取成分与疾病靶点交集进行可视化处理及拓扑参数分析,应用STRING 数据库进行蛋白相互作用分析,DAVID数据库进行GO及KEGG pathway富集分析。结果获得龙芩定眩颗粒活性成分65个,625个靶点,眩晕181个疾病靶点,两者共同靶点30个,通过GO富集分析,获得生物学过程(BP)69个,细胞组分(CC)9个,分子功能(MF)21个,其中BP主要涉及药物反应、药物代谢过程、单萜代谢过程,CC主要涉及质膜的组成部分、质膜、细胞器膜,MF咖啡因氧化酶活性、酶结合、组胺受体活性等。通过KEGG富集分析富集到14条通路,主要涉及神经活性配体-受体相互作用、化学致癌作用、钙信号通路等。结论龙芩定眩颗粒可通过多途径、多靶点治疗眩晕。
[关键词]网络药理学;龙苓定眩颗粒;眩晕;作用机制
[中图分类号]R285 [文献标识码]A [文章编号]2095-0616(2022)05-0014-05
Discussion on the mechanism of Longqin Dingxuan Granules in treating vertigo based on network pharmacology
DONG Hanshuo1 GAO Xiangyu2 LIU Yin1 PAN Weiwei3 SUN Li1
l.Department of Geriatrics,Jilin Academy of Chinese Medicine Sciences,Jilin,Changchun 130021,China;2.Directly Cadres Health Care Office of Jilin Province,Jilin,Changchun 130051,China;3.Changchun Medical Collage,Jilin,Changchun 130031,China
[Abstract] Objective Network pharmacology was used to analyze the specific mechanism of Longqin Dingxuan Granules in treating vertigo. Methods Application TCMSP database,PubChem and Swiss Target Prediction database screening effective active ingredient and the corresponding targets of Longqin Dingxuan Granules. Apply TTD and DrugBank database screening targets of vertigo disease,take the intersection of components and disease targets for visualization and analysis of topological parameters,use STRING database for protein interaction analysis,and DAVID database for GO and KEGG pathway enrichment analysis. Results Get Longqin Dingxuan Granules 65 active ingredient,625 target,181 Vertigo diseases targets,30 common targets,through the analysis of the enrichment of the GO for 69 biological processes (BP),9 cell components (CC),21molecular function (MF). BP is mainly involved in drug reaction,drug metabolism process and monoterpene metabolism process,CC is mainly involved in plasma membrane components,plasma membrane,organelle membrane,MF caffeine oxidase activity,enzyme binding,histamine receptor activity,etc. Enrichment 14 pathway through KEGG,mainly related to neural activity ligand receptor interaction,chemical carcinogen,calcium signaling pathways,etc. Conclusion Longqin Dingxuan Granules can treat vertigo through multiple ways and multiple targets.
[Key words] Network pharmacology;Longqin Dingxuan Granules;Vertigo;Mechanism
头晕和眩晕是临床最常见的症候临床症状,是门、急诊就诊患者描述最多的临床症状之一[1]。有调查显示,眩晕的患病率达20%~30%,年患病率5%,年复发率1.4%[2]。国外流行病学调查显示,35%的患者头晕每天发作,51%的患者每月均有发作,患病年龄以45~64岁为主[1-2]。有80%的前庭性眩晕患者会就医,复发率可达88%,同时还可引起心理疾患[3],严重者累及身心健康。可见该疾病的发病率及复发率较高,甚至影响人们日常工作和生活质量,已引起临床的重视。
中医对眩晕的研究历史悠久,有“諸风掉眩,皆属于肝”“无风不作眩”“无虚不作眩”“髓海不足,则脑转耳鸣,胫酸眩冒”等诸家学说。孙莉教授带领的团队根据多年临床经验提出了眩晕病“病位在心脑”的新理论,即神明其源在心脑,藏于脑而用于心,脑为神明之体,心主神明。急性期治疗以泻火平肝、安神定眩为主,拟龙芩定眩颗粒方,其加减方作为院内制剂广泛应用于临床中,治疗眩晕(前庭性偏头痛),临床疗效显著,可以预防和延缓眩晕的发作频率,进而减轻眩晕发作程度。龙芩定眩颗粒由龙胆草、黄苓、车前子、山栀子、瞿麦、柴胡、当归、生地黄、茯神、水牛角组成,泻火的同时兼有安神功效,降中寓升,祛邪而不伤正,泻火而不伐胃,使火降热清,神明得安,眩晕诸症皆可相应而愈,但其具体作用机制尚不明确。本研究采用网络药理学方法探讨龙苓定眩颗粒治疗眩晕的具体分子机制,为其临床应用提供客观依据。
1 材料与方法
1.1 中药活性成分及对应靶点筛选
中药系统药理学数据库与分析平台TCMSP数据库(https://tcmspw.com/tcmsp.php)输入龙胆、茯 苓、黄苓、栀子、瞿麦、车前子、熟地黄、当归、柴胡,筛选龙苓定眩颗粒活性成分,ADME参数筛选条件:口服生物利用度(oral bioavailability,OB)≥30%,类药性(drug-likeness,DL)≥0.18,筛选龙芩定眩颗粒有效化合物活性成分,将筛选出来的有效活性成分在Pubchem数据库中查询相应的SMILE结构(https://pubchem.ncbi.nlm.nih.gov/),再通过 Swiss Target Prediction 数据库(http://www.swisstargetprediction.ch/)预测候选成分对应的靶点。
1.2 眩晕疾病靶点筛选
应用DisGeNET数据库(http://www.disgenet.org/web/DisGeNET/menu/home)、TTD数据库(http:// db.idrblab.net/ttd/)、DrugBank 数据库(https://go.drugbank.com/)筛选眩晕对应靶标,输入“Migrainous Vertigo”“Vertigo”,筛选疾病靶点。
1.3 中药成分—疾病靶点网络构建
将筛选出的龙苓定眩颗粒成分靶点与眩晕靶点输入Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/index.html)绘制韦恩图,将疾病与药物共同作用靶点导入String数据库(https://string-db.org/),构建成分疾病共同靶点的PPI网络,同时运用Cytoscape 3.2.1软件进行成分-网络结构可视化处理及拓扑结构分析。
1.4 靶点生物功能注释及通路分析
应用DAVID 数据库(https://david.ncifcrf.gov/)对筛选出的两者共同靶点进行GO富集分析,包括生物学过程(biological process,BP)、细胞组成(cellular component,CC)、分子功能(molecular function,MF),及KEGG 通路富集分析,P<0.05 作为靶点的筛选标准。通过分析富集分析的功能条目,考察龙苓定眩颗粒治疗眩晕可能干预的生物学功能及通路,并运用Omicshare数据库(https://www. omicshare.com/tools/)工具进行气泡图绘制。
2 结果
2.1 龙苓定眩颗粒主要活性成分及靶点筛选
TCMSP数据库中,龙苓定眩颗粒中筛选后去掉未查询到靶点化合物,共得到活性成分65个,去掉重复靶点,共筛选得到625个作用靶点。见表1。
2.2 眩晕的靶点筛选
通过DisGeNET数据库、TTD数据库及DrugBank 数据库,共筛选出靶点181个。
2.3 龙苓定眩颗粒及眩晕共同靶点及PPI网络构建
将中药成分靶点与疾病靶点输入Venny 2.1.0绘制韦恩图,取得两者共同靶点30个,见图1。将共同靶点导入String数据库构建共同靶点的蛋白相互作用网络,获得节点数30、边数86,平均节点度为5.73,平均局部聚类系数为0.505,PPI富集P<1.0e。
2.4 龙苓定眩颗粒成分-靶点相互作用网络构建
运用Cytoscape 3.2.1软件对龙苓定眩颗粒与眩晕的共同成分靶点进行网络结构可视化处理,见图2。进行拓扑结构分析,主要核心靶点(Degree 值前10):ACHE、ABCB1、MAOA、SHBG、OPRM1、CYP1A1、PGR、CYP1A2、CALM1、GRM5。主要核心活性成分:欧前胡素(Ammidin)、粗毛豚草素(Dinatin)、川白芷内酯[(+)-Anomalin]、刺槐素(acacetin)、甘露糖醇(Cerevisterol)、鼠尾草素(Salvigenin)等。
2.5 龙苓定眩颗粒-眩晕共同靶点GO及KEGG通路富集分析
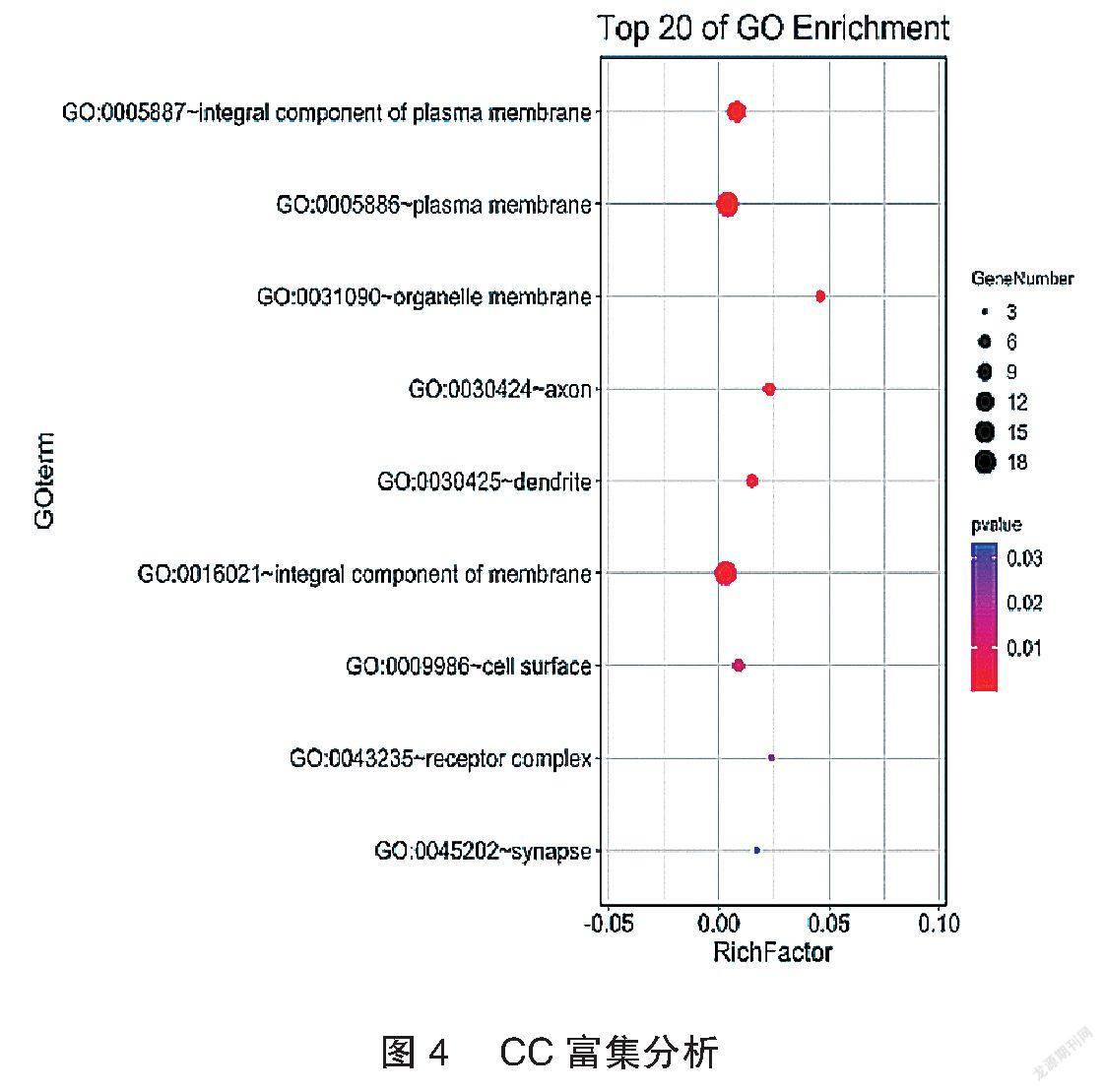
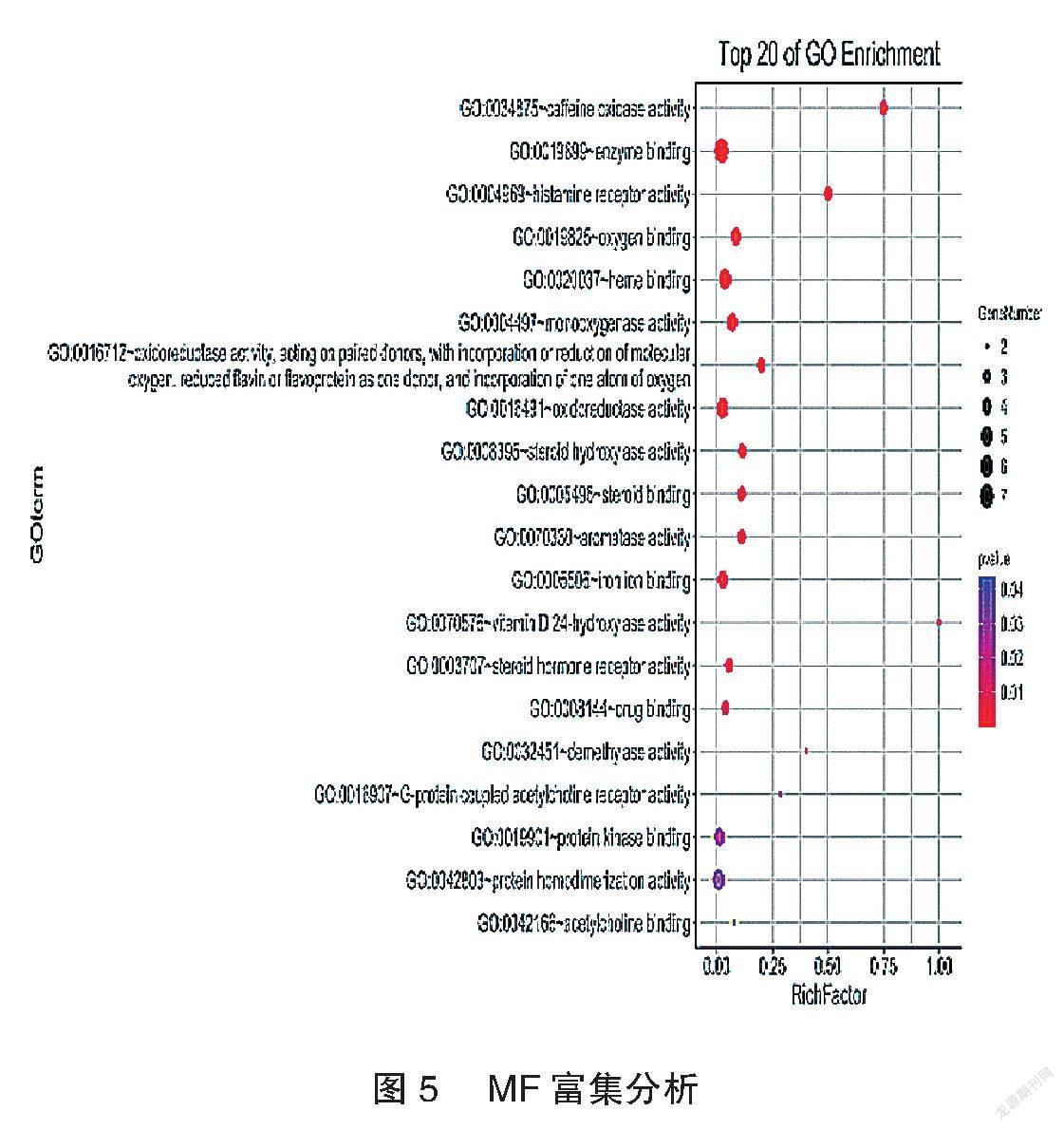
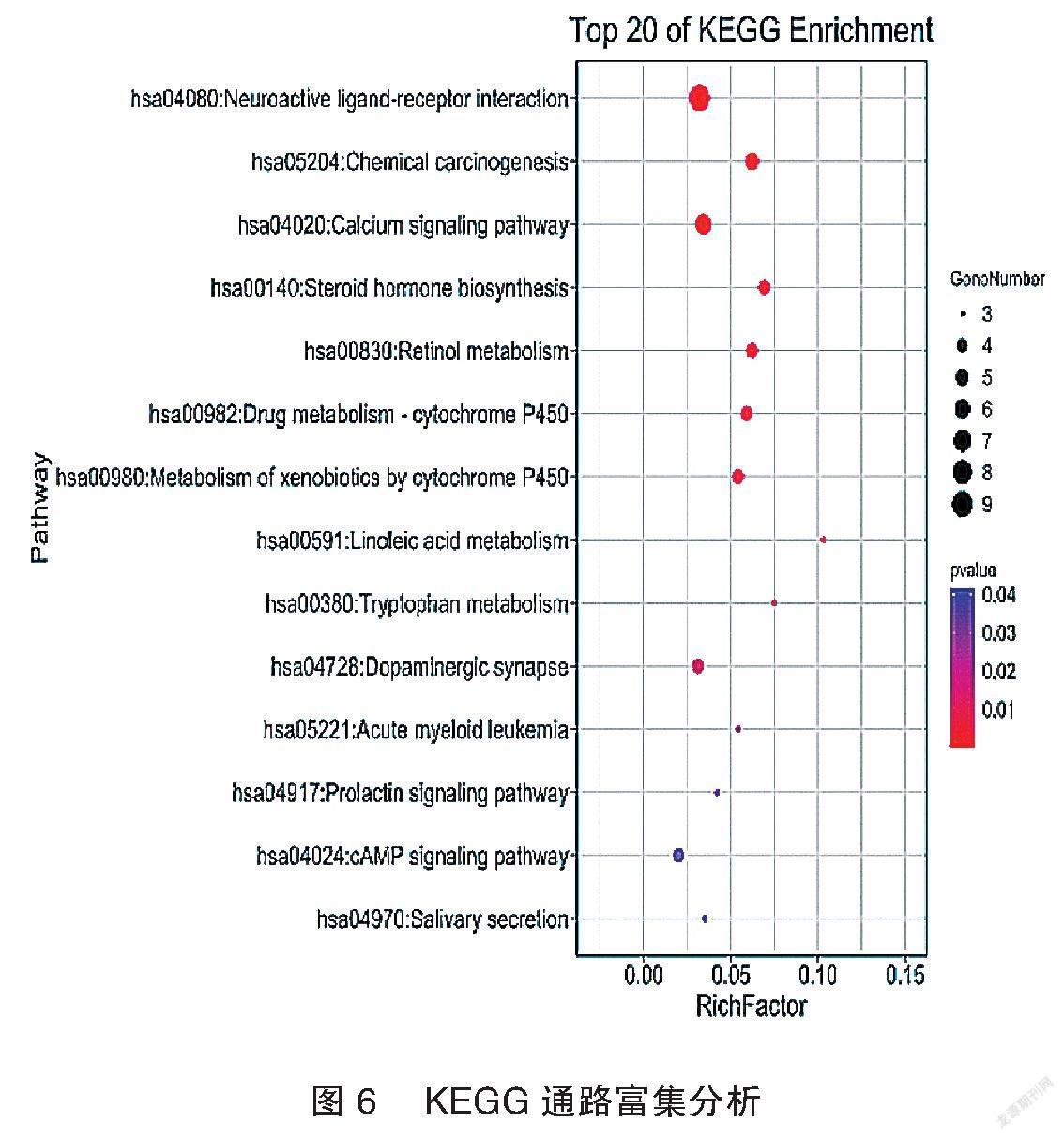
应用DAVID数据库及Omicshare数据库将筛选出的两者共同靶点进行GO(BP、CC、MF)富集及KEGG Pathway功能富集分析,P<0.05作为靶点的筛选标准。富集结果用气泡图显示前20个分析结果。见图3~6。
3 讨论
中药复方的作用特点是“多成分、多途径、多靶点”的协同作用[4]。网络药理学是一门新兴学科[5],通过结合各种组学、筛选、分子交换验证、网络可视化及分析等技术揭示“药物-基因-靶点-疾病”之间复杂的网络关系[6-7]。仍需要利用如多学科结合技术、分子对接技术等进行临床及科学技术的支持验证[8]。
龙芩定眩颗粒方中龙胆为君药,既能泻肝胆实火,又能凉肝平肝;水牛角、茯神与君药合用,加强泻火熄风、安神定眩之力,共为臣药;黄苓、栀子清肝降火,以折其亢阳,瞿麦、车前子渗湿泄热,使邪热从小便出,生地、当归养血滋阴,使邪去而阴血不伤,以上共为佐药;柴胡和解表里,疏肝郁,升阳气,功兼佐使。本研究对龙苓定眩颗粒及眩晕相关靶点进行研究,通过GO富集分析,BP 69个,CC 9个,MF 21个,显著的BP包括药物反应、药物代谢过程、单萜代谢过程等;显著的CC包括质膜的组成部分、质膜、细胞器膜等;显著的MF包括咖啡因氧化酶活性、酶结合、组胺受体活性等。通过KEGG pathway富集分析富集到14条通路,包括神经活性配体-受体相互作用、化学致癌作用、钙信号通路、环磷酸腺昔(cyclin adenosine monophosphate,cAMP)信号通路等。李华等[9]研究表明加味半夏白术天麻汤可以降低椎基底动脉供血不足眩晕大鼠的cAMP含量。这些靶点均预测了该方治疗眩晕的可能作用机制。
通过现代研究对方中药物的化学成分和药理作用成分进行分析。龙胆[10]、茯苓[11-12]、熟地黄[13-14]、柴胡[15]具有镇静作用,栀子[16-17]、瞿麦[18]、车前子[19-20]、当归[21-22]可以保护肝肾,茯苓[23]、黄苓[24]、当归[25]能够调节机体免疫力,茯苓的茯神宁心安神的功效最强[11]。药理实验提示,龙芩定眩颗粒中药物具有镇静安神、调节机体免疫力的作用,从而达到止晕的效果。
本研究仅对药物靶点等方面进行机制研究,并进行了疾病谱的预测,仍需完善分子对接技术等实验,以便进一步验证药物作用,使筛选得到的活性成分和作用机制更有说服力。
[参考文献]
[1]戚晓昆,王志伟.走出头晕与眩晕诊断的误区[J].北京医学,2015,37 (5 ):483-485,506.
[2]单希征.眩晕医学国内外研究进展与展望[J].武警医学,2018,29 (2):109-112.
[3]周丽萍.眩晕的流行病学调查研究[J].中国实用神经疾病杂志,2010,13 (18):31-32.
[4]毛麗斯,朱晓红.网络药理学在中药领域的应用进展[J].中医药管理杂志,2021,29 (13 ):98-102.
[5]杨力龙,苏华珍,卢新丽,等.网络药理学在中药及其复方中应用的研究进展[J].大众科技,2021,23(3):55-57.
[6]陈健,陈启龙.网络药理学在中医药研究中的现状及思考[J].上海中医药大学学报,2021,35 (5):1-6,13.
[7]世界中医药学会联合会.网络药理学评价方法指南[J].世界中医药,2021,16 (4):527-532.
[8]宗阳,丁美林,贾可可,等.基于网络药理学和分子对接法探寻达原饮治疗新型冠状病毒肺炎(COVID-19)活性化合物的研究[J].中草药,2020,51(4):836-844.
[9]李华,许仕海,秦璃,等.加味半夏白术天麻汤对椎基底动脉供血不足眩晕大鼠血管活性物质的影响[J]. 安徽中医学院学报,2013,32 (6):71-73.
[10]潘旭,朱鹤云,张昌浩,等.龙胆化学成分和药理作用研究进展[J].吉林医药学院学报,2020,41(2):150-151.
[11]杜晓妍,吴娇.茯苓的化学成分和药理作用研究进展[J].新乡医学院学报,2021,38 (5 ):496-500.
[12]张超伟,张钰,苏珊,等.茯苓类药材本草学、化学成分和药理作用研究进展[J].湖北农业科学,2021,60(2):9-14,19.
[13]陈洁.浅述中药熟地黄[J].中国中医药现代远程教育,2010,8 (7):201.
[14]陈思琦,李佳欣,吴鑫宇,等.熟地黄的药理学研究进展[J].化学工程师,2019,33 (11 ):46-50.
[15]张耀峰.中药柴胡皂昔药理作用的研究进展[J].中医临床研究,2020,12 (33 ):120-121.
[16]周新新,崔悦,朱鹤云,等.栀子的化学成分、药理作用及提取工艺的研究进展[J].吉林医药学院学报,2021,42(5):374-376.
[17]杨博媛.栀子的化学成分与药理作用[J].化工设计通讯,2020,46 (11 ):136-137.
[18]程霜杰,李燕,袁明智,等.瞿麦化学成分及药理作用研究进展[J].中华中医药学刊,2021,39 (3):134-139.
[19]彭东辉,匡海学,王秋红.车前子多糖的研究进展[J]. 广东药科大学学报,2019,35 (5):702-706.
[20]徐硕,徐文峰,梁晓丽,等.车前子的化学成分及生物活性研究进展[J].西北药学杂志,2019,34(4):567-570.
[21]任伟钰,郑宜黎,张月梅,等.当归多糖药理作用的研究进展[J].时珍国医国药,2020,31(10):2484-2487.
[22]李岩,严宛鸿,闫宁,等.当归多糖对肝脏缺血再灌注损伤保护作用的研究进展[J].西部中医药,2020,33(10):133-137.
[23]钟霞.中药茯苓的药理研究及临床应用[J].中国农村卫生,2019,11(4):33,35.
[24]杨献光,孙阁阁,丁翠红,等.黄芩甘的生物学功能及作用机理[J].中国细胞生物学学报,2021,43 (4):850-855.
[25]陈琳,朱靖,王嵩,等.当归主要活性成分提取方法及其活性研究进展[J].上海医药,2021,42(9):71-75.
