叶酸和利拉鲁肽对 2 型糖尿病血管内皮保护作用的相关性研究
2022-05-01刘雪凤谭丽艳
刘雪凤 谭丽艳




[摘要]目的通过检测利拉鲁肽和叶酸对2型糖尿病(T2DM)小鼠血浆 NO 和 ROS 的影响,探讨两者在糖尿病血管内皮保护的作用上是否存在协同作用。方法采用链脲佐菌素多次腹腔注射的方法制备2型糖尿病小鼠模型。将糖尿病小鼠随机分为四组(叶酸组、利拉鲁肽组、联合组、空白组),每组各8只,根据分组情况分别给予叶酸溶液灌胃及利拉鲁肽注射液腹腔注射干预8周(空白对照组给予生理盐水灌胃及腹腔注射),采用断头取血法取小鼠外周血,采用 ELISA 法检测小鼠血浆一氧化氮(NO)、活性氧(ROS)、空腹胰岛素(FIN)的浓度。结果联合组的血浆 NO、FIN 最高,其次利拉鲁肽组和叶酸组,空白组最低,差异有统计学意义(P <0.05)。联合组的血浆 ROS 最低,其次为叶酸组和利拉鲁肽组,空白组最高,差异有统计学意义(P <0.05)。联合组的血浆 FPG 最低,其次是利拉鲁肽组和叶酸组,空白组最高,差异有统计学意义(P <0.05)。结论利拉鲁肽和叶酸对2型糖尿病小鼠血管內皮的保护作用上存在协同作用。
[关键词]2型糖尿病;利拉鲁肽;叶酸;血管内皮;协同作用
[中图分类号] R587.1 [文献标识码] A [文章编号]2095-0616(2022)08-0080-05
Study on the correlation of folic acid with liraglutide in protecting vascular endothelium in mice with T2DM
LIU Xuefeng TAN Liyan
Department of Endocrinology, the First Affiliated Hospital ofJiamusi University, Heilongjiang, Jiamusi 154000, China [Abstract] Objective To investigate the synergistic effect between liraglutide and folic acid in protecting vascular endothelium by examining the effect of liraglutide and folic acid on plasma nitric oxide (NO) and reactive oxygen species (ROS) of mice with type 2 diabetes mellitus (T2DM). Methods A mouse model of T2DM was prepared by multiple intraperitoneal injections of streptozotocin. The mice with T2DM were randomly divided into four groups (the folic acid group, the liraglutide group, the combined group and the blank group), with 8 mice in each group, and they were given by intragastric administration with folic acid solution and injected with liraglutide injection intraperitoneally for 8 weeks according to the grouping results (the blank group was given by intragastric administration and intraperitoneally injected with normal saline). The peripheral blood of mice was collected by decapitation, and plasma NO, ROS and fasting insulin (FIN) concentrations were measured by enzyme linked immunosorbent assay (ELISA). Results The plasma NO and FIN concentrations were the highest in the combined group, followed by the liraglutide and folic acid groups, and the lowest in the blank group, with statistically significant differences (P <0.05). The plasma ROS concentration was the lowest in the combined group, followed by the folic acid and liraglutide groups, and the highest in the blank group, with statistically significant differences (P <0.05). The plasma FPG concentration was the lowest in the combined group, followed by the folicacid and liraglutide groups, and the highest in the blank group, with statistically significant differences (P <0.05). Conclusion There is a synergistic effect between liraglutide and folic acid in protecting vascular endothelium in mice with T2DM.
[Key words] Type 2 diabetes mellitus; Liraglutide; Folic acid; Vascular endothelium; Synergistic effect
糖尿病(diabetes mellitus, DM)是一组由多种病因引起的以慢性高血糖为特征的代谢性疾病。2015—2017年中华医学会内分泌学分会在全国31个省进行调查,发现我国18岁及以上年龄人群中糖尿病患病率达11.2%[1]。DM 有多种分型,以2型糖尿病(type 2 diabetes mellitus, T2DM)最为常见,约占90%以上[2]。T2DM 随着病情进展会出现多种并发症,其中以血管并发症最为常见,其患者约有70%~80%直接死于糖尿病大血管并发症[3]。叶酸作为改善高同型半胱氨酸的药物为人熟知,其具有血管内皮保护作用也得到了大众的认可。利拉鲁肽作为新型的降糖药物,在降低心血管事件上具有积极的作用。目前研究发现两者对糖尿病血管内皮均存在保护作用,并有部分相似作用机制,本实验希望通过小鼠实验探究上述两药联合使用对糖尿病血管内皮保护作用上是否存在协同作用。
1资料与方法
1.1 一般资料
实验材料及试剂:健康雄性8周龄昆明小鼠购于吉林省生物制品厂动物室(序号:202100036061);小鼠血浆一氧化氮(nitric oxide, NO)酶联反应试剂盒(ELISA 法)(上海博湖生物科技有限公司,产品号: PM103771);血浆活性氧(reactive oxygen species, ROS)酶联反应试剂盒(ELISA 法)(上海博湖生物科技有限公司,产品号:PM104209);空腹胰岛素(fasting serum insulin,FIN)酶联反应试剂盒(ELISA 法)(上海博湖生物科技有限公司,产品号:PM154243);血糖检测仪及检测试纸(江苏鱼跃医疗设备股份有限公司,型号:590血糖仪);利拉鲁肽注射液(丹麦诺和诺德制药有限公司,国药准字J20200026);叶酸片(北京华润紫竹药业有限公司)。T2DM 模型小鼠的制备:取健康的8周龄昆明小鼠40只给予普通小鼠饲料适应性喂养2周,给予高脂饮食喂养8周,测小鼠体重(41.5±8.2)g,禁食不禁水12 h,连续2 d 腹腔注射 STZ 40 mg/kg,继续高脂饮食饲养72 h,72 h 后禁食12 h,测定空腹血糖(FPG), FPG ≥11.1 mmol/L 即为造模成功,最终造模成功 T2DM 小鼠32只,死亡8只。干预:将32只糖尿病小鼠随机分为四组(叶酸组、利拉鲁肽组、联合组、空白组,每组各8只),四组小鼠均给予相同的高脂饮食及水,定时清理鼠笼,保证鼠笼清洁,叶酸组小鼠给予叶酸溶液(71μg/kg)灌胃,利拉鲁肽组给予利拉鲁肽溶液(0.2 mg/kg)腹腔注射,联合组给予叶酸溶液(71μg/kg)灌胃及利拉鲁肽溶液(0.2 mg/kg)腹腔注射,空白组给予生理盐水灌胃(71μg/kg)及腹腔注射(0.2 mg/kg)。动物处理及取样:四组小鼠药物干预8周后禁食不禁水12 h,断头法取血置于 EP 管内,静置20 min,后以2000 r/min 离心15 min,取上层澄清血浆,于-80℃冰箱内保存。
1.2 相关指标检测
血浆 NO、ROS、FIN 的检测:取小鼠血浆50μl,使用小鼠血浆 NO、ROS、FIN 酶联反应试剂盒(ELISA 法)分别测得各组小鼠血浆 NO、ROS、FIN 的浓度,并在酶标仪在450 nm 波长处测定各孔吸光度值,利用标准曲线计算浓度,结果记录于统计表格内。
血浆 FPG 的检测:四组小鼠药物干预8周后禁食不禁水12 h 后,采用断尾取血法取适量小鼠鼠尾血,置于血糖试纸上,使用血糖仪测空腹血糖并记录。
1.3 统计学方法
本研究使用 SPSS 23.0软件包进行数据统计及分析,计量资料以均数±标准差(x ± s)表示,采用方差分析,采用 LSD-t 检验比较组間差异;采用 Pearson 相关性分析检验两连续变量的相关性, P <0.05为差异有统计学意义。
2结果
2.1 各组小鼠血浆NO、ROS、FIN、FPG浓度比较
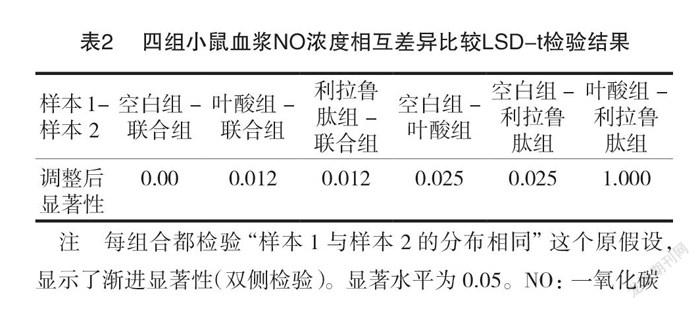
小鼠血浆 NO、ROS、FIN、FPG 浓度分布均符合正态分布。各组小鼠血浆 NO、FIN 浓度,以联合组最高,其次为利拉鲁肽组和叶酸组,空白组最低,差异有统计学意义(P <0.05);各组小鼠血浆 ROS 浓度,以联合组最低,其次为叶酸组和利拉鲁肽组,空白组最高,差异有统计学意义(P <0.05);各组小鼠血浆 FPG,以联合组最低,其次是利拉鲁肽组和叶酸组,空白组最高,差异有统计学意义(P <0.05)。见表1。
2.2 小鼠血浆NO与FPG浓度的相关性
NO浓度与FPG浓度呈负相关(r=-0.825)(见图1), LSD-t 检验结果提示各组小鼠血浆 NO 浓度除叶酸组与利拉鲁肽组外,差异有统计学意义(P<0.05)。见表2。
2.3 小鼠血浆ROS与FPG浓度的相关性
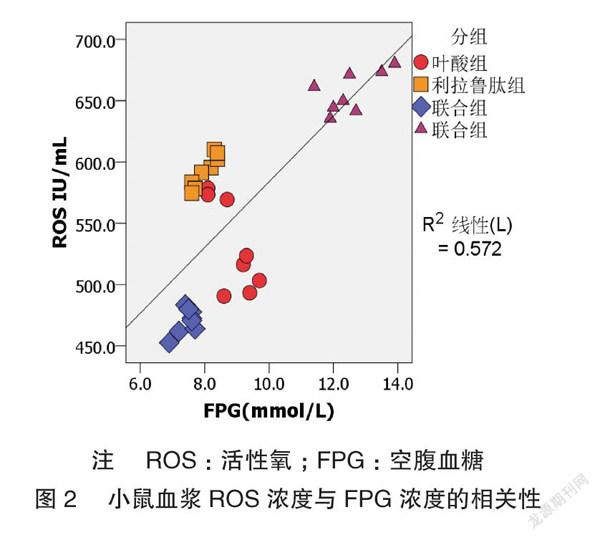
血浆 ROS 浓度与空腹血糖浓度呈正相关(r=0.756)(图2), LSD-t 检验结果提示各组小鼠血浆 ROS 浓度除叶酸组与利拉鲁肽组外,差异有统计学意义(P <0.05)。见表3。
2.4 小鼠血浆FIN与FPG的相关性
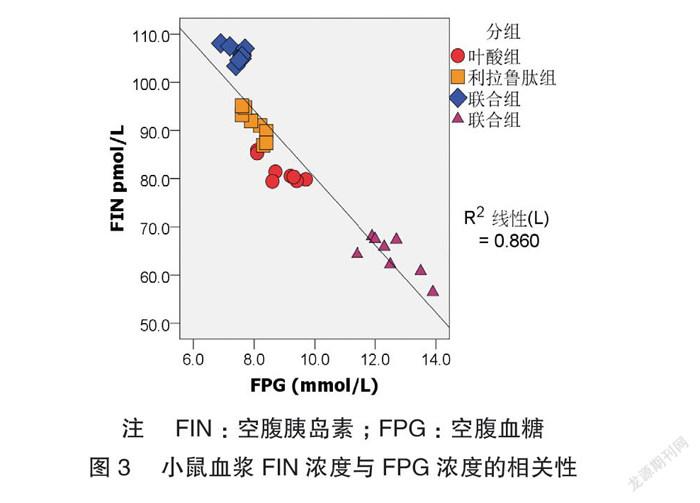
小鼠血浆 FIN 浓度与 FPG 浓度呈负相关(r=-0.927)(图3),LSD-t 检验结果提示各组小鼠 FIN 血浆浓度比较,差异有统计学意义(P <0.05)。见表4。
3讨论
血管内皮细胞是构成心血管封闭系统的形态基础,其功能障碍则是血管内皮损害的主要表现形式,表现为内皮依赖的血管舒缩功能、屏障功能障碍及血管内皮炎性因子的附着或表达增加等[4]。血管内皮损害的两个重要标志是 NO 的生物利用度的降低和 ROS 的生成增加。
慢性持续性高血糖是糖尿病患者最常见的表现。长期的高血糖会导致内皮素的升高,血管内皮内的 NO 下降,同时诱发 NO 合成酶(eNOS)蛋白及其 mRNA 表达异常,引起 NO 的合成减少及其生物活性降低,导致持续的血管内皮损伤[5];同时长期慢性的高糖环境,会诱发血管内皮的氧化应激,产生大量的 ROS,不仅会消耗血管內皮细胞内的还原型物质,还会加速血管内皮下的脂质氧化,造成血管的粥样硬化,并继发促凝和抗凝系统平衡紊乱,加重血管内皮功能损害[6]。除此之外,叶酸的缺乏也会对血管内皮造成持续的损害。一方面,它会引起血管内皮氧化应激反应的发生,促进血管内皮 ROS 的生成;另一方面,它引起的血管内皮内四氢生物蝶呤的利用度下降,诱发eNOS脱偶联,引起血管内皮内 NO 生成进一步减少,造成血管内皮的持续损害[7]。
叶酸作为水溶性维生素 B,能促进内源性四氢生物蝶呤(BH4)的循环,使 BH4与eNOS的重新耦联,恢复已解耦联的eNOS的功能,增加血管内皮内 NO 的合成,达到对血管的保护作用[8]。而且叶酸能清除血管内皮细胞内羟自由基及超氧阴离子自由基,抑制血管内皮内氧化应激反应,改善血管内皮功能障碍[9]。其类似物四氢叶酸作为多种生物反应过程中的辅酶参与一碳单位的转移,促进同型半胱氨酸再甲基化形成甲硫氨酸,增加血管内皮细胞蛋白质、磷脂等的合成;同时它具有抗氧化性,可以在线粒体电子传递链水平阻断超氧化物的生成,发挥其对血管内皮的保护作用[10]。本研究发现给予叶酸干预的小鼠,其血浆 ROS 浓度较空白组降低,血浆 NO 浓度较空白组升高,说明叶酸对糖尿病血管存在保护作用。不仅如此,叶酸干预组小鼠 FIN 水平较空白组高,血浆 FPG 水平较空白组低,说明叶酸改善了糖尿病小鼠的胰岛素抵抗,这可能是因为叶酸促进了血液中胰岛素和细胞表面受体有效结合,并减少胰岛素抵抗,提高胰岛素受体的敏感性;另一方面叶酸可以抑制肠道黏膜吸收葡萄糖,从而降低外周血糖浓度[11]。尽管如此,叶酸降糖能力也低于利拉鲁肽。
利拉鲁肽通过激活 GLP-1受体,促进胰岛β细胞产生葡萄糖依赖性的胰岛素分泌,并抑制胰岛α细胞分泌胰高血糖素,达到降糖效果,改善慢性高血糖对于血管内皮的损害[12];同时它能通过抑制血管内皮细胞中的纤溶酶原激活物抑制剂1型及血管黏附分子的表达,增加eN OS 的活性,增加血管内皮中的 NO 的表达,改善血管内皮功能[13]。不仅如此,利拉鲁肽可以降低血浆中的三酰甘油、胆固醇浓度,减少血管内皮内脂质氧化,改善血管内皮的持续损害[14]。而张瑶等[15]的大鼠实验发现腹腔注射利拉鲁肽可以改善血管内皮细胞内质网应激及炎症反应,同时抑制 p38 MAKA 通过,引起超氧化物歧化酶(SOD)及谷胱甘肽过氧化物酶(GSH-PX)活性升高,表现出对血管的保护作用。本研究发现利拉鲁肽干预的小鼠血浆 ROS 浓度较空白组降低,血浆 NO、FIN 浓度较空白组升高。说明利拉鲁肽对糖尿病血管内皮保护作用是显著的。
叶酸与利拉鲁肽对于血管内皮保护作用上存在相似的机制,且两者间未见相互药物作用的不良反应,因此两者联合应用是符合用药规定的,且两者对于血管内皮保护的作用显著。本研究结果支持这一点,叶酸联合利拉鲁肽干预的小鼠,其血浆 ROS、 FPG 浓度为四组中最低的,血浆 NO、FIN 为四组中最高,说明利拉鲁肽和叶酸对2型糖尿病小鼠血管内皮的保护作用上存在协同作用。但是这一作用在糖尿病患者身上能否体现仍有待进一步验证。
[参考文献]
[1] Li Y,Teng D,Shi X,et al.Prevalence of diabetesrecorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association: national cross sectional study[J].The British Medical Journal,2020,23(9):494-504.
[2] Tang X,Yan X,Zhou H,et al.Prevalence andidentification of type 1 diabetes in Chinese adults with newly diagnosed diabetes[J]. SSRN Electronic Journal 2019,12:1527-1541.
[3] Fatemeh Mehravar,Mohammad Ali Mansournia,KouroshHolakouie-Naieni.Associations between diabetes self-management and microvascular complications in patients with type 2 diabetes[J].Epidemiology and Health,2016,38:e2016004.
[4] Akiko Hirose,Takahisa Tanikawa,Hiroko Mori,et al.Advanced glycation end products increase endothelial permeability through the RAGE/Rho signaling pathway[J]. FEBS Letters,2010,584(1):61-66.
[5]胡丽叶,陈红军,宋光耀,等.内皮型一氧化氮合酶在2型糖尿病大鼠主动脉的表达及罗格列酮干预效果[J].解放军医药杂志,2015,27(2):42-46.
[6]张留弟,李群益,施孝金.血管内皮功能障碍与2型糖尿病研究进展[J].上海医药,2014,35(23):45-48,52.
[7] Hole M,Jorge-Finnigan A,Underhaug J,et al.Pharma c o l o g i c a l C ha pe ro ne s t ha t Pro t e c t Tetrahydrobiopterin Dependent Aromatic Amino Acid Hydroxylases Through Different Mechanisms[J].Current Drug Targets-The International Journal for Timely in- depth Reviews on Drug Targets,2016,17(13):1515-1526.
[8] Yuyun MF,Ng LL,Ng GA.Endothelial dysfunction,endothelial nitric oxide bioavailability, tetrahydrobiopterin, and 5-methyltetrahydrofolate in cardiovascular disease. Where are we with therapy?[J].Microvascular Research: An International Journal,2018(119):7-12.
[9]遲晓星,张涛,赵静,等.叶酸的提取及抗氧化性研究[J].现代食品科技,2011,27(10):1234-1237.
[10] Zheng YX,CantleyLC.Toward a better understandingof folate metabolism in health and disease[J].The Journal of Experimental Medicine,2019,216(2):253-266.
[11] R. Buettner, I. Bettermann, C. Hechtl, et al.DietaryFolic Acid Activates AMPK and Improves Insulin Resistance and Hepatic Inflammation in Dietary Rodent Models of the Metabolic Syndrome[J].Hormone and Metabolic Research,2010,42(11):769-774.
[12] K Pabreja,M A Mohd,C Koole,et al.Molecularmechanisms underlying physiological and receptor pleiotropic effects mediated by GLP-1R activation[J]. British Journal of Pharmacology,2014,171(5):1114-1128.
[13] Gaspari Tracey,Liu HongBin,WelungodaIresha,et al.A GLP-1 receptor agonist liraglutide inhibits endothelialcell dysfunction and vascular adhesion molecule expression in an ApoE-/-mouse model[J].Diabetes & Vascular Disease Research,2011,8(2):117-124.
[14] Feng Sun,Shanshan Wu,Jing Wang,et al.Effectof glucagon-like peptide-1 receptor agonists on lipid profiles among type 2 Diabetes:A Systematic Review and Network Meta-analysis[J].Clinical Therapeutics,2015,37(1):225-241.
[15] 张瑶,谢家钊,胡军,等 . 利拉鲁肽通过 p38MAPK通路改善高同型半胱氨酸血症诱导的大鼠海马氧化应激及炎症损伤 [J]. 中国病理生理杂志,2018,34(11):2025-2030.
(收稿日期:2021-10-09)
