Tuftsin衍生物T肽的抗肿瘤作用及机制探讨
2022-04-29史振伟王聪聪黄转青徐风华
史振伟,罗 东,孙 琦,王聪聪,杨 齐,马 玥,杨 飞,黄转青,徐风华
1 解放军总医院医疗保障中心 药剂科药学基础研究室,北京 100853;2 解放军医学院,北京 100853
黑色素瘤是一类起源于黑色素细胞的高度恶性肿瘤,发生于皮肤、黏膜、眼葡萄膜、软脑膜等部位[1]。它是临床上较为常见的恶性肿瘤之一,具有高度恶性、高侵袭性、易转移、预后差的特点。尽管我国黑色素瘤的发病率较欧美国家低[2],但近年来呈现快速增长的趋势,加之我国人口基数大,因此我国黑色素瘤患者的数量庞大[3-4]。近年来,新的有效系统诊治方案的发展[5],尤其是通过改善自身免疫系统自然防御机制的免疫治疗的发展使患者的存活率大幅提高,抗肿瘤免疫治疗日益受到人们的重视[6-8]。促吞噬肽(Tuftsin)是源于脾的活性四肽[9],是一种生物反应调节剂。Tuftsin可以激活粒细胞、单核细胞和巨噬细胞,通过提高它们的趋化性、吞噬作用以及增强细胞毒性T淋巴细胞的细胞杀伤作用[10-12],从而增强淋巴系统的细胞免疫活性,并表现出抗肿瘤作用[9,13-14]。但它在体内易被酶解,半衰期短,仅16 min,限制了其成药性[15]。为了增加促吞噬肽的稳定性并延长其在体内的生物活性时间,人们开发了各种衍生物[15-17]。T肽是以Tuftsin为母体进行改造所得到的一种新型衍生物[18],其由4个Tufsin经赖氨酸连接而成,分子量在2 000以上。这种连接结构使T肽在体内更稳定,半衰期延长为2~4 h[18-19]。初步研究表明,T肽在一定条件下表现出可靠且显著的肿瘤抑制作用。在裸鼠移植瘤模型中,T肽能够显著抑制HepG2人肝癌、HT29人结肠癌和BGC-823人胃腺癌术后肿瘤生长,发挥抗肿瘤作用,抑制率可达60%以上[20];在非免疫缺陷小鼠移植瘤模型中,T肽对术后肿瘤的生长抑制率高达70%以上。同时,在抗肿瘤研究中,T肽表现出良好的安全性,对小鼠体质量没有明显影响[21]。此外,An等[20]发现T肽可以与巨噬细胞中表达的特异性表面抗体结合,增强巨噬细胞的吞噬和细胞毒功能。根据这些结果,我们推测T肽对肿瘤的治疗作用主要源于免疫系统的激活,但具体有哪些免疫细胞和免疫因子被激活尚不完全清楚。在本研究中,我们尝试通过对T肽的体内外抗肿瘤活性研究和对免疫系统的激活作用研究,进一步探讨T肽的抗肿瘤作用机制。
材料与方法
1 仪器和试剂 流式细胞仪(美国贝克曼库尔特公司,型号CytoFLEX);细胞计数仪(美国Millipore公司,型号Scepter2.0);移液器(德国Eppendorf公司);酶标仪(Thermo Scientific Varioskan LUX多功能微孔板读数仪);二氧化碳培养箱(Thermo型号HERAcell240i);培养瓶(美国Corning公司);T肽为白色冻干粉末,纯度大于98%,由解放军总医院药学基础研究室提供,批号:120903;APC/Cyanine7 anti-mouse CD3流式检测抗体、FITC anti-mouse CD4流式检测抗体、Per-CP/Cyanine5.5 anti-mouse CD8a流 式 检 测 抗 体、PE/Cy7 anti-mouse/human CD44流式检测抗体、APC anti-mouse NK-1.1流式检测抗体、PE antimouse CD86流式检测抗体、Brilliant Violet 421TManti-mouse CD206 (MMR)流式检测抗体、Brilliant Violet 650TManti-mouse F4/80流式检测抗体、Brilliant Violet 605TManti-mouse Ly-6G/Ly-6C (Gr-1)流式检测抗体、Intracellular Staining Permeabilization Wash Buffer (10X破膜液)、PE/DazzleTM594 antimouse/human CD11b流式检测抗体(美国Biolegend公司);IL-2 Elisa试剂盒、IL-4 Elisa试剂盒、IL-10 Elisa试剂盒、IL-12 Elisa试剂盒、TNF-α Elisa试剂盒、IFN-γ Elisa试剂盒、TGF-β Elisa试剂盒(美国Biolegend公司);RPMI 1640细胞培养基(美国Gibco公司);胎牛血清(美国Gibco公司)。
2 细胞和实验动物 B16-F10小鼠黑色素瘤细胞由军事医学科学院实验室保存提供。C57BL/6小鼠12只,鼠龄6周左右,体质量(16.58±0.58) g,健康雌性,购买于北京维通利华实验动物技术有限公司并饲养于解放军总医院实验动物中心。试验经解放军总医院动物实验福利伦理委员会批准,授权编号为2019-X15-90。
3 B16-F10细胞移植性肿瘤模型的建立和分组处理 12只小鼠随机分为两组,即T肽组和对照组,每组6只。两组小鼠右侧前肢腋下接种黑色素瘤细胞悬液0.1 mL,含B16-F10细胞5×105个。肿瘤细胞接种后当天(第0天)T肽组小鼠皮下注射T肽(药物剂量8 mg/kg),实验期间隔日给药,共计给药9次;对照组小鼠注射相同体积的0.9%氯化钠注射液。待肿瘤生长至可见突起后隔日测量肿瘤的长短径。
肿瘤体积按公式计算:V=L×W2/2(V=肿瘤体积,L=长径,W=短径)。
肿瘤生长抑制率(瘤重)=(空白对照组瘤重-给药组瘤重)/空白对照组瘤重×100%。
4 流式细胞术检测小鼠脾组织免疫细胞表达 在第17天处死小鼠,每组随机取5只小鼠,无菌操作取小鼠脾,用眼科剪将脾剪碎成小块,把脾放在网上,以5 mL注射器内芯轻轻搓组织块,边搓边加0.9%氯化钠注射液冲洗,直至完成,离心去上清;加入红细胞裂解液3 mL,室温放置5 min,离心去上清;用2 mL含10%胎牛血清RPMI 1640培养液重悬细胞,计数。取5×106个细胞置于24孔板内,并加入含10%胎牛血清的RPMI 1640培养液至2 mL,培养72 h。收集细胞悬液于离心管内,离心后收集上清液,用于检测细胞因子IL-2、IL-4、IL-10、IL-12、TNF-α、TGF-β、IFN-γ的分泌量;另取含5×106个细胞的悬液置于流式检测管,每管加入适量(200 µL)的预稀释好的CD3、CD4、CD8、CD44、NK1.1、F4/80、CD86、CD11b、Gr-1流式检测抗体;在空白管或同型对照管中加入与实验组相同量的抗体对照试剂;各管避光在4℃冰箱中孵育30 min;加入1 mL细胞染色缓冲液,然后350 g离心5 min后弃上清液;每管内加入0.5 mL固定液,室温、避光孵育20 min;离心弃去上清液;加入配制好的破膜液,离心后弃去上清液,重复1次。在每个流式检测管中加入适量(200 µL)的预稀释的CD206流式检测抗体,室温、避光孵育20 min;加入1 mL破膜液,350 g离心5 min后弃上清。用500 µL细胞染色缓冲液重悬细胞,过200目细胞筛,上机检测免疫细胞的数量。
5 流式细胞术检测小鼠移植瘤免疫细胞表达 在第17天处死小鼠,每组随机取5只小鼠,用眼科剪取小鼠移植瘤,并将肿瘤组织剪碎成小块,小心研磨,用200目筛网滤取细胞悬液于离心管内,离心去上清;加入红细胞裂解液3 mL,室温放置5 min,离心去上清;用2 mL RPMI 1640培养液重悬细胞,计数。取含5×106个细胞的悬液置于流式检测管,每管加入适量(200 µL)的预稀释好的CD3、CD4、CD8、CD44、NK1.1、F4/80、CD86、CD11b、Gr-1流式检测抗体;在空白管或同型对照管中加入与实验组相同量的抗体对照试剂;各管避光在4℃冰箱中孵育30 min;加入1 mL细胞染色缓冲液,然后350 g离心5 min后弃上清液;每管内加入0.5 mL固定液,室温、避光孵育20 min;离心弃去上清液;加入配制好的破膜液,离心后弃去上清液,重复1次。在每个流式检测管中加入适量(200 µL)的预稀释的CD206流式检测抗体,室温、避光孵育20 min;加入1 mL破膜液,350 g离心5 min后弃上清。用500 µL细胞染色缓冲液重悬细胞,过200目细胞筛,上机检测免疫细胞的数量。
6 小鼠血清和脾细胞培养上清液中免疫因子表达量测定 摘取小鼠眼球取血,收集血液于离心管内,在冰块上静置2 h,2 000 r/min离心10 min,收集上层血清,采用ELISA法测定血清和脾细胞培养上清液中免疫因子IL-2、IL-4、IL-10、IL-12、TNF-α、TGF-β、IFN-γ的表达量。
7 体外细胞毒性实验 B16-F10小鼠黑色素瘤细胞培养基为含10%胎牛血清的RPMI 1640培养基,25 cm2培养瓶,置于37℃、5% CO2饱和湿度的培养箱中培养,隔日更换1次培养液,待细胞长满培养瓶,收集细胞并用细胞计数仪计数,备用。将B16-F10小鼠黑色素瘤细胞以10 000/孔的密度接种在96孔板中。培养24 h后,更换培养液,使细胞在T肽浓度为0.1、1、5、10 µmol/L的培养基以及PBS(对照组)中继续培养72 h。按照说明书操作,使用CCK-8测定细胞活性,在450 nm测定吸光值A,使用公式计算存活百分比:

8 统计学方法 采用GraphPad Prism 7统计分析软件和SPSS23.0软件进行统计学分析,实验数据计量资料以±s表示,组间比较采用方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
结 果
1 T肽对移植肿瘤生长的抑制作用 两组小鼠在接种肿瘤细胞前体质量无明显差异;在实验期间,两组小鼠在相同的时间点体质量无明显差异(图1A),T肽组小鼠移植瘤肿瘤体积和重量明显低于对照组,移植肿瘤抑制率约为56.45%(图1D)。
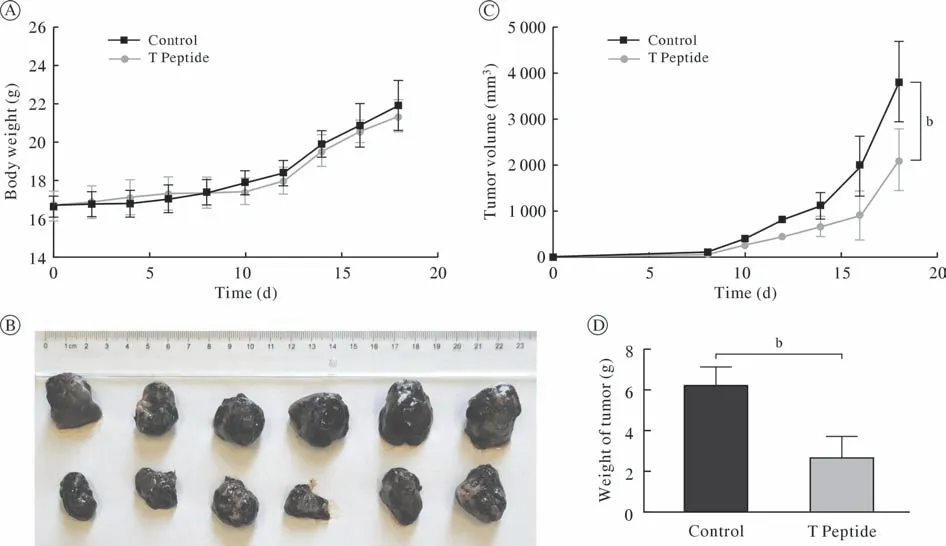
图1 T肽抑制体内B16-F10肿瘤生长作用Fig.1 T peptide inhibits B16-F10 tumor growth in vivo
2 T肽对小鼠脾组织免疫细胞表达量的影响 流式细胞术检测小鼠脾组织免疫细胞表达量,发现T肽可显著升高荷黑色素瘤小鼠脾组织中CD8+T淋巴细胞(图2A)、记忆性T细胞(CD3+CD44+)(图2B)、髓系来源抑制细胞(CD11b+Gr-1+)(图2D)和M1巨噬细胞(F4/80+CD86+)(图2E)表达率,而对CD4+T淋巴细胞(图2A)、自然杀伤细胞(NK1.1+)(图2C)、M2巨噬细胞(F4/80+CD206+)(图2F)表达率无明显影响。

图2 小鼠脾中各免疫细胞(流式代表图和统计结果)Fig.2 FCM assay of splenocytes from tumor-bearing mice
3 T肽对移植瘤免疫细胞表达量的影响 流式细胞术检测发现,皮下隔日注射T肽可显著升高黑色素瘤小鼠肿瘤组织中记忆性T细胞(CD3+CD44+)(图3A)表达率,而对CD4+T淋巴细胞、CD8+T淋巴细胞(图3B)、自然杀伤细胞(NK1.1+)(图3C)、髓系抑制细胞(CD11b+Gr-1+)(图3D)、M1巨噬细胞(F4/80+CD86+)(图3E)、M2巨噬细胞(F4/80+CD206+)(图3F)表达率无明显影响。
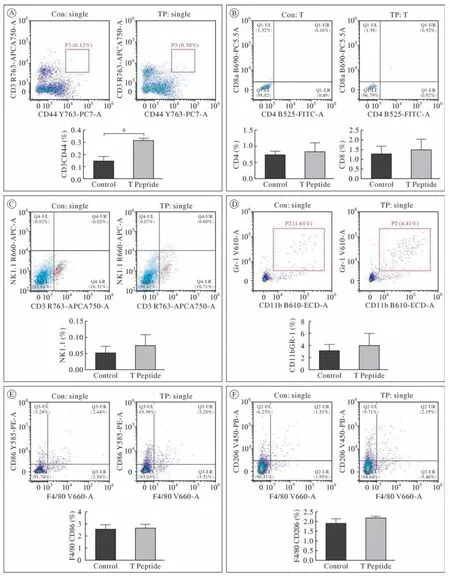
图3 小鼠肿瘤组织各免疫细胞(流式代表图和统计结果)Fig.3 FCM assay of immune cells infiltrating into tumors
4 T肽对小鼠血清和脾细胞培养上清液中免疫因子表达的影响 ELISA法检测发现,T肽组脾细胞培养上清液和血清中IFN-γ(图4G)分泌量显著高于对照组,而IL-2、IL-4、IL-10、IL-12、TNF-α、TGF-β分泌量与对照组相比无统计学差异(图4A~图4F),提示T肽能提高细胞因子IFN-γ表达量。

图4 T肽对脾细胞培养上清液和血清中细胞因子的影响(aP<0.05;bP<0.01)Fig.4 Effect of T Peptide on cytokines produced in the cultured supernatant of splenocytes and in serum (aP<0.05;bP<0.01)
5 T肽对细胞增殖的影响 采用CCK-8法测定B16-F10黑色素瘤细胞与不同浓度的T肽孵育72 h后的细胞活力。结果表明,T肽在0.1~10 µmol/L范围内均不影响B16-F10细胞的增殖,亦未显示对肿瘤细胞的浓度依赖性作用。见图5。

图5 不同浓度T肽对体外肿瘤细胞增殖的影响Fig.5 Effect of T peptides at different concerntrations on melanoma cells in vitro
讨 论
本研究表明,T肽在体外对肿瘤细胞没有细胞毒性,其体内抗肿瘤作用主要是由于免疫系统激活。荷瘤小鼠给予T肽后,CD8+T细胞、CD3+CD44+T细胞、MDSCs和M1巨噬细胞在脾中聚集的比例增加,IFN-γ表达增加。巨噬细胞在抗肿瘤免疫调节过程中发挥着重要作用,肿瘤基质中的肿瘤相关巨噬细胞可以在肿瘤微环境的调控下改变其表型,进化为抑制肿瘤生长的M1型或促进肿瘤进展的M2型。本研究发现T肽组小鼠脾中M1型巨噬细胞(F4/80+CD86+)的表达率升高,而M2型巨噬细胞(F4/80+CD206+)的表达率无明显变化,说明T肽有利于肿瘤抑制性巨噬细胞(M1)的产生,该结果与文献报道类似[20]。这些发现部分解释了T肽对皮下移植瘤的抑制作用。
An等[20]报道T肽在鼠源性肉瘤细胞S180和肝癌细胞H22小鼠移植瘤模型中未显著抑制肿瘤生长,认为T肽不会抑制体内肿瘤生长,本研究中T肽对B16-F10黑色素移植瘤的抗肿瘤作用显著,导致不同结果的原因可能是T肽给药时间不同。An等[20]的研究中,当肿瘤平均体积达到80 ~100 mm3时小鼠皮下注射T肽,本研究中自小鼠皮下接种细胞悬液当日即开始给予T肽,这进一步说明T肽是通过调动机体免疫力发挥抗肿瘤作用的,当外来肿瘤细胞在体内定植并形成瘤体后,机体免疫系统已受到影响,导致T肽的作用下降,不能表现出抑制肿瘤生长的作用。
髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)被认为是免疫抑制网络的主要组成部分,在诸多病理条件下干扰T细胞功能,这些细胞可以抑制T细胞的增殖和B细胞的功能。本研究发现,T肽治疗组脾组织细胞中CD11b+Gr-1+的表达率升高,提示T肽对MDSCs的表达和分布也有调节作用,相关机制值得进一步研究。
综上,T肽可通过增加小鼠脾中CD8+T细胞和M1型巨噬细胞的水平,并增加免疫因子IFN-γ的表达来抑制小鼠黑色素瘤B16-F10细胞移植性肿瘤的生长,全面理解其肿瘤抑制作用机制还有待于更加全面系统的研究。
