去甲斑蝥素对实验性过敏性结膜炎眼部炎症及Th1/Th2平衡的影响及机制
2022-04-28庄海容吴子东陈雪红李成军
庄海容, 吴子东, 陈雪红, 李成军
(海南医学院第二附属医院眼科, 海南 海口 570311)
过敏性结膜炎(allergic conjunctivitis,AC)是一种常见的过敏性眼表疾病,多发于儿童与青少年人群中,临床表现为眼部瘙痒、肿胀、发红、流泪和畏光等症状,通常与鼻炎、哮喘和其他过敏性疾病的发作密切相关[1,2]。近年来,由于空气污染和气候变暖,AC的发病率逐年增高,这严重影响了患者的生活质量。AC主要与免疫球蛋白E(immunoglobulin E,IgE)介导的I型过敏反应和T淋巴细胞介导的IV型超敏反应有关[3],但具体介导的其病理生理过程尚未明确。斑蝥素(cantharidin,CTD)是从昆虫大斑蝥中提取的一种主要活性成分,具有促进毛发生长、皮肤止痒等药理作用。去甲斑蝥素(norcantharidin,NCTD)是CTD的去甲甲基化合物,与CTD相比,具有易合成、副作用少、活性强等优点。近年来,人们对NCTD的关注度越来越高,尤其是其抗癌作用。各种临床和实验研究证明其对多种癌细胞具有强大而广泛的抗肿瘤作用,如胆管癌、鼻咽癌、肺癌、直肠癌和乳腺癌等[4~6],特别是对肝癌的预后显示出良好效果[7],其机制主要包括抑制细胞生长、迁移和侵袭,并介导调控细胞自噬和多个相关信号通路。此外,NCTD还具有增强免疫、抗血小板聚集和抑制肾间质纤维化的作用,由此说明,NCTD可能具有更广泛生物活性作用有待挖掘。已有研究表明,NCTD能够明显抑制新生血管的生成[8],血管内皮生长因子(vascular endothelial growth factor,VEGF)作为血管内皮细胞的特异性生长因子,能够诱导血管生成。因此,本研究通过构建AC大鼠模型,检测经NCTD作用的AC大鼠角结膜组织的病理情况,Th1/Th2细胞比例的变化,以及VEGF相关途径蛋白的表达,综合探讨NCTD对AC大鼠模型的治疗作用及其意义。
1 材料与方法
1.1实验动物:健康清洁级SD大鼠,40只,8周龄,体质量为200~220g,饲养环境设置为温度(22±2)℃、相对湿度40~60%、光照/黑暗各12h循环,自由饮食、饮水。适应性饲喂一周后开始实验,本研究获得我院动物伦理委员会批准。
1.2主要材料与试剂:去甲斑蝥素(norcantharidin,NCTD,纯度>99%,生产批号CPRS100414)购自上海博顿生物化工有限公司,卵清蛋白(OVA)购自美国Sigma公司,HE试剂盒和PAS试剂盒购自北京雷根生物有限公司,大鼠特异性ELISA试剂盒购自南京凯基生物公司,RNAiso Plus和SYBR Premix Ex Taq Ⅱ试剂盒购自大连宝生物公司,免疫荧光染色试剂购自上海翊圣生物科技有限公司,RIPA溶液、BCA蛋白测定试剂盒和ECL发光液购自上海碧云天生物研究所,Cy5-A CD4、PE-A IFN-γ、PE-A IL-4抗体购自美国e Biloscience公司,兔抗VEGF、VEGFR2单克隆抗体、兔抗GAPDH多克隆抗体及TRITC标记的山羊抗兔IgG购自英国Abcam公司,其他试剂均为国产市售分析纯。
1.3方 法
1.3.1动物建模、分组及给药:参考文献[9]方法,采用OVA致敏法建立SD大鼠AC模型。第1天大鼠通过皮下注射含100μg OVA和5mg佐剂Al(OH)3的PBS溶液200μL,将大鼠致敏;第7天腹腔注射含100μg OVA的PBS溶液200μL;第8~13天,用含80μg/μL OVA的生理盐水溶液点眼以加强致敏;第14天和第16天,分别用含150μg/μL、0.15mg/μL OVA的PBS溶液点眼以进行致敏原攻击;第17天,再以腹腔注射含100μg OVA的PBS溶液200 μL;第18天和第20天,用含0.15mg/μL OVA的PBS溶液点眼进行致敏原攻击;第17~26天,各组连续给药10d;第27天,再用含0.15 mg/μL OVA的PBS溶液点眼,再次进行致敏原攻击,20min后观察大鼠眼部体征并记录。将40只SD大鼠按照数字随机表法分为4组,包括对照组、模型组、NCTD低剂量组和NCTD高剂量组,每组10只,除对照组外,其余3组建立AC模型,在给药期间,对照组和模型组给予生理盐水,NCTD低、高剂量组分别按0.05mg·kg-1·d-1、0.1mg·kg-1·d-1的剂量给予NCTD灌胃,连续10d。
1.3.2模型大鼠眼部体征观察及评估:大鼠OVA末次致敏后,双盲法通过台式裂隙灯显微镜观察其眼部体征,包括:结膜水肿、充血,眼睑充血、水肿,分泌物产生,根据Magone等[10]的评分标准进行评分,4种指标评分分别记为0~3分,相加得出评分,最低为0分,最高为12分,以此判断大鼠眼部症状严重程度。
1.3.3眼部病理学变化观察:断颈法处死各组大鼠,迅速摘除眼球,取角膜组织与结膜组织,清洗固定后,置于OCT包埋剂中,切成4μm的组织薄片。苏木精-伊红(HE)染色观察角膜组织病理学变化,切片常温下复温,脱蜡脱水,浸入苏木素染色8min,自来水冲洗,1%盐酸酒精分化数秒,自来水冲洗,伊红浸染3min,自来水冲洗,常规脱水,二甲苯透明,以中性树胶封片,光学显微镜观察组织形态并采集图像。高碘酸‐希夫(PAS)染色观察结膜组织,统计结膜区域下穹窿0.1mm2区域中的杯状细胞数目。切片复温后,脱蜡脱水,浸入阿利新蓝溶液染色10min,自来水冲洗,过碘酸溶液氧化5min,Leagene SchiffReagent染色10min,流水冲洗,苏木素染核,乙醇分化,氨水溶液返蓝,自来水冲洗后,常规脱水,二甲苯透明,以中性树胶封片,光学显微镜观察组织染色情况并采集图像。
1.3.4血清细胞因子分析:各组大鼠腹主动脉采血,室温静置2h,再以4000r/min离心15min,收集上清,使用特异性ELISA试剂盒检测各组大鼠血清中细胞因子IL-2、IL-4、IL-5、IL-10及IFN-γ的含量,实验步骤严格按照试剂盒说明书进行。
1.3.5流式细胞术检测Th1/Th2细胞比值:无菌环境下摘取大鼠脾脏组织,清洗干净,于匀浆器中充分研磨,钢筛过滤,以4000r/min离心10min,弃上清留取沉淀,PBS洗涤,利用分离液分离获得单个核细胞。取1mL细胞悬液,再以1000r/min离心10min,留取沉淀,适量缓冲液重悬,依次加入Cy5-A CD4以及PE-A IFN-γ、PE-A IL-4抗体各10μL,均匀后,室温避光静置30min,离心再以PBS重悬,通过流式细胞仪检测Th1、Th2细胞百分比,计算Th1/Th2比值。
1.3.6总RNA提取与实时荧光定量PCR检测实验:取结膜组织加入RNAiso Plus试剂,于匀浆器中充分研磨,按照试剂盒说明书提取组织总RNA,紫外分光光度计测量样品OD值,测定RNA的质量与浓度。将总RNA通过逆转录操作合成cDNA,再以cDNA为模版,采用荧光实时定量PCR法检测目的基因mRNA表达水平,以GAPDH为内参基因,扩增体系:cDNA 2μL、上游引物/下游引物各0.5μL、SYBR Premix Ex Taq Ⅱ 10μL、加无酶水补足20μL;扩增条件:95℃ 3min(第一阶段,1个循环);95℃ 12s,62℃ 40s,95℃ 15s(第二阶段,45个循环)。引物具体序列如下:IFN-γ上游引物:5’-AGCCGCCACATCAAACACATA-3’,下游引物:5’-CGCTGGATTCTCAAGTCGTT-3’;IL-4上游引物:5’-ACGCCATCAGGAAGGTTGTT-3’,下游引物:5’-GTGCCCACCGCTGTGCTTAC-3’;GAPDH上游引物:5’-AACGGATTTGGTCGTATTG-3’,下游引物:5’-GGAAGATGGTGATGGGATT-3’。检测结束后,2-△△Ct法计算基因mRNA相对表达水平。
1.3.7免疫荧光染色检测VEGF表达:将制备的角膜组织切片解冻复温,使用4%甲醛溶液固定20min,浸入0.2%Triton X-100中透化20min,以10%山羊血清室温封闭30min,再与兔抗VEGF单克隆抗体(1∶200)共同置于4℃隔夜孵育。次日,弃去原液,加入TRITC标记的山羊抗兔IgG(1∶200),室温下孵育2h,DAPI染核10min,以中性树胶封片,荧光显微镜观察组织染色情况并采集图像,随机选择5个视野,计数该视野下阳性细胞数与总细胞数,以阳性细胞数/总细胞数作为阳性细胞表达。
1.3.8Western Blot法:无菌环境下将眼结膜组织剪碎,加入RIPA溶液置于冰上裂解45min,超声裂解20min,以12000r/min离心30min,取上清液,BCA法进行蛋白定量。制备10%SDS-PAGE凝胶,取等量蛋白加入胶孔,通过电泳分离蛋白,转印至PVDF膜,用5%脱脂奶粉在室温下封闭1h,加入稀释的一抗(1∶1000),4℃隔夜孵育。次日,弃去原液,洗膜后加入对应稀释后的二抗(1∶5000),37℃孵育1h,再次洗膜后,ECL发光液显影,凝胶成像系统拍照,Image ProPlus软件分析蛋白条带灰度值,以GAPDH作为内参蛋白,以目的蛋白灰度值/内参蛋白灰度值的比值作为目的蛋白相对表达水平。

2 结 果
2.1大鼠眼部体征观察及炎症评分:通过观察可见对照组大鼠结膜无明显充血红肿,未见分泌物,眼裂大小正常,精神状况良好;模型组大鼠结膜明显充血红肿,眼裂变小、流泪、分泌物增多且浸润至眼周,精神状况较差,活动减少,炎症评分显著高于对照组(P<0.01);NCTD低、高剂量组大鼠结膜充血红肿现象较模型组明显缓解,流泪、分泌物均减少,炎症评分显著下降(P<0.01),且NCTD高剂量组炎症评分显著低于NCTD低剂量组(P<0.01),见表1。

表1 各组大鼠炎症评分比较±s)
2.2去甲斑蝥素对AC大鼠角结膜病理变化的影响:HE染色可见对照组角膜组织结构清晰,角膜上皮细胞层整齐紧密排列,未见炎症浸润现象;模型组角膜表面不平,结构疏松,角膜上皮细胞层有缺损细胞,可见新生血管产生;NCTD低、高剂量组的角膜组织中上皮细胞排列较为紧密,较模型组未见明显缺损现象,新生血管减少,且NCTD高剂量组病理改善作用更加明显,见图1A。PAS染色观察到对照组结膜有大量杯状细胞,细胞形态饱满、体积较大,而模型组结膜中杯状细胞大量减少,细胞数目较对照组显著下降(P<0.01),形态欠规则;与模型组比较,NCTD低、高剂量组的结膜中杯状细胞数目显著增加(P<0.01),细胞间接较为紧密,见图1B与图1C。
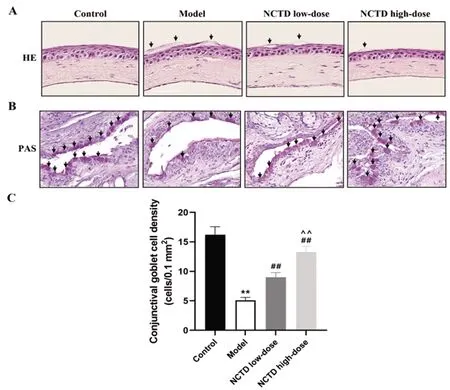
图1 各组大鼠角结膜病理变化观察注:A:HE染色观察角膜组织,箭头所指为新生血管(比例尺=100μm);B:PAS染色观察结膜组织,箭头所指为杯状细胞(比例尺=100μm);C:大鼠结膜组织杯状细胞数目统计。与对照组比较,**P<0.01;与模型组比较,##P<0.01;与NCTD低剂量组比较,^^P<0.01。
2.3去甲斑蝥素对AC大鼠血清细胞因子水平的影响:ELISA检测结果如表2所示,与对照组比较,模型组大鼠血清中IL-2、IFN-γ含量显著降低,IL-4、IL-5、IL-10含量显著升高(P<0.01);与模型组比较,NCTD低、高剂量组IL-2、IFN-γ含量显著升高,而IL-4、IL-5及IL-10含量显著降低(P<0.01);同时,NCTD高剂量组IL-2、IFN-γ含量显著高于NCTD低剂量组,IL-4、IL-5、IL-10含量显著低于NCTD低剂量组(P<0.01)。

表2 各组大鼠细胞因子水平比较±s,pg/mL)
2.4去甲斑蝥素对AC大鼠Th1/Th2免疫平衡的影响:流式细胞术检测结果如图2所示,与对照组比较,模型组大鼠脾脏淋巴细胞内Th1细胞比例和Th1/Th2比值均显著减少,Th2细胞比例显著增加(P<0.01);与模型组比较,NCTD低、高剂量组Th1细胞比例和Th1/Th2比值均显著增加,Th2细胞比例显著减少(P<0.01);而相较于NCTD低剂量组,NCTD高剂量组Th1细胞比例及Th1/Th2比值显著增加,Th2细胞比例显著减少(P<0.01),见图2。

图2 各组大鼠脾脏淋巴细胞Th1、Th2比例及Th1/Th2比值比较注:与对照组比较,**P<0.01;与模型组比较,##P<0.01;与NCTD低剂量组比较,^^P<0.01
实时荧光定量PCR检测结果显示,模型组大鼠结膜组织中IFN-γ mRNA表达较对照组显著下调,IL-4 mRNA表达较对照组显著上调(P<0.01);与模型组比较,NCTD低、高剂量组IFN-γ mRNA表达显著上调,IL-4 mRNA表达显著下调(P<0.01);与NCTD低剂量组比较,NCTD高剂量组IFN-γ mRNA表达显著上调,IL-4 mRNA表达显著下调(P<0.01),见图3。
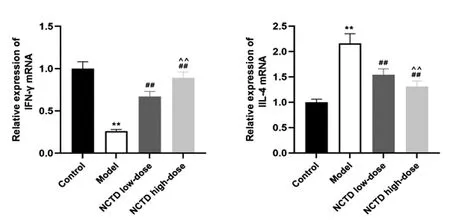
图3 实时荧光定量PCR检测各组大鼠结膜组织IL-4与IFN-γ mRNA表达注:与对照组比较,**P<0.01;与模型组比较,##P<0.01;与NCTD低剂量组比较,^^P<0.01
2.5去甲斑蝥素对AC大鼠VEGF相关途径蛋白表达的影响:免疫荧光染色观察各组大鼠角膜组织VEGF表达,可见对照组角膜组织中染色强度弱,VEGF阳性表达低;模型组中染色强度明显增强,VEGF阳性表达率较对照组显著增加(P<0.01);与模型组比较,NCTD低、高剂量组染色强度明显减弱,VEGF阳性表达率显著减少(P<0.01);NCTD高剂量组染色强度较低剂量减弱,VEGF阳性表达率显著减少(P<0.01),见图4。

图4 免疫荧光染色检测各组大鼠角膜组织VEGF表达(比例尺=50μm)注:与对照组比较,**P<0.01;与模型组比较,##P<0.01;与NCTD低剂量组比较,^^P<0.01
Western Blot检测结果显示,模型组结膜组织中VEGF、VEGFR2蛋白表达水平均较对照组显著上调(P<0.01);与模型组比较,NCTD低、高剂量组中VEGF、VEGFR2蛋白表达水平均显著下调(P<0.01);此外,NCTD高剂量组中VEGF、VEGFR2蛋白表达水平均较NCTD低剂量组显著下调(P<0.01),见图5。

图5 Western Blot检测各组大鼠结膜组织中VEGF、VEGFR2蛋白表达注:与对照组比较,**P<0.01;与模型组比较,##P<0.01;与NCTD低剂量组比较,^^P<0.01
3 讨 论
AC作为常见的眼病之一,可分为5种类型,包括季节性过敏性结膜炎(SAC)、常年性过敏性结膜炎(PAC)、巨乳头状结膜炎(GPC)、春季角结膜炎(VKC)以及特应性角结膜炎(AKC),后两种严重时可导致视力功能出现障碍。据统计,AC的发病率在全球范围内为6%~30%,除了过敏体质和遗传因素外,环境也是AC发生的重要危险因素,并与过敏性疾病密切相关,在过敏性鼻炎患者中有30%~70%的患者患有AC[2]。AC作为一种季节性且反复发作的疾病,严重时甚至会导致视力障碍,不仅影响了患者的日常活动,而且对其身心状态造成不利影响。目前,AC已被视为全球主要的公共卫生问题,对AC的治疗包括非药物治疗和药物治疗,包括识别和避免过敏触发因素和恶化因素,以及外用抗组胺药、肥大细胞稳定剂、非甾体抗炎药和类固醇等[11],然而,这些抗生素治疗的疗程较长,易产生耐药性,并具有一定的毒副作用,因此难以根除。AC的特征是炎细胞浸润,IgE能够与肥大细胞上的受体结合,通过分泌炎症因子引起一系列不良反应,因此,抑制炎症反应是缓解AC的一个关键环节。
NCTD作为一种有效的抗癌药物,已在临床上用于治疗癌症。随着分子生物学技术的发展及一些疾病治疗分子机制的深入探究,NCTD在一些炎症疾病和其他疾病中的作用也被揭示。例如,Shen等[12]研究表明NCTD能够降低胶原性关节炎大鼠的关节炎评分,减轻大鼠踝关节的病理改变,并抑制血清炎症因子水平,说明了NCTD对胶原性关节炎大鼠具有治疗作用;陈东军等[13]采用NCTD治疗增殖性狼疮性肾炎患者后发现,NCTD较单纯采用标准免疫抑制剂治疗具有更显著的临床疗效和良好的远期预后。鉴于以往这些研究结果,本实验通过在构建的AC大鼠模型中施以NCTD作用,结果显示出AC大鼠结膜充血红肿现象得到明显缓解,流泪和分泌物均减少,炎症评分也下降,经过眼部病理学检测显示AC大鼠角膜上皮细胞损伤和新生血管均减少,结膜杯状细胞数目增加。由此推测,NCTD对AC大鼠具有良好的治疗效果。
AC的发病机制十分复杂,目前尚未完全阐明,已知辅助性T细胞在免疫功能障碍中起着至关重要的作用,在AC致敏阶段,个体眼部暴露于由树突细胞和/或其他抗原呈递细胞处理和呈递新型过敏原的初始遗传易感性,会导致CD4幼稚细胞或辅助性T细胞的成熟并分化为Th2型细胞[14]。Th2细胞的致敏和分化需要树突状细胞呈递抗原,其主要通过释放IL-3、IL-4、IL-5、IL-9、IL-10和IL-13等因子参与IgE介导的过敏反应,阻止Th1细胞和自然杀伤细胞产生细胞因子,例如IL-2、IFN-γ,以妨碍T细胞介导的免疫反应。此外,Th1细胞能够抑制肥大细胞、嗜碱性粒细胞的分化和增殖。在正常情况下,机体内的Th1/Th2处于动态平衡状态,彼此之间相互调节以维持体内环境的稳定。Th1/Th2失衡是AC发生的一个重要机制,Th2及相关反应增强导致了炎细胞浸润。本研究显示,NCTD干预AC大鼠模型后检测相关指标,结果显示血清IL-2、IFN-γ含量升高,IL-4、IL-5及IL-10含量降低,结膜组织中IFN-γ mRNA表达上调,IL-4 mRNA表达下调,脾脏淋巴细胞中Th1细胞比例和Th1/Th2比值均增加,Th2细胞比例减少,可见NCTD能够调控AC大鼠的Th1/Th2失衡,这可能是其改善AC体征的重要机理。
血管形成由多种血管生成因子参与,该过程相对复杂,其中VEGF是关键的促血管生成因子,其能够促进血管和淋巴管内皮细胞的有丝分裂。已证实NCTD可抑制血管生成,诱导血管内皮细胞凋亡,下调血管生成因子如VEGF、VEGFR-2,并上调TSP和TIMP-2等抗血管生成因子的表达[8],因此,NCTD可能是一种潜在抗血管生成药物。本研究检测结果显示,NCTD干预AC大鼠模型后角膜组织内VEGF阳性表达率减少,结膜组织中VEGF、VEGFR2蛋白表达水平明显下调,进一步说明了NCTD抑制血管新生的作用。
综上所述,本研究显示在OVA刺激下可引起大鼠实验性过敏性结膜炎,而去甲斑蝥素能在过敏性结膜炎中减轻机体炎症反应,调节Th1/Th2平衡,并抑制VEGF及VEGFR2表达,从而起到缓解大鼠过敏性结膜炎的作用。本研究只对相关机制进行了初步探究,过敏性结膜炎病理机制复杂,将去甲斑蝥素应用于该疾病的治疗还需要进一步大量且深入的实验研究。
