GAB2在卵巢癌组织中的表达及其与预后的相关性
2022-04-28尹翼欧朝阳何爱琴
尹翼 欧朝阳 何爱琴
卵巢癌是女性生殖系统肿瘤中常见的恶性肿瘤之一,其发病率逐年增加[1-2]。由于疾病早期缺乏特异性症状,大多数患者发现时已处于晚期或发生远处转移[3]。临床上卵巢癌的标准治疗是肿瘤细胞减灭术联合以铂类为基础的化疗,尽管治疗后可达到完全缓解,但仍有约60%的卵巢癌患者会在5年内复发[4],而且大多数患者最终会发展为铂类耐药[5]。目前为止,卵巢癌的发生发展机制尚不清楚。因此,研究与卵巢癌恶性行为相关的分子调控机制并寻找新的治疗靶点至关重要。
GABs蛋白家族是一种高度保守的支架蛋白[6]。该家族结构具有同源性,包括N端PH结构域(N-terminal pleckstrin homology domain)、中央富含脯氨酸结构域和多重酪氨酸残基[7]。目前,许多证据表明GABs蛋白在多种癌症中异常表达,并参与多种细胞进程,如增殖、迁移和侵袭[8-9]。据报道,在乳腺癌细胞中GAB2的高表达增强了细胞的侵袭能力[10],卵巢癌细胞SKOV3和HO-8910中GAB2敲低后,肿瘤细胞的增殖能力显著下降,说明GAB2在卵巢癌发生发展中可能发挥了重要作用[11]。但是GAB2在卵巢癌组织中的表达及其与预后的关系尚不清楚。因此,本研究旨在评估卵巢癌组织中GAB2的表达及其预后价值。
1 资料与方法
1.1 一般资料
收集2013年1月—2016年1月在南通大学附属肿瘤医院手术切除的119例卵巢癌患者的癌组织及其癌旁组织(经病理证实未被癌累及的卵巢组织或输卵管组织)制成组织微阵列。收集这些患者的临床资料、血清肿瘤指标、影像结果和病理结果。119例标本包括101例浆液性癌、10例粘液性癌、2例子宫内膜样癌、3例透明细胞癌和3例其他类型卵巢癌。所有标本都由2位高年资的病理科医师重新阅片。本研究已获得南通大学附属肿瘤医院伦理委员会批准。
1.2 免疫组织化学染色法
采用免疫组化(SP)法对组织标本进行染色,切片厚度约4 μm,85℃烘箱烤片30 min,二甲苯脱蜡,乙醇脱水。碱性修复液高压加热进行抗原修复,冷却至室温,过氧化物酶阻断剂室温封闭20 min,一抗4℃过夜[GAB2(ab235932),稀释浓度为1∶50]。次日,复温至室温,DaKo免疫组化二抗室温孵育20 min,每个步骤之间用PBS缓冲液清洗 3次,每次5 min。DAB显色2 min,苏木素染色30 s,乙醇脱水,二甲苯脱蜡,中性树胶封片。
1.3 结果判定
GAB2染色阳性标准为胞浆着色,阴性标准为无胞浆着色,不论胞膜和胞核是否着色。按胞浆着色程度分为未着色、淡黄色、黄色、棕色或深棕色,所对应染色强度分别为-、+、++、+++,评分分别为0、1、2、3分。阳性细胞百分比<20%、21%~50%、51%~75%、>75%,评分分别为1、2、3、4分。综合评分为两项指标乘积。基于综合评分,根据受试者工作特征曲线(ROC)及约登指数计算最佳截断值,分为GAB2低表达组(<4)和高表达组(≥4)。
1.4 随访
所有患者在初始治疗结束后1年内每月随访1次,2年内每3个月随访1次,3~5年每4~6个月随访1次,5年以上者每年随访1次。根据病人对铂类化疗药物的敏感性,以初次治疗(达到临床缓解)停药后6个月为界,将复发性卵巢癌分为铂耐药性复发和铂敏感性复发,铂敏感性复发定义为发生在停药后6个月以上的复发,铂耐药性复发定义为发生在停药后6个月以内的复发。总生存期(Overall survival,OS)定义为从治疗开始至死亡或随访截止日期的时间。随访截止时间为2020年12月。中位随访时间74个月(60个月~81.24个月),随访结束后存活57人,死亡62人。
1.5 Nomogram预后预测模型
运用R 4.1.1中的survival和rms两个程序包构建Nomogram预后预测模型。使用Cox风险比例模型分析卵巢癌患者的独立预后因素并绘制列线图(Nomogram);根据不同危险因素对卵巢癌患者3年和5年生存率的影响程度,计算相应得分,根据总得分评估每个患者的生存率。
1.6 统计学方法
采用SPSS 25.0统计学软件,计量资料以均值±标准差表示,组间比较采用配对t检验。使用配对卡方检验分析癌与癌旁组织中GAB2的表达差异。使用卡方检验和连续性校正卡方检验分析GAB2表达与临床病理特征的关系,采用Kaplan-Meier生存曲线和Cox比例风险模型分析GAB2表达与卵巢癌患者预后的关系,P<0.05为差异具有统计学意义。
2 结果
2.1 卵巢癌组织和癌旁组织中GAB2的表达情况
利用免疫组织化学染色法检测组织芯片中119例癌组织及其癌旁组织中GAB2的表达情况。免疫组化染色结果显示,73例癌组织中GAB2高表达,43例癌旁组织中GAB2高表达,结果提示,GAB2在卵巢癌组织中表达上调(图1,表1)。

表1 GAB2在癌组织和癌旁组织中的染色情况
2.2 GAB2表达与卵巢癌患者临床病理特征的关系
基于GAB2在癌组织中的染色评分,利用ROC曲线及约登指数计算出最佳截断值为4,分为GAB2高表达组(≥4)和GAB2低表达组(<4)。GAB2表达量与FIGO分期、初诊时CA125水平和铂耐药性复发密切相关(P<0.05)(表2)。
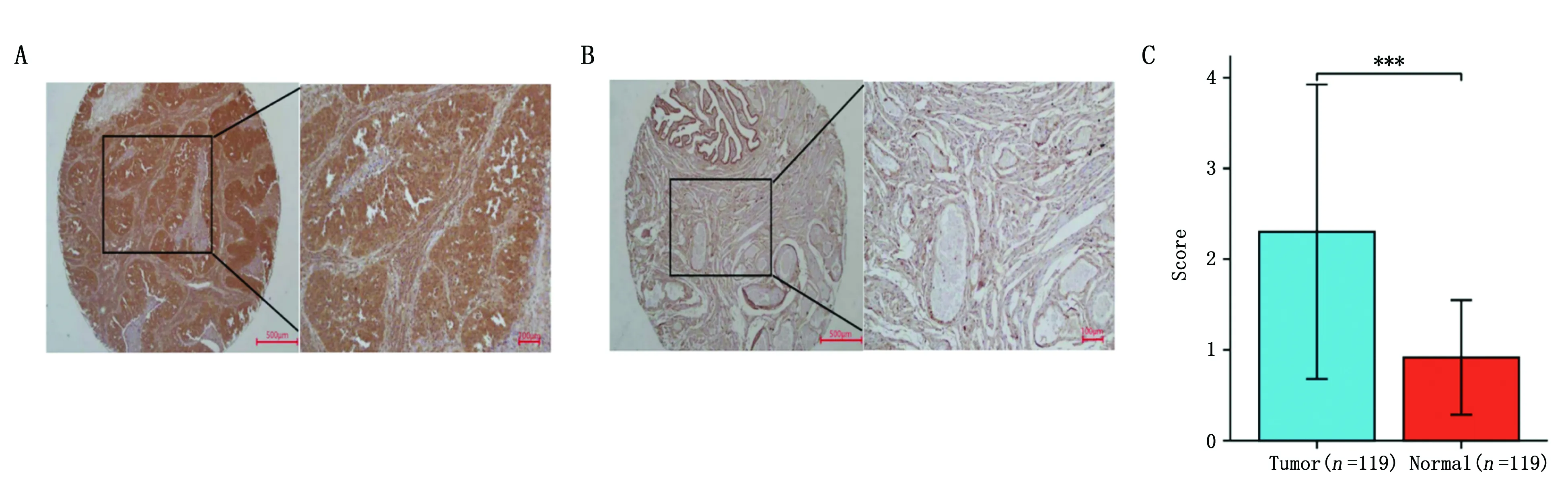
图1 GAB2在卵巢癌组织和癌旁组织中的表达差异Figure 1 The expression of GAB2 in ovarian tumor tissues and adjacent tissuesNote:A.The high expression of GAB2 in ovarian cancer tissues.B.The low expression of GAB2 in adjacent tissues.C.The statistical analysis of GAB2 expression in ovarian tumor tissues and adjacent tissues.***P<0.001.
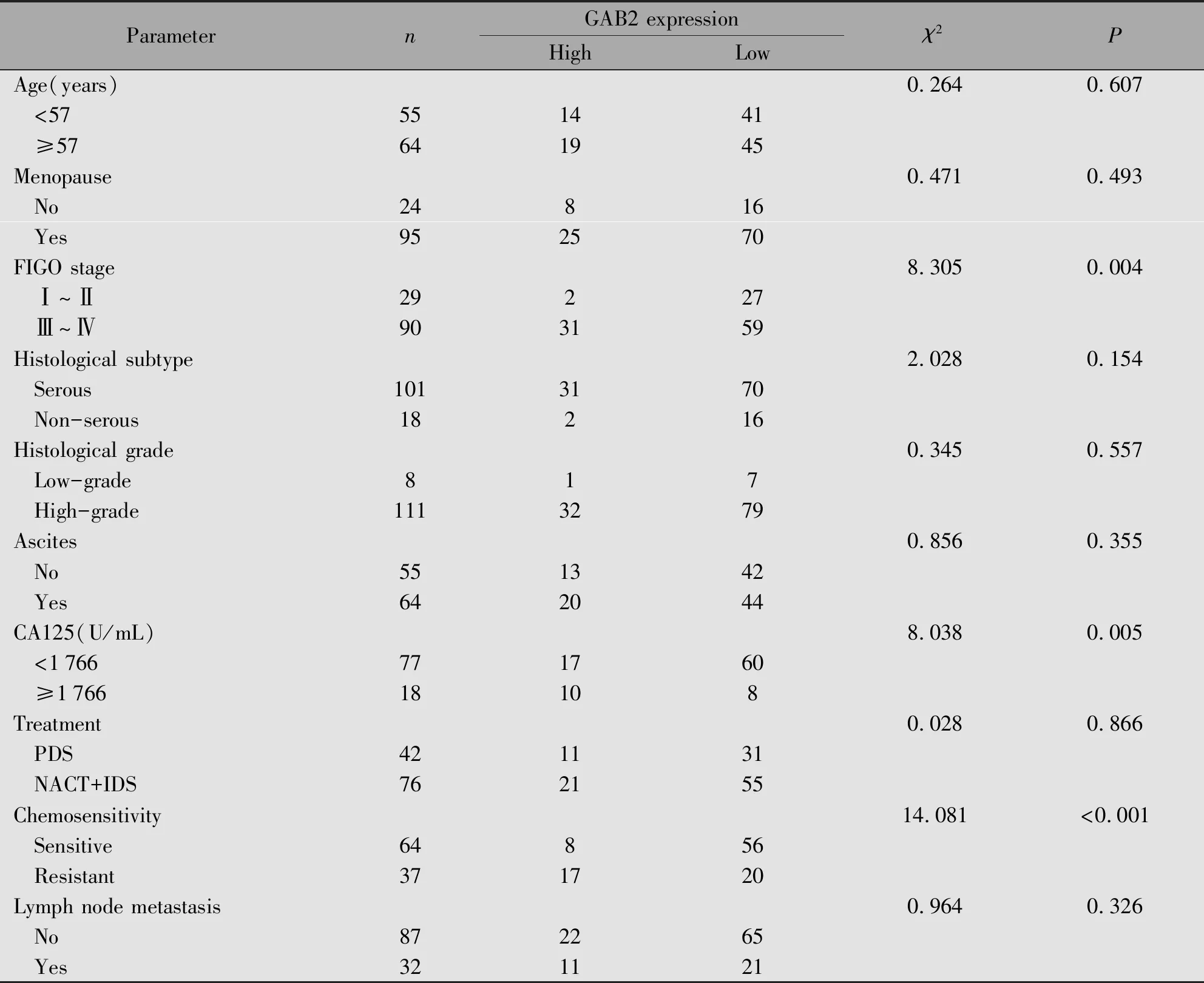
表2 GAB2表达与临床病理特征的关系
2.3 GAB2表达与卵巢癌患者预后的关系
GAB2高表达卵巢癌患者的中位OS为20个月(95%CI:16.28~24.15),GAB2低表达卵巢癌患者的中位OS为49.5个月(95%CI:43.75~52.25)。Kaplan-Meier生存曲线分析结果显示,与GAB2低表达组比较,GAB2高表达的卵巢癌患者的OS较差(χ2=69.692,P<0.001)。然后,根据分期情况将119例患者分为FIGO Ⅰ~Ⅱ期亚组和FIGO Ⅲ~Ⅳ期亚组,分层分析结果显示,FIGO Ⅰ~Ⅱ期亚组中,GAB2表达量与OS无相关性(χ2=1.315,P=0.252)。而FIGO Ⅲ~Ⅳ期亚组中,GAB2高表达与卵巢癌患者不良预后相关(χ2=53.991,P<0.001)(图2)。
2.4 Cox比例风险模型分析影响卵巢癌患者预后的危险因素
单因素Cox分析结果显示,GAB2表达量、分期、初诊时CA125水平、铂耐药性复发可能与卵巢癌患者OS相关(P<0.05)(表3)。多因素Cox回归分析结果表明,GAB2表达量、铂耐药性复发是影响卵巢癌患者OS的独立危险因素(P<0.05)(表3)。
2.5 Nomogram预后模型预测卵巢癌患者5年生存率
为了更准确的预测卵巢癌患者的生存率,本研究在Cox比例风险模型的基础上构建了Nomogram预后模型来预测患者的3年和5年生存率(图3)。结果显示,Nomogram预后模型能较准确的预测卵巢癌患者3年和5年生存率(C指数为0.801,95%CI:0.781~0.822),并且该预后模型的预测能力较好(3年AUC=0.927,5年AUC=0.809)。
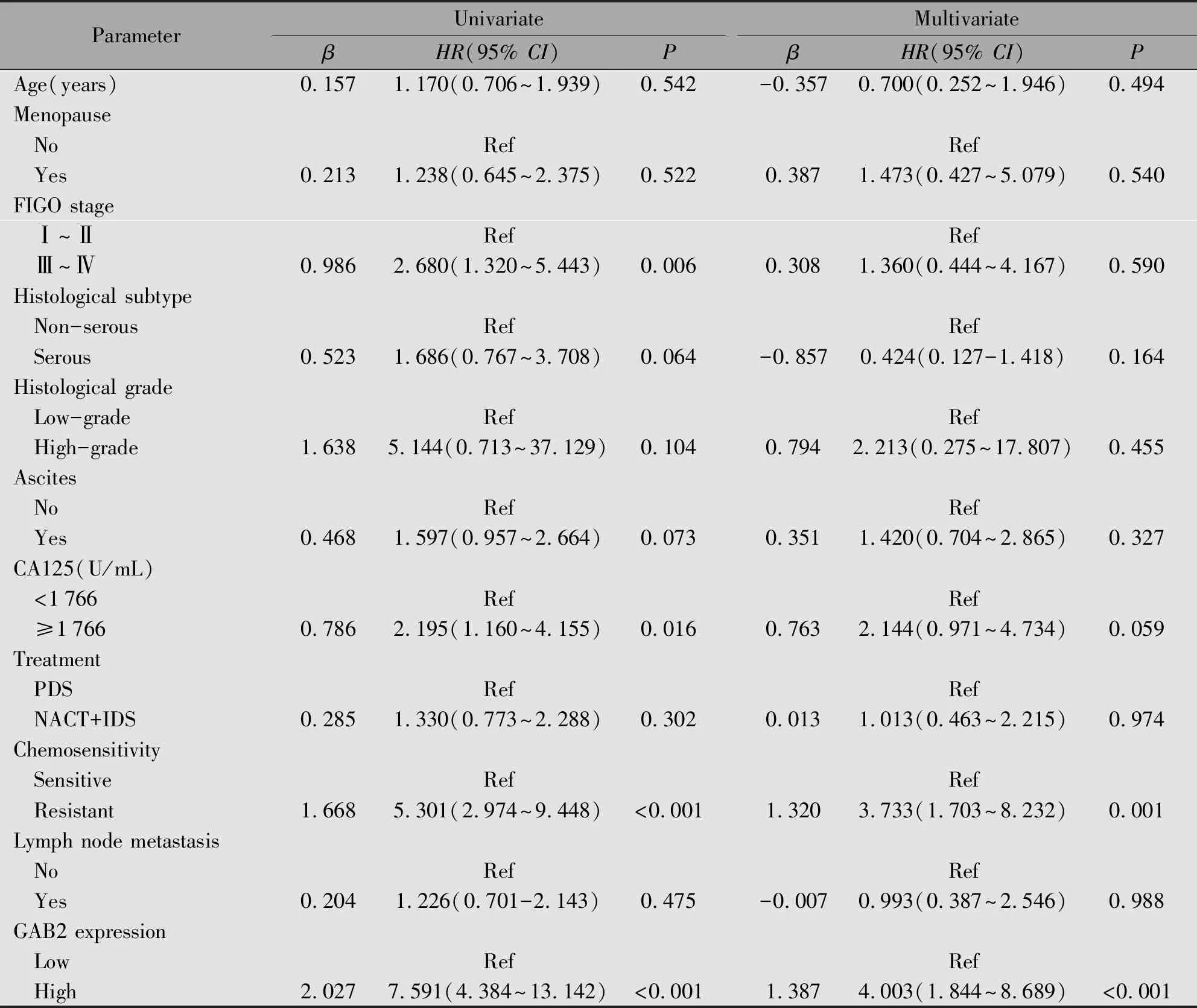
表3 单因素和多因素Cox比例风险模型预测影响卵巢癌患者OS的危险因素
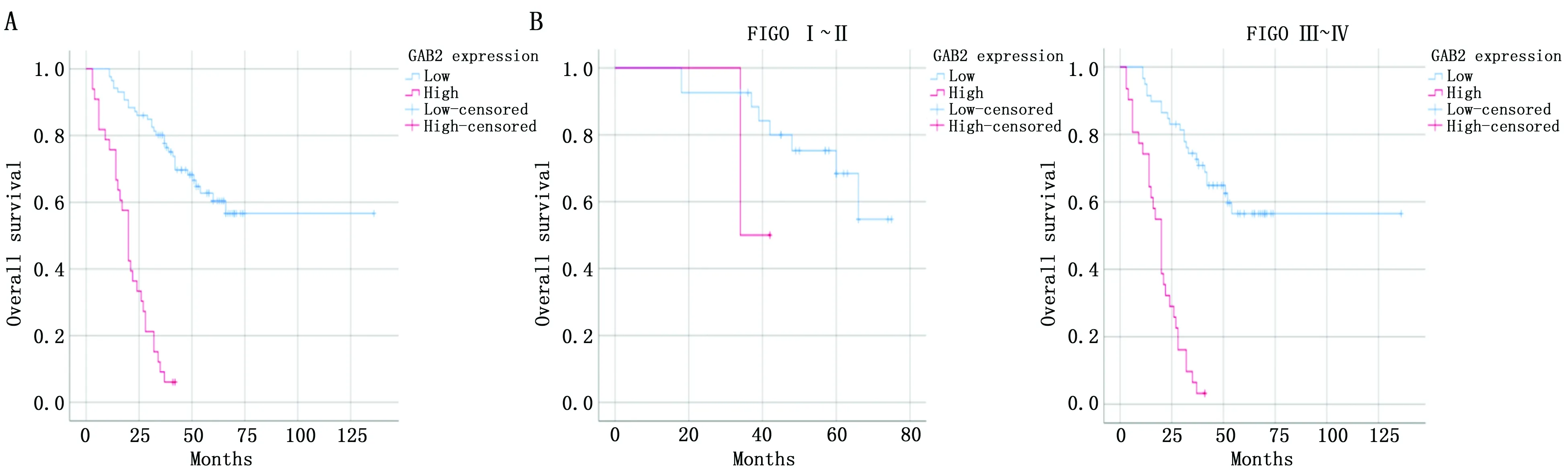
图2 Kaplan-Meier曲线分析GAB2表达与卵巢癌患者预后的关系Figure 2 Kaplan-Meier curves were used to analyze the relationship between GAB2 expression and prognosis of ovarian cancer patientsNote:A.Overall survival curves of GAB2 in the high expression group and low expression group;B.Survival curves of GAB2 in the high expression group and low expression group as well as FIGO I-II and FIGO III-IV subgroups.

图3 Nomogram预后预测模型Figure 3 The Nomogram prognostic modelNote:A.Nomogram prognostic model;B.Calibration curve;C.ROC curve.
3 讨论
在女性生殖系统肿瘤中,卵巢癌发病率次于宫颈癌和子宫体癌,但是死亡率却居首位。据统计,2020年全球卵巢癌新增病例313 959例,死亡207 252例[12]。由于卵巢癌的发病隐匿、高转移性和治疗后易发生化疗耐药[13],使卵巢癌的治疗成为一个难点。因此,监测卵巢癌预后和寻找新的治疗靶点就显得尤为重要。
GAB2位于人染色体11q13.4-q13.5,分子量97~100 kD[14]。GAB2作为一种支架蛋白,不仅参与信号传递,在肿瘤的发生发展中也发挥了重要作用。GAB2主要通过两种信号传导途径促进肿瘤发生发展。在GAB2-SHP2介导的RAS/ERK途径中,酪氨酸磷酸酶(SHP2)是GAB2下游的重要效应蛋白。GAB2与SHP2相互作用后激活下游RAS,继而促进肿瘤发展[15-16]。据报道,GAB2过表达激活了SHP2-RAS-ERK途径,增强了神经母细胞瘤的诱导,并增加了肿瘤的渗透性[17]。GAB2参与信号转导的另一条通路是PI3K/AKT信号通路。GAB2在细胞因子作用下发生磷酸化,磷酸化后的GAB2作用于PI3K的p85亚基,诱导PI3K的激活,继而发挥促癌的作用[18]。Tian等[19]报道GAB2通过PI3K/AKT途径促进前列腺癌的增殖、侵袭和上皮-间质转化(EMT)。也有研究证实,大肠癌组织中GAB2表达上调与VEGF水平呈正相关。GAB2高表达促进结直肠癌细胞的增殖和克隆形成,而沉默GAB2则抑制其增殖和克隆形成[20]。Duckworth等[21]研究证明,在GAB2缺陷的裸鼠模型中,GAB2的缺失能抑制肿瘤细胞增殖、血管生成和腹膜肿瘤生长。同时,也有研究报道,GAB2表达与卵巢癌患者预后的关系,GAB2的高表达与卵巢癌中较短的无进展生存率有关[22]。为了进一步探索GAB2与卵巢癌患者预后的关系,本研究在组织芯片中比较了119例卵巢癌组织和癌旁组织中GAB2的表达差异,并分析了其表达水平与卵巢癌患者预后的关系。结果显示,与癌旁组织相比,GAB2在卵巢癌组织中表达水平显著升高,并且,GAB2的表达水平与FIGO分期、初诊时CA125水平和铂耐药性复发均有显著相关性。Kaplan-Meier生存曲线分析结果也表明,与GAB2高表达组的患者相比,GAB2低表达组的患者生存明显较长。Cox比例风险模型分析结果表明,GAB2表达水平是卵巢癌患者的独立预后因素。
本研究首次在组织芯片中分析GAB2在卵巢癌组织中的表达及其与预后的关系。但是,在Cox回归模型分析过程中,我们发现分级与患者预后之间无明显相关性,这似乎与临床不符。我们分析这可能是由于制作组织芯片前我们筛选的病人存在偏倚所造成,所纳入的病人中低级别8例,高级别111例。因此,GAB2与卵巢癌患者临床特征及预后的关系仍需要更大样本量的研究。
综上所述,GAB2在卵巢癌发生发展中可能起到促癌作用,并且GAB2表达与卵巢癌患者的预后相关,可作为影响卵巢癌患者预后的独立危险因素。这些都提示GAB2有望成为临床上监测卵巢癌患者预后的有效指标,为卵巢癌的治疗提供新的靶点。
