ILF2及NF90在口腔鳞状细胞癌中的表达及临床意义
2022-04-28王雪高雨蔚宋红权张兴伟杨帆焦晓辉
王雪 高雨蔚 宋红权 张兴伟 杨帆 焦晓辉
头颈部鳞状细胞癌是全球第六大常见癌症,而口腔鳞状细胞癌(Oral squamous cell carcinoma,OSCC)是其中的主要类型[1]。根据GLOBOCAN最新的统计结果,2020年OSCC新发病例高达377 713例,死亡病例达到177 757例[2]。尽管OSCC的治疗手段不断改进,但仍然以手术治疗为主,放化疗为辅,患者5年生存率未见明显改善[3]。因此,积极寻找OSCC新的诊断标志物、治疗靶点以及预后评估指标至关重要。
白细胞介素增强结合因子2(Interleukin enhancer-binding factor 2,ILF2)位于人类1号染色体1q21.3区,由ILF2基因编码[4];核因子90(Nuclear factor 90,NF90),位于人类19号染色体,由ILF3基因编码[5]。二者最早在Jurkat T细胞中被发现,普遍表达于人体组织细胞核中[4-5]。ILF2与NF90可以结合,形成异二聚体复合物,共同参与DNA损伤修复、转录和翻译、调控miRNA等[6]。研究发现,ILF2和NF90与多种肿瘤的发生发展密切相关,但与OSCC的相关研究却未见报道。本研究通过免疫组化(Immunohistochemistry,IHC)及实时荧光定量检测(Quantitative real-time PCR,qRT-PCR)方法探究了ILF2和NF90在OSCC组织中的表达及临床意义,以期为OSCC的早期诊断、治疗方法选择以及预后评估提供新的思路。
1 材料和方法
1.1 组织标本
选取2014年1月—2019年12月就诊于哈尔滨医科大学附属口腔医院的初发OSCC患者石蜡标本66例,男性患者40例,女性患者26例,年龄36~88岁;组织病理分级(参考WHO分级标准):高分化36例,中低分化30例;TNM分期(参考国际抗癌联盟第六版):T1~T2期27例,T3~T4期39例;淋巴结转移25例,无淋巴结转移41例。选取30例非肿瘤患者正常口腔黏膜组织石蜡标本作为对照组,男15例,女15例;年龄25~87岁,平均(54.16±17.23)岁,两组间性别和年龄无统计学差异(P>0.05)。以上标本用于IHC实验。选取2019年9月—2020年12月就诊于哈尔滨医科大学附属口腔医院确诊为OSCC患者的新鲜组织标本20例,同一患者的正常口腔黏膜(Normal oral mocusa,NOM)组织作为对照组,男11例,女9例;年龄45~82岁,平均(58.75±8.15)岁,置于-80℃冰箱冻存,用于qRT-PCR实验。本实验所有患者均行手术治疗,术前均未经其他治疗,标本经病理证实,获得患者知情同意和本院伦理委员会同意,所有病例临床资料完整。
1.2 IHC
将蜡块切成厚度为4 μm的切片,常规HE染色,镜下确认病理分型。将切片经过复水及抗原修复后,滴加兔抗人ILF2抗体一抗(1∶100),兔抗人NF90抗体一抗(1∶100),静置冲洗后滴加广谱二抗,DAB显色后复染后冲洗,常规脱水、透明、封片。
实验结果判读由两位专职病理医生各自独立操作,评估采用双盲法,以细胞中出现棕黄色颗粒为阳性信号。(1)以半定量积分法进行阳性结果判断,目标蛋白染色为无着色计0分、浅黄色计1分、棕黄色计2分、棕褐色计3分;(2)阳性比例按视野内阳性细胞所占总细胞数的比例记分,无计为0分、≤25%计1分、26%~50%计2分、51%~75%计3分、>75%计4分;(3)将每张切片于400倍视野下随机选取5个组织视野,对所有视野分别计分,并将以上两种计分结果相乘,低表达组≤4分,计为阴性(-);高表达组>4分,计为阳性(+)[7]。
1.3 qRT-PCR
利用TRIpure裂解液提取组织中的总RNA,使用紫外分光光度计测定各样本中RNA的浓度,使用PCR仪将上述得到的RNA,以β-actin为内参逆转录成cDNA,引物序列见表1,最后使用荧光定量仪进行定量分析。采用2-△△Ct法进行实验数据计算。
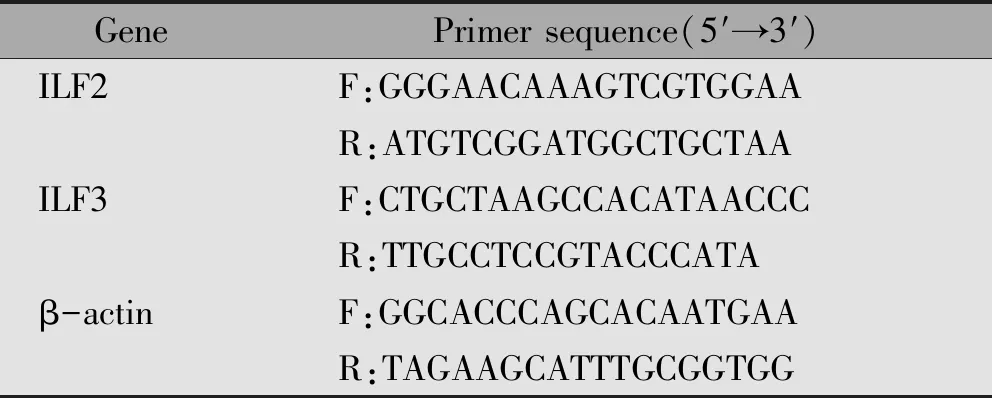
表1 PCR引物序列
1.4 随访
采用电话随访的方式记录总生存期(Overall survival,OS)。OS为自手术开始至患者死亡或随访截止的时间。随访时间范围为11~81个月,中位随访时间为28个月,随访截止时间为2020年12月31日。
1.5 ILF2和NF90的生物信息学分析
基于Oncomine数据库(https://www.oncomine.org/resource/login.html)对ILF2和NF90进行分析,分析两者在OSCC组织和NOM组织中的表达差异。基于GEPIA数据库(http://gepia.cancer-pku.cn/)对ILF2和NF90在OSCC中的相关性进行分析。
1.6 统计学分析
2 结果
2.1 ILF2及NF90的表达情况
IHC结果显示,在OSCC和NOM组织中,ILF2主要定位于细胞质,NF90主要定位于细胞核(图1)。其中,在OSCC组织切片中,ILF2和NF90的阳性表达率分别为68.2%和62.1%;在NOM组织切片中,ILF2和NF90的阳性表达率分别为36.7%和30.0%,ILF2和NF90在OSCC组织中的阳性表达率高于NOM组织(P=0.004)(表2)。
qRT-PCR结果显示,与NOM组对比,ILF2和NF90在OSCC组织中均高表达,差异具有统计学意义(P<0.001)(图2)。
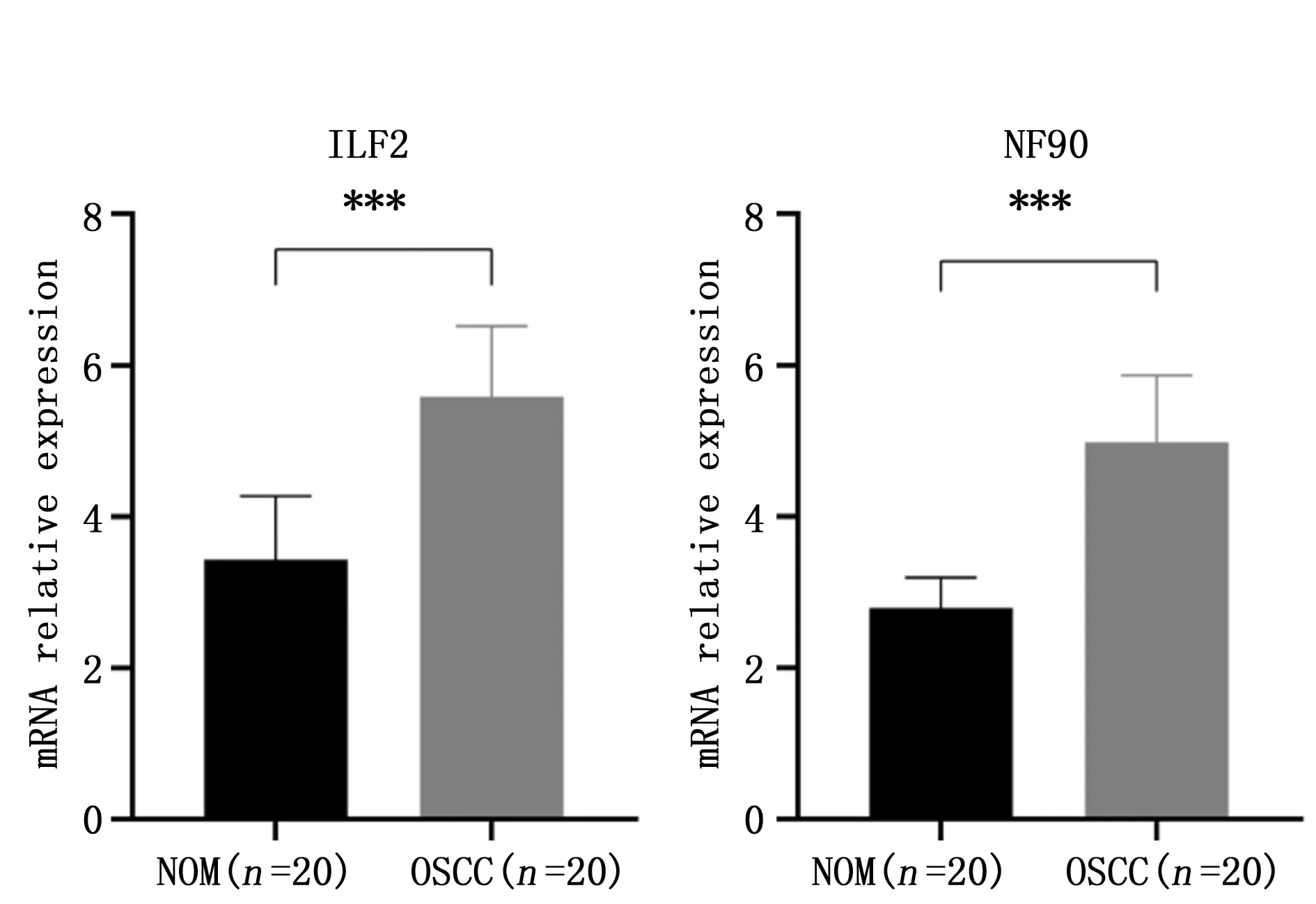
图2 ILF2 mRMA和NF90 mRNA在OSCC与NOM 组织中的表达Figure 2 The mRMA expression of ILF2 and NF90 in OSCC and NOM tissuesNote:***P<0.001,when compared with the NOM group.
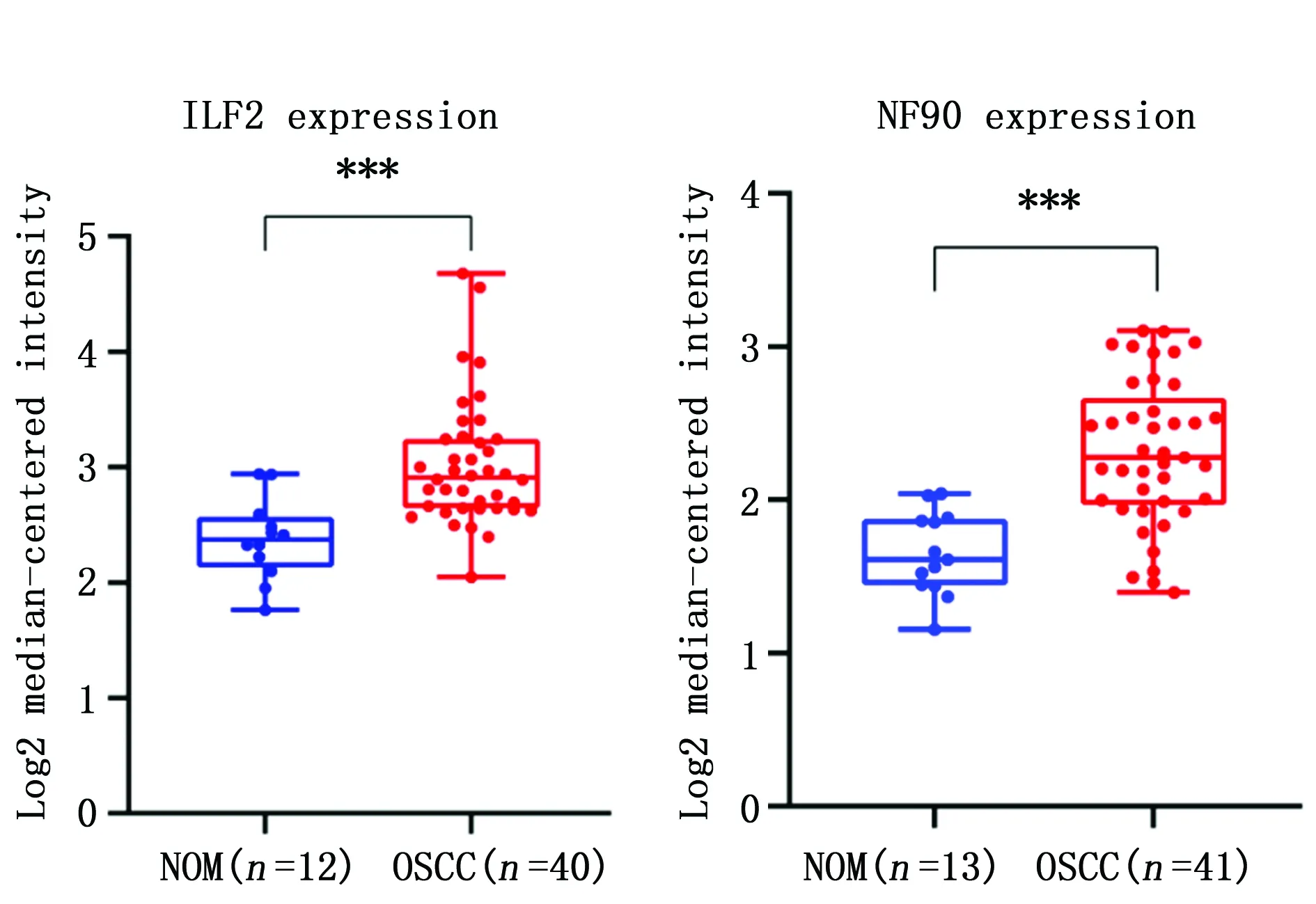
图3 Oncomine数据库分析ILF2和NF90在OSCC和NOM组织中的表达情况Figure 3 The expression of ILF2 and NF90 in OSCC and NOM groups by the Oncomine biological information databaseNote:***P<0.001,when compared with the NOM group.
Oncomine数据库分析发现,与NOM组织比较,ILF2和NF90在OSCC中同样高表达(P<0.001)(图3)。
2.2 ILF2和NF90的表达与OSCC患者临床病理特征之间的关系
ILF2及NF90与TNM分期、肿瘤分化程度及淋巴结是否转移有关(P<0.05),而与OSCC患者的年龄、性别及是否吸烟无关(P>0.05)(表3)。
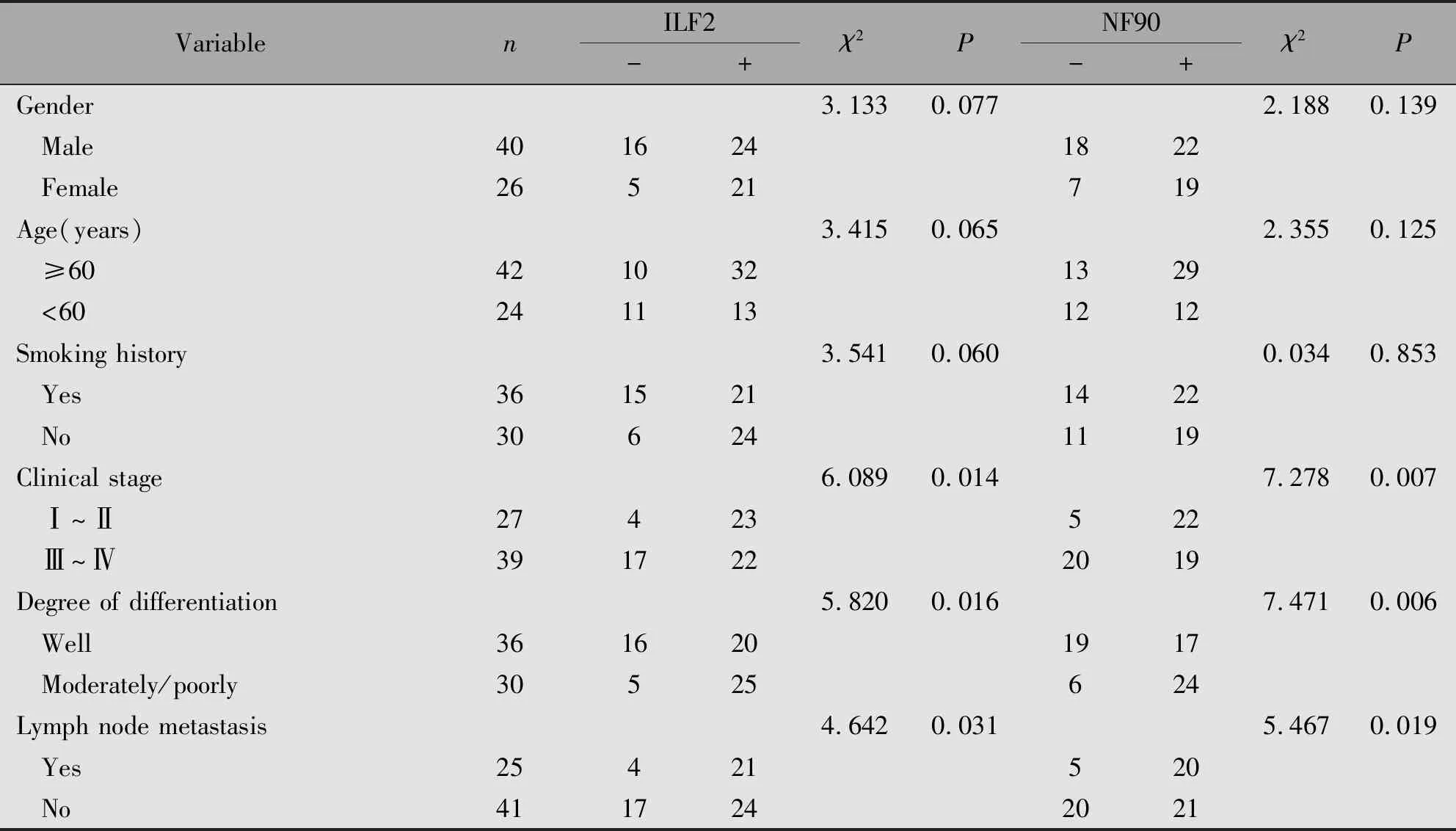
表3 66例OSCC患者ILF2、NF90的表达与临床病理特征的关系
2.3 ILF2与NF90在OSCC中的共表达分析
ILF2与NF90共阳性表达36例,共阴性表达16例,ILF2与NF90在OSCC中的表达存在相关性(φ=0.540,P<0.001)(表4)。GEPIA数据库分析结果显示,ILF2与NF90在OSCC组织中的表达呈正相关(r=0.600,P<0.001)(图4)。
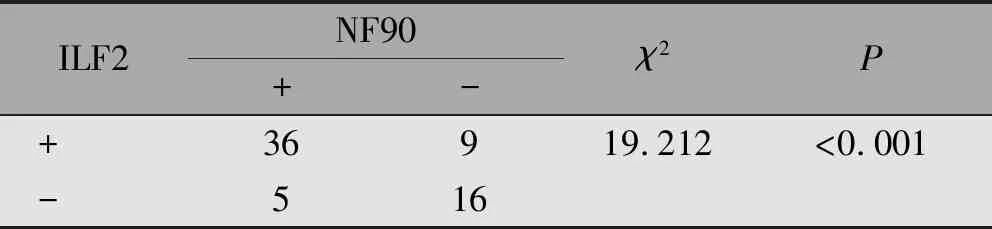
表4 OSCC组织中ILF2、NF90表达的相关性

图4 GEPIA数据库显示ILF2和NF90(ILF3)在OSCC组织中的表达成正相关Figure 4 A positive correlation between the expression of ILF2 and NF90(ILF3)in OSCC tissues by the GEPIA database
2.4 ILF2和NF90表达与OSCC预后的关系
单因素Cox回归分析显示,ILF2高表达(HR=3.184,P=0.006)、NF90高表达(HR=4.425,P<0.001)、肿瘤分化程度(HR=5.025,P<0.001)、淋巴结是否转移(HR=1.385,P=0.046)可能是患者OS影响因素。多因素Cox回归分析表明,ILF2高表达(HR=2.786,P=0.041)、NF90高表达(HR=2.392,P=0.042)、肿瘤分化程度(HR=5.618,P<0.001)是影响患者OS的独立危险因素(表5)。
Kaplan-Meier法和Log-rank检验分析结果显示,ILF2高表达患者较低表达患者的预后差(P=0.007);同样,NF90高表达患者的预后较低表达患者的预后差(P=0.001)(图5)。
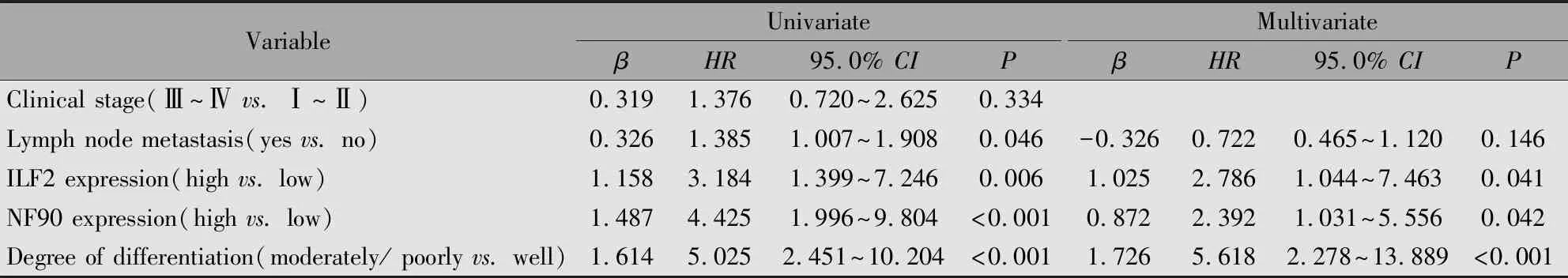
表5 OSCC患者OS影响因素的Cox单因素及多因素分析
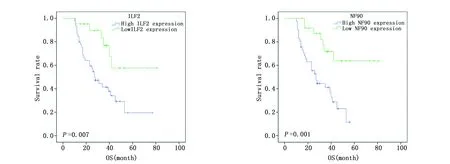
图5 ILF2和NF90高表达及低表达患者的生存曲线Figure 5 Survival curves for patients with high and low expression of ILF2 and NF90
3 讨论
OSCC是口腔癌最常见的类型,5年生存率约50%,但早期发现和适当治疗可使治愈率提高到80%左右[8]。因此,专家学者致力于寻找OSCC的早期诊断和治疗方法。本研究通过探究ILF2及NF90在OSCC中的表达及其临床意义,为OSCC的早期诊断和治疗提供新的依据。
ILF2和NF90在许多恶性肿瘤中高表达,如肺非小细胞癌、食管鳞状细胞癌、乳腺癌、宫颈癌、肝细胞癌、胰腺癌及鼻咽癌等[9-17]。ILF2通过促进14-3-3ε蛋白的表达,激活其下游的Tiam1/Rac1通路,进而促进食管鳞状细胞癌的侵袭与增殖[10],而Tiam1/Rac1能重组肿瘤细胞的骨架结构,影响细胞形体极化过程,促进肿瘤细胞运动和迁移,并参与基因表达调控、细胞增殖与凋亡[18]。早期转移的肿瘤细胞必须对抗失巢凋亡,才可能脱离原发灶独立生存,具有锚定独立性。ILF2通过抑制磷酸酶和紧张素同源物增强非小细胞肺癌细胞的锚定独立性,抵抗肿瘤细胞的失巢凋亡[19],进而促进了肿瘤细胞的转移。NF90通过PI3/AKT通路调节宫颈癌细胞血管内皮生长因子A的表达,从而调控宫颈癌肿瘤血管的生成,沉默NF90后,宫颈癌肿瘤生长被明显抑制[13]。本研究表明ILF2、NF90在OSCC中的表达与TNM分期、肿瘤分化程度及淋巴结是否转移相关,我们合理推测ILF2及NF90在OSCC中也可能通过上述机制来促进肿瘤细胞的生长、侵袭与转移。
ILF2和NF90复合物也与多种恶性肿瘤发生发展息息相关。在本实验中,ILF2及NF90在OSCC组织中高表达且两者呈正相关,我们合理推测两者可能是以复合物的形式参与OSCC的发生发展。MicroRNA-7(miR-7)在多种肿瘤中被证实起到抑癌作用,在胰腺癌中,miR-7通过调节ILF2发挥其抑癌基因的作用[16]。在肝细胞癌中也存在相似的机制,ILF2和NF90复合物,通过抑制miR-7促进肝细胞癌的增殖[15],因此在OSCC中,是否也存在类似的机制值得我们进一步探究。长链非编码RNA(Long non-coding RNAs,lncRNAs)是一组长度超过200个核苷酸且缺乏蛋白质编码能力的RNA分子,其与肿瘤进展和转移相关。lncRNA中有一种分化对抗非蛋白编码RNA(Differentiation antagonizing non-protein coding RNA,DANCR),具有抑制表皮细胞分化功能,促进多种癌症的进展和恶化过程。DACNR通过与ILF2和NF90复合物相结合,使缺氧诱导因子-1α(Hypoxia inducible factor-1α,HIF-1α)的稳定性增加,从而促进鼻咽癌细胞迁移和侵袭[20]。而且已有报道表明HIF-1α在OSCC中高表达[21],所以在OSCC中,ILF2和NF90复合物、DANCR及HIF-1α的关系也值得进一步研究。
有研究表明ILF2和NF90复合物与p53基因相关。二者的复合物在来自HPV感染的肿瘤细胞系中有抑制p53表达的作用。通过敲低ILF2和NF90复合物可以抑制病毒E6的表达,从而抑制p53的降解,恢复p21等因子的功能。这些因子依赖p53的调控,能够在照射和化疗药物治疗后的肿瘤中,有效激活肿瘤细胞的凋亡[22],这为OSCC患者的非手术治疗提供了新靶点。
ILF2的低表达能够下调着丝粒相关蛋白E对乳腺癌细胞增殖的抑制[23]。ILF2也可作为一种乳腺癌预后生物标志物,也可以预测新辅助化疗反应[11]。NF90作为泛素特异性蛋白酶11(Ubiquitin-specific protease 11,USP11)的下游基因,与USP11结合并去泛素化,从而稳定蛋白表达水平,促进肝癌细胞增殖和转移[14],NF90被敲除后,肝癌细胞的增殖显著降低。NF90与LincIN结合,与晚期的乳腺肿瘤的转移相关[24]。本研究中ILF2及NF90高表达的OSCC患者OS较短,并且是影响OSCC患者OS的独立危险因素,因此ILF2及NF90也可能作为OSCC预后评估的新指标。
综上所述,ILF2及NF90可为OSCC的诊断、治疗及预后评估提供新的思路,但是二者在OSCC中的具体作用还需要进一步的研究。
