恶性颈动脉体瘤1例并文献复习
2022-04-28陈冬格马迎春杨艳丽刘斌
陈冬格,马迎春,杨艳丽,刘斌
1联勤保障部队第九四〇医院病理科,兰州 730050
2甘肃中医药大学基础医学院,兰州 730000
颈动脉体瘤(carotid body tumor,CBT)属于头颈部副神经节瘤,其发生率不足0.03%,是一种罕见的化学感受器瘤[1]。CBT主要位于颈动脉分叉处,多为良性,恶性表现多为公认的出现淋巴结和(或)远处转移。目前,CBT的相关报道多为外科手术诊治经过,临床与病理结合的研究较为少见,且对其良恶性的鉴别诊断还有待进一步探索。本文报道1例恶性CBT伴淋巴结转移患者,旨在探讨CBT的临床病理特征、诊断及鉴别诊断等,提高对其认识水平,为CBT患者的治疗提供可靠依据。
1 病历资料
患者女,54岁,因发现右侧颌下肿物1年余入院。患者于2018年3月无意中发现右侧颌下肿物,查体测得肿物大小约1 cm×1 cm,无疼痛、瘙痒症状,未给予重视。2019年开始逐渐增大,再次查体发现肿物增大至3 cm×2 cm,无发热、乏力、心悸、气短、呼吸困难症状,无午后低热、盗汗、皮肤潮湿症状。遂于2019年2月在当地医院就诊,B超检查提示右侧颈部淋巴结肿大。患者2019年4月8日于联勤保障部队第九四〇医院入院治疗,血管造影提示右侧CBT。由于患者同侧颈外动脉供血,大脑前动脉间交通代偿较差,未达到手术指征而未进行治疗。出院后患者为求进一步诊治,于2019年6月10日再次就诊,MRI检查显示右侧颈部软组织间隙内可见一团块状占位,位于颈内动静脉、颌下腺、腮腺、胸锁乳突肌之间,边界较清,大小约2.5 cm×2.3 cm×4.5 cm(图1)。完善相关检查后,于2019年6月18日行颌面颈部深部肿物探查,并进行CBT切除+血管移植术、周围神经嵌压松解、血管危象探查修复术。
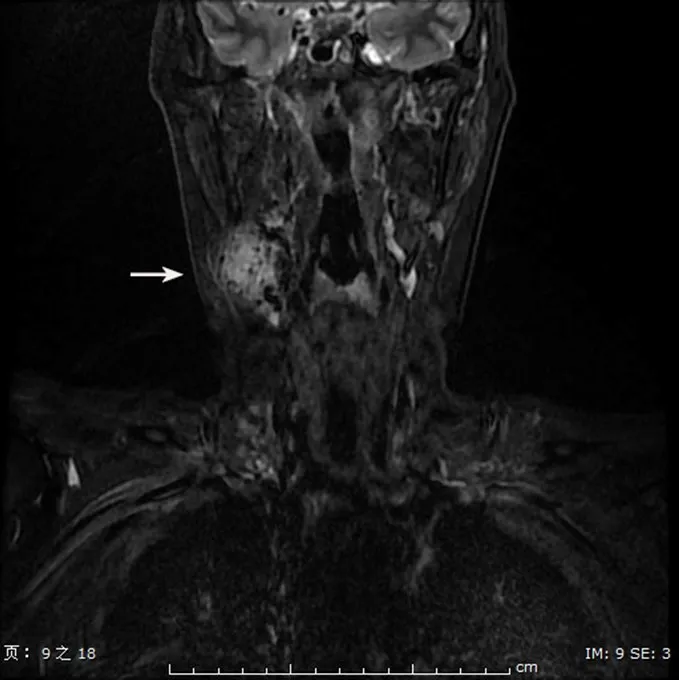
图1 CBT患者的MRI图像
手术过程:患者取仰卧位,头偏左侧,经鼻气管插管复合静脉全身麻醉,常规颌面、颈部消毒、铺巾。于右侧颈部颈动脉表面做弧形切口,长约13 cm,切开皮肤、皮下及颈阔肌,分离颈动脉鞘,显露颈动脉分叉区肿瘤及颈总动脉,充分暴露术野,于右侧颈动脉鞘处可见一瘤体,瘤体与颈部血管无明显粘连,于肿瘤下方颈外动脉远心端结扎,分离并保护舌下神经,沿肿瘤瘤体周缘分离,结扎瘤体血管,完整分离出肿瘤,大小约3 cm×2 cm,进行术中冰冻病理检查,结果显示右侧CBT。于颈动脉鞘深处见一瘤体,瘤体与颈总动脉和颈内动脉紧密粘连,分离并保护迷走神经,沿肿瘤瘤体周缘分离,结扎瘤体血管,在分离瘤体与颈动脉时,颈动脉分叉处破裂出血,立即钳夹颈动脉近、远心端,升高血压并增加灌注,剪除与瘤体粘连的动脉,约1 cm,使用prolene线缝合颈动脉,血管通畅无出血,搏动有力,血压正常。于下颌及颈部分离出3个约0.3 cm×0.2 cm的瘤体,将分离的瘤体送病理检查。手术中采取自体血回收装置。术中清创、严密止血并冲洗,于术区放置负压引流装置,固定,分层缝合伤口。手术过程顺利,术中出血800 ml,术中输液2700 ml,术中输红细胞 800 ml,尿量 1000 ml,术后患者生命体征平稳,送入麻醉恢复室。
病理检查:①巨检。发现灰红色结节状组织,大小为3.0 cm×2.0 cm×1.5 cm,周围少许脂肪组织,表面带包膜,切面灰红色,实性,质中,与周围界清。②镜检。肿瘤实质由主细胞和支持细胞构成。主细胞排列呈腺泡状或巢状,周围可见梭形的支持细胞,间质血管丰富。主细胞为圆形或多边形,细胞质丰富,嗜酸性,呈空泡状,边界不清,部分可见多核瘤巨细胞。核无明显异型性,可见核分裂象。淋巴结中可见肿瘤组织浸润(图2A~2C)。③免疫组化染色。嗜铬粒蛋白A(chromogranin A,CgA)(+)、突触素(synapsin,Syn)(+)、S100散在(+)、琥珀酸脱氢酶B(succinate dehydrogenase subunit B,SDHB)灶性(+)、CD34血管(+);广谱细胞角蛋白(pan cytokeratin,pan-CK)(-)、CD20(-)、CD3(-)、CD68(-);Ki-67<5%(图2D)。病理诊断:(右侧颈部)恶性副神经节瘤,淋巴结转移。
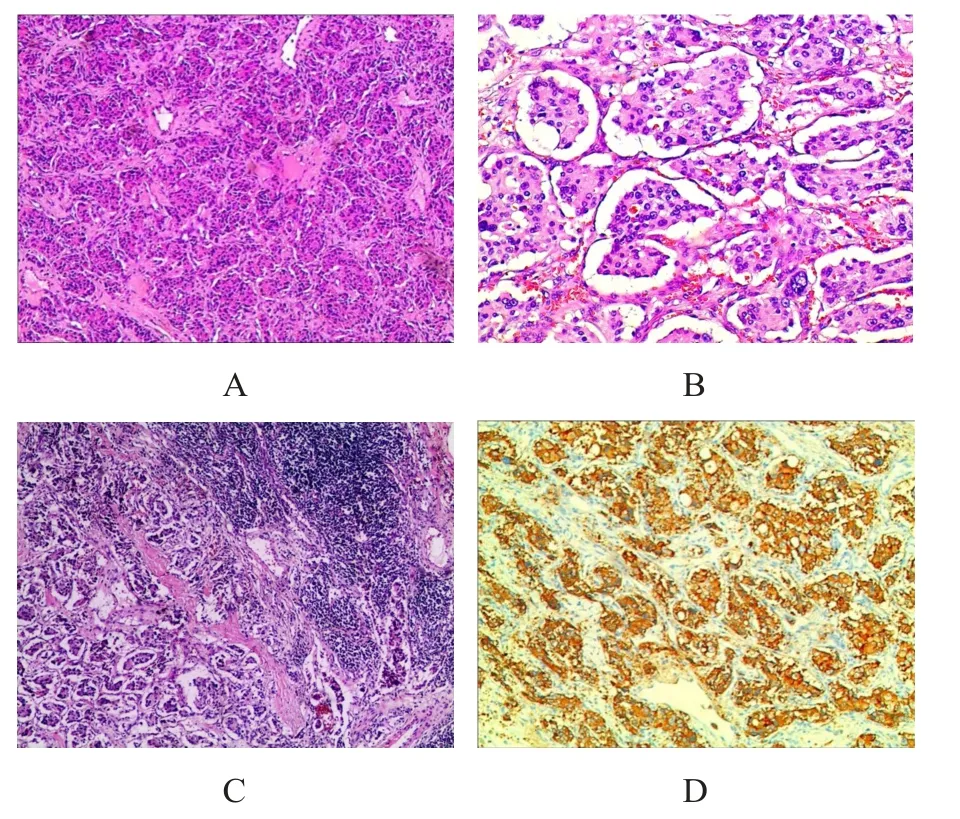
图2 CBT 患者的免疫组化染色结果
术后治疗及预后:术后给予抗感染、止血等支持治疗,患者病情恢复良好,伤口愈合良好,10天后出院。目前随访26个月,患者全身状况良好,未见复发及转移。
2 讨论
CBT占头颈部副神经节瘤的70%左右,其中家族型占10%;CBT生长缓慢,大多为良性,恶变率不足10%[2]。研究显示,CBT的发病率男女之比为1∶1.9,40~50岁为发病高峰且高海拔地区的发病率较高[3]。这可能是由于缺氧导致颈动脉体长期增生,进而促进肿瘤的发生。笔者查阅联勤保障部队第九四〇医院病理科近10年的档案资料,发现9例CBT患者,89%为女性,发病年龄为31~55岁,平均(47.22±8.08)岁,多以无痛增大肿物就诊,均为良性(表1)。

表1 9例CBT患者的临床特征
CBT多表现为单侧颈部无痛肿块,散发病例中4%为多发性肿块[1]。极少数CBT患者可伴疼痛或触痛,体格检查中,肿物可在水平方向移动,而无法在垂直方向移动。恶性CBT以转移性扩散为特征,可向周围及颅内侵犯,产生声音嘶哑、疼痛、颅神经压迫等症状[4]。Maicas等[5]发现了肿瘤侵袭颈动脉合并颈内静脉血栓形成的病例,患者的平均肿瘤直径约3.8 cm,切面灰红、实性,可见出血及囊性变。患者可因瘤体位置造成面颈部不对称,病侧颈部较对侧膨隆。少数患者出现一过性晕厥,可能是压迫颈动脉所致。本研究提及的9例患者的平均肿瘤直径为3.5 cm,与上述文献描述大致相同。本文报道的1例CBT患者出现局部淋巴结转移,因此诊断为恶性。
CBT镜下可见主细胞及周围支持细胞。主细胞呈圆形或多角形,核可有异型性,核分裂象少见。肿瘤细胞排列呈巢状、条索状或腺泡样结构,间质血窦丰富,部分可见灶性坏死及血管侵犯。支持细胞分布于主细胞外周,呈梭形。CBT属于神经内分泌肿瘤,其在免疫表型上呈现神经内分泌肿瘤的特征。主细胞表达CgA、Syn,支持细胞表达S100,Ki-67较低。其中,支持细胞表达S100有助于CBT的诊断,证明了肿瘤的副神经节起源。研究发现,Ki-67在CBT鉴别诊断及预后预测方面具有重要价值[6]。Ki-67阳性CBT患者的病死率较Ki-67阴性患者高,Ki-67>5%CBT患者的远期生存率低于Ki-67≤5%的患者;恶性CBT转移部位的Ki-67表达率较良性CBT高,约为8.2%;另外对于同一个体,转移部位与原发灶的Ki-67表达无明显区别[7]。笔者总结9例CBT患者的镜下形态特点,发现主细胞多呈腺泡状排列,偶可见巢状、条索状。另外,9例患者的Ki-67<10%,推测其与预后具有一定的关系。
恶性CBT的诊断需影像学检查和(或)手术切除显示转移,而非局部浸润。大多数学者认为出现局部或远处转移则提示恶性,但极少数报道中CBT虽为恶性但未出现转移[8]。可见CBT的组织学行为与生物学行为不符,仅凭借病理形态难以区分良恶性。恶性CBT局部转移较远处转移常见,远处转移部位多为肺部和骨骼,也有全身转移。局部转移CBT患者的预后优于远处转移患者。美国国家癌症数据报告显示,若发生局部淋巴结转移,CBT患者的5年生存率约为60%[9]。同时,恶性CBT容易复发,国外有股骨复发及转移的病例,提示需长期密切随访[10]。
CBT需与其他肿瘤进行鉴别诊断。①类癌:间质纤维组织较多,肿瘤细胞表达上皮样标志物pan-CK等。②嗜铬细胞瘤:发生于肾上腺髓质,分泌儿茶酚胺,可通过检测尿液中的儿茶酚胺及其代谢物进行鉴别。③腺泡状软组织肉瘤:肿瘤细胞体积较大,多呈空泡状,过碘酸希夫(periodic acid-Schiff,PAS)染色阳性,神经内分泌标志物阴性。
CBT的家族遗传特征与多种基因突变有关,目前已检测出超过15个基因,如琥珀酸脱氢酶复合体(succinate dehydrogenase complex,SDH)、神经纤维瘤蛋白基因 1(neurofibromin 1,NF1)、ret原癌基因(ret proto-oncogene,RET)等[11]。SDH包括B、C、D三个亚单位,但SDHC基因与恶性肿瘤的关联不大。发生SDHD基因突变的患者易在较早年龄发病且更有可能发生多灶性肿瘤。如1例双侧恶性CBT患者的31个家庭成员中,13个发生SDHD基因突变而其中9个出现了双侧CBT[12]。本文报道的恶性CBT患者SDHB灶性表达,未检测到SDHB突变,提示此例为散发病例。
CBT患者的5年生存率为34%~72%,肺转移的患者预后较差[13]。CBT的治疗方法首选手术治疗及淋巴结清扫,术前栓塞能够有效减少术中出血量,缩短手术时间。动脉造影可显示肿瘤与颈动脉和颈内静脉的关系,有助于确定手术方案。当CBT患者出现远处及全身转移时,手术治疗已不适用,多选择全身化疗,化疗药物包括多柔比星和异环磷酰胺等,常规放疗仅在全身骨转移时作为姑息治疗[14]。
综上所述,恶性CBT的诊断较困难,临床医师需结合临床表现、病理检查、基因检测及家族史等多方面因素综合考虑。
