近红外二区荧光探针的设计及应用研究进展
2022-04-28黄艳芳李子婧
黄艳芳,李子婧
(厦门大学公共卫生学院,分子影像暨转化医学研究中心,福建 厦门 361102)
光学成像技术具有无创、安全、可视化能力强、空间分辨率高、成本低等优点,可对生物分子、细胞、组织和生物体进行实时、多维的可视化监测,是生物医学领域中的重要研究手段[1-2].荧光成像由于其灵敏度高、分辨率高及操作简单等优点,在生物分子检测成像、药物分布代谢跟踪、疾病检测和诊断,特别是癌症早期诊断和影像引导治疗中,具有良好应用前景.
与可见光相比,发射波长在近红外区域的荧光探针可获得更深的穿透深度和更好的成像质量,因此,近10年来,荧光成像技术主要集中在近红外窗口.近红外一区(NIR-Ⅰ,700~900 nm)荧光成像以其高灵敏度、快速反馈、无危害辐射、低成本等优点,在生物医学研究中受到广泛关注.例如,利用NIR-Ⅰ荧光染料可以精确地描绘前哨淋巴结/肿瘤轮廓,并在术中引导切除前哨淋巴结/肿瘤组织[3].最近的研究表明,由于具有散射少、组织吸收可忽略和自荧光效应最小化等优势,在近红外二区(NIR-Ⅱ,1 000~1 700 nm)进行生物医学成像可以充分提高成像的时空分辨率(约20 ms 和约25 mm)以及穿透深度(高达3 cm),从而获得比NIR-Ⅰ更好的图像质量和更高的信背比[4-7].
目前,临床批准的近红外荧光染料有两种,分别是吲哚菁绿(ICG,发射波长800 nm)和亚甲基蓝(MB,发射波长700 nm),两者都是可以快速排泄的小分子,主要用于NIR-Ⅰ成像[2].随着化学合成的不断发展,新的荧光材料不断被发掘.NIR-Ⅱ荧光材料种类也日益丰富,如有机荧光材料、量子点、稀土纳米材料等被开发应用于近红外生物医学成像.然而,缺乏良好的水溶性、稳定性、荧光效率和生物相容性等是NIR-Ⅱ荧光材料发展的瓶颈.如何解决这些问题是NIR-Ⅱ荧光成像领域的热点,也是未来发展方向[8-12].因此,开发荧光效率高、水溶性好、生物相容性好的新型NIR-Ⅱ荧光材料,对荧光成像技术的发展具有重要意义.本文对近期新型NIR-Ⅱ荧光材料的设计理念及其在生物医学领域的应用进行综述和展望,以期为NIR-Ⅱ荧光成像技术的发展提供参考思路.
1 有机NIR-Ⅱ荧光探针
目前,已经开发出多种性能优良的有机NIR-Ⅱ荧光材料,其具有明确的化学结构,并且易于代谢,生物相容性好[13],因此极具吸引力和发展前景,有望率先在未来的临床中应用.
1.1 苯并双噻二唑(BBTD)类
具有供体-受体-供体(D-A-D)特征的荧光团,如BBTD衍生物,具有较大的斯托克斯位移(约200 nm)和高成像质量.在D-A-D支架中,强电子供体与中心电子受体的空间结构可缩小杂化最高占据分子轨道(HOMO)与最低未占据分子轨道(LUMO)能级之间的能隙,将荧光发射波长红移至NIR-Ⅱ窗口[13-16].BBTD通过调节D-A-D荧光团的受体和供体结构可以有效地改变吸收和发射光谱特征.
通常,BBTD基荧光团的最大吸收波长和发射波长分别位于800和1 000 nm左右,波长相对较短.设计波长更长的新型荧光团将有利于在NIR-Ⅱ对深层组织进行成像[17].Fang等[18]研究后发现:用Se原子取代BBTD骨架中的S原子可以使发射波长红移,引入给电子氨基也可以使发射波长延长至NIR-Ⅰ;但是单一的改进措施只能使波长红移≤50 nm,如何进一步有效延长波长仍然是一项挑战.通过同时在BBTD骨架中引入一个Se原子和一个氨基,开发了一种最大发射波长为1 210 nm的新型有机小分子荧光团FM1210;与S取代的类似物CF1065相比,FM1210的发射波长大幅红移了145 nm,并保持相当的量子产率和亮度,从而使FM1210的活体成像质量明显高于CF1065,波长增益约为使用单一修饰的BBTD衍生物(约50 nm)的3倍,超过1 200 nm区域波长的大幅增加可归因于Se原子和氨基的协同作用.这些优点进一步使NIR-Ⅱ荧光探针能够以100帧/s的速度对小鼠进行成像.此外,该研究还证明纳米尺度的FM1210脂质体(FM1210-NPs)能以高信背比对肿瘤及血管系统进行活体成像(图1).

图1 FM1210的结构(a)及其脂质体用于血管及肿瘤的荧光成像(b)[18]
揭示BBTD基荧光团的分子结构与光学行为之间的关系,也有助于开发具有长波长荧光发射的探针.为此,Ye等[19]研究了BBTD核心两侧的共轭桥和电子供体对光学行为的影响:当将苯基噻吩共轭桥(如PT、PPT和PTT)置于BBTD核心两侧时,它们的吸收波长在640~860 nm区域,而其发射波长约1 070 nm;当加入噻吩桥(TPAT)时,吸收和发射波长分别可达920和1 150 nm.在芴吡咯(FP)官能团存在的情况下,由于吡咯的NH基团与BBTD的氮原子之间形成了分子内氢键,吸收波长可达1 020 nm,发射波长超过1 200 nm.这些结果表明,TPAT和电子供体是延长荧光团吸收和发射波长的关键成分.基于此,选择TPAT和苯乙烯来放大共轭桥,以N,N-二甲基氨基作为电子供体,将它们整合到BBTD支架中,从而得到在942 nm处有一个很强的吸收峰、在1 302 nm处有一个发射峰的目标分子BBTD-1302.1 302 nm 处的最大发射峰不仅有助于解决更深层肿瘤的成像问题,还避免了使用长通滤波器时荧光成像的亮度下降[13].接着以聚乙二醇(PEG)化表面活性剂对其进行功能化形成水分散性纳米粒子BBTD-1302NPs,并通过体外研究验证了BBTD-1302NPs的高生物相容性和耐光降解性;基于BBTD-1302NPs的良好性能,在荷瘤裸鼠体内对BBTD-1302NPs的光热治疗能力进行了研究,结果显示经尾静脉注射BBTD-1302NPs和980 nm激光照射的小鼠肿瘤生长受到抑制.
为了改善NIR-Ⅱ荧光量子产率,目前还开发出多种具有屏蔽单元-供体-受体-供体-屏蔽单元(S-D-A-D-S)结构的荧光团.引入屏蔽单元可以保护荧光团的共轭骨架免受分子间相互作用,从而提高量子产率;同时,供体单元也有助于改善S-D-A-D-S荧光团在水溶液中的量子产率性能.例如:使用3,4-乙二氧基噻吩(EDOT)代替噻吩作为供体单元,可以使荧光探针水溶液中的量子产率从0.002%指数级增加到0.2%(将荧光团IR-26在二氯乙烷中的量子产率0.05%作为参比测定得出);具有增强疏水性的3-辛基噻吩进一步作为荧光团IR-FTAP的第一供体,在水中的量子产率提高到0.53%[20].尽管这种供体修饰可有效改善水溶液中的量子产率,但也会引起共轭主链更大的畸变,从而导致吸收光谱移动,发射波长减小,吸收系数降低.因此,为有效改善荧光团的亮度,在提高量子产率的同时应不牺牲吸收系数.基于此,Ma等[21]设计并合成了以二辛基链取代的3,4-丙基二氧基噻吩(PDOT)为供体单元的新型S-D-A-D-S NIR-Ⅱ荧光团IR-FP8P,以增强量子产率和吸收系数;与IR-FTAP的3-辛基噻吩相比,PDOT供体的共轭主链扭曲较小,因此IR-FP8P实现了吸收光谱的红移和吸收系数的提高.此外,二辛基链取代的PDOT能很好地保护主链不与水相互作用,量子产率明显提高.结果显示:IR-FP8P在水溶液中的荧光量子产率为0.60%,在水溶液中的峰值吸收系数为1.3×104L/(mol·cm);与IR-FTAP相比,亮度(808 nm激发)增加了5.7倍以上.IR-FP8P可在1 300 nm长通滤波器下对小鼠后肢血管进行成像,并观察到清晰的血管网络,信背比约为7.此外,通过偶联卵泡刺激素(FSH)制备具有靶向能力的FSH@FP8荧光探针,可用于小鼠卵巢成像.
大多荧光分子探针在聚集态时,会由于平面结构分子间强π-π相互作用诱导荧光猝灭(ACQ)效应,在水溶液或生理条件下荧光亮度降低,从而限制了其生物成像质量.Mei等[22]和Liu等[23]发现了与ACQ相反的聚集诱导发光(AIE)现象,即处于聚集状态的荧光探针强度远高于分散态.因此,当赋予NIR-Ⅱ荧光材料AIE特性,它将具有更高的荧光效率和光稳定性,同时大幅提升成像清晰度和分辨率.近期,Li等[24]以BBTD为电子受体、三苯胺(TPA)为电子供体,利用AIE活性分子转子,设计并合成了PEG化SA-TTB-PEG100;通过自组装技术获取了纳米颗粒(粒径为35 nm),在约1 050 nm处表现出最大荧光发射峰,在水中的最高量子产率为10.30%.此外,该自组装的纳米颗粒相比于通过两亲性聚合物包裹的对应物,表现出更小的多分散指数(PDI)、更好的均一性以及更久的胶体稳定性,在生物成像方面具有更好的潜力.接着,利用此纳米探针在小鼠和兔模型中评估了这种AIE纳米颗粒的近红外荧光成像性能,结果显示,NIR-Ⅱ荧光成像在体分辨率约38 μm,穿透深度约1 cm.该研究表明,高效自组装策略设计的NIR-Ⅱ AIE纳米颗粒对血管相关疾病的诊断和治疗具有重要意义,为NIR-Ⅱ荧光成像技术的转化应用提供了新机会.
1.2 花菁类
基于聚次甲基骨架的花菁染料含有扩展π共轭体系,具有独特的共轭骨架结构.通过加长聚次甲基链、增加杂环供体强度,或将杂原子从氧改变为其他硫族元素等方法,可以使染料的吸收波长红移.与D-A-D型染料相比,花菁类染料合成过程相对简单,吸收强度较高(ε>105L/(mol·cm)),特别是对近红外光有很强的吸收,因此很适合于近红外成像[25-26].
由于循环时间短,菁类染料为血管成像提供的成像时间窗口通常小于2 min.将染料与蛋白质进行生物结合可以增强循环时间,但这可能会产生猝灭效应而牺牲亮度.因此,需要发展一种新策略,在改善药代动力学特征的同时,又能确保NIR-Ⅱ荧光团的高量子产率.Tian等[27]通过牛血清白蛋白(BSA)和花菁染料之间的工程化超分子组装,开发了一个自组装的、尺寸约为50 nm的IR-783@BSA.该复合物可以保持扭曲的构象,且IR-783与白蛋白之间的纳摩尔级结合亲和力增强了扭曲的分子内电荷转移(TICT)过程和循环时间;循环时间增强使IR-783@BSA能够在注射后3 h内观测到3 μm宽的血管,同时具有超高的对比度,从而获得高质量的NIR-Ⅱ成像.
目前,NIR-Ⅱ花菁类染料在生物成像中存在稳定性差、斯托克斯位移小,或发生溶剂化猝灭等缺点.针对这些问题,Ren等[28]通过理性设计和理论计算相结合,提出构建NIR-Ⅱ荧光染料的新思路,即增大空间位阻和电子不对称性,并以此开发了一系列稳定、高量子产率、抗溶剂化猝灭的新型菁荧光团(NIRⅡ-RTs),其在水溶液中的吸收和发射峰分别高达977和1 008 nm.与传统的NIR-Ⅱ七甲川菁相比,NIRⅡ-RTs具有较小的斯托克斯位移和对溶剂极性敏感的吸收带,在极性溶剂中表现出稳定且强烈的吸收.稳定性测试表明,NIRⅡ-RTs在生理环境中的化学稳定性和光稳定性均优于商用七甲川菁类似物IR1061和吲哚菁绿.这些特点使NIRⅡ-RTs在生物成像应用中具有优异的高亮度和深层组织穿透性.此外,由于引入了羧酸官能团,新型染料NIRⅡ-RT3/4可以通过螺旋环化作用产生一个强大的荧光开关机制,所以NIRⅡ-RT染料可以设计作为可激活的NIR-Ⅱ荧光探针.作为概念的证明,该团队应用NIRⅡ-RT4构建了一系列可靶向激活的NIR-Ⅱ荧光探针(NIRⅡ-RT-pH、NIRⅡ-RT-三磷酸腺苷(ATP)和NIRⅡ-RT-Hg),用于生物相关物质的检测.特别是利用NIRⅡ-RT-ATP探针,首次实现了高对比度药物性肝损伤小鼠肝脏ATP含量的实时监测.
通常,有机荧光染料仅通过结构修饰很难将最大吸收波长和发射波长红移至1 300 nm以上,而J-聚集体可以使单个分子的吸收和发射波长红移,吸收系数增强且斯托克斯位移减小.因此,为了获取更长吸收和发射波长的NIR-Ⅱ探针,最近Sun等[29]通过自组装FD-1080花菁染料和1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱(DMPC),成功开发了一种新型的NIR-Ⅱ探针FD-1080 J-聚集体,其在生理条件下表现出较高的亲水性和稳定性,最大吸收和发射波长均超过1 300 nm;进一步利用分子动力学模拟研究了磷脂DMPC与FD-1080在J-聚集体形成过程中的相互作用;此外,还对FD-1080 J-聚集体进行了1 500 nm以上的光学成像(图2),并成功用于监测高血压大鼠在给药后颈动脉的动态变化,以评价降压药的疗效.
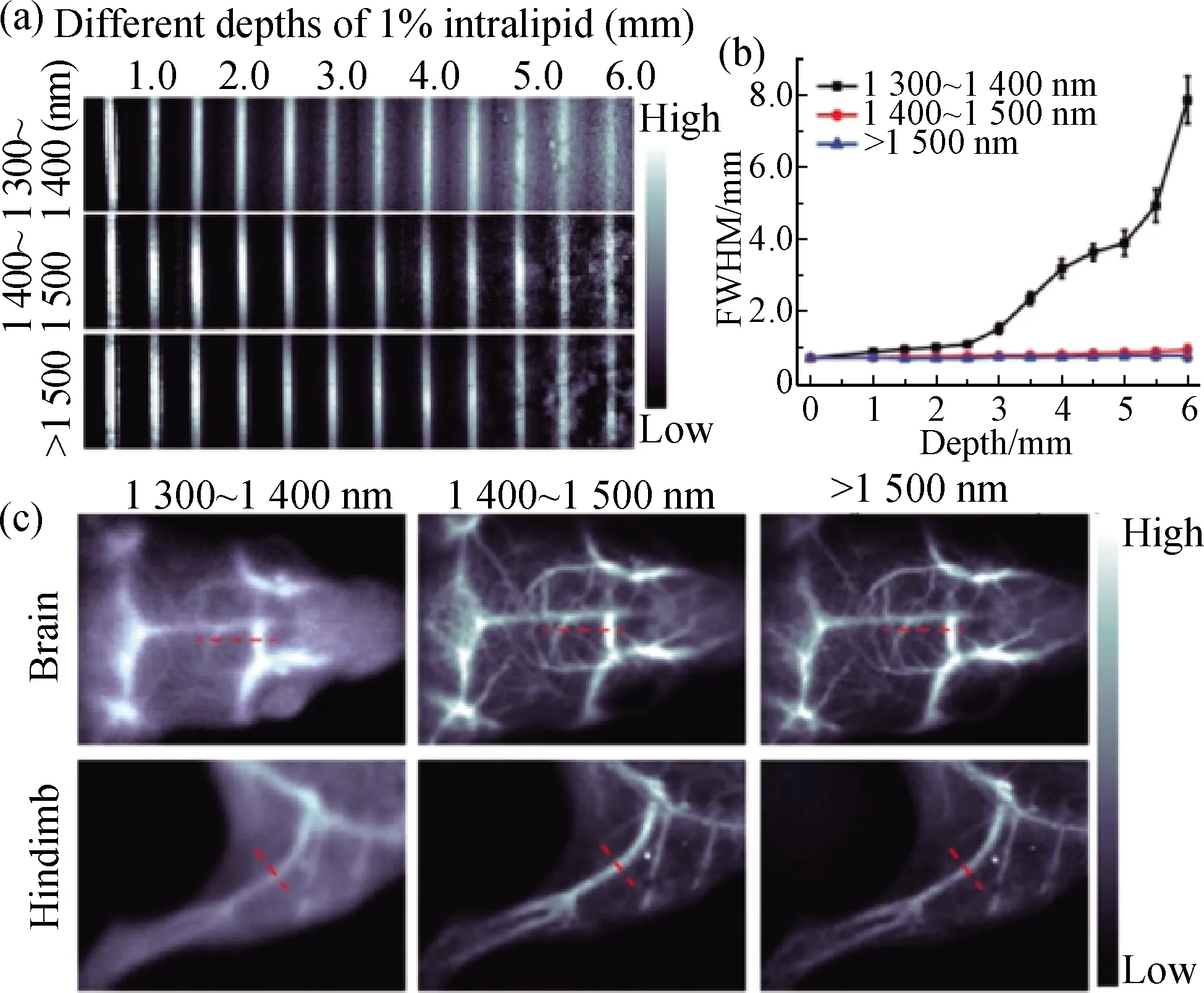
图2 浸没于不同深度甘油中的J-聚集体的荧光图像(a),不同成像窗口中在穿透深度处J-聚集体的半峰宽(FWHM)(b)及注射J-聚集体后在不同区域获得的脑和后肢血管图像(c)[29]
1.3 硼二吡咯烷(BODIPY)类
BODIPY染料具有高的量子产率、优异的化学和光物理稳定性,在分子成像和药物传递方面发挥着重要作用[30-31].经典的BODIPY吸收范围为500~600 nm,并且具有相当小的斯托克斯位移(15~30 nm).基于BODIPY的强吸电子性质,引入给电子基团可促使吸收和发射波长红移.例如,Mcdonnel等[32]在3,5-位将己二甲胺基引入苯环,可使其在三氯甲烷溶液中吸收和发射光谱的峰值分别从650和672 nm显著红移到799和823 nm.近年来,基于BODIPY的NIR-Ⅱ型有机荧光材料也得到了迅速的发展.
氮杂BODIPY(aza-BODIPY)的水溶性较差,限制了它们在活体研究中的应用.为了解决该问题,Godard等[33]采用了一种新策略,通过在硼原子上引入铵基,制备出水溶性aza-BODIPY,命名为SWIR-WAZABY-01.无需亲水性包封或PEG辅助,SWIR-WAZABY-01可直接用于肿瘤的NIR-Ⅱ成像(图3).这种以aza-BODIPY为基础的染料可以在肿瘤中迅速到达和累积,并在体内保留长达1周.

图3 SWIR-WAZABY-01的结构及其用于肿瘤的荧光成像[33]
最近,Bai等[34]利用分子工程开发出一系列新的aza-BODIPY染料:NJ960、NJ1030和NJ1060.与经典的aza-BODIPY相比,该类分子在强D-A分子内电荷转移(ICT)效应的帮助下可将近红外发射光谱红移到NIR-Ⅱ.此外,该类染料具有很好的光物理性能,如斯托克斯位移大、光稳定性好、水溶液中荧光亮度大等,其中NJ-1060在NIR-Ⅱ荧光量子产率高达1.00%,并且体内NIR-Ⅱ荧光成像结果表明NJ-1060具有高分辨率和深穿透成像能力.
1.4 基于共轭聚合物的NIR-Ⅱ染料
富电子供体和吸电子受体可使共聚物的带隙变小,因此通过D-A交替共聚生成的共轭聚合物具有带隙小、易调整的优点,是NIR-Ⅱ探针设计的一种有效途径.半导体聚合物点(Pdots)是近年来出现的一种新型有机荧光材料.与传统荧光染料相比,Pdots具有宽吸收、对称窄发射、高光亮度、高光稳定性及大斯托克斯位移.因此,高荧光Pdots组成的纳米颗粒被视为一种有效的荧光探针[35-36],在生物成像、分子检测、指导药物治疗等领域展现出广阔的应用前景.
尽管Pdots由于其可调的光学特性,在生物成像和生物传感方面具有很强的实用价值,但是与有机溶剂中的原始聚合物相比,纳米粒子形式的半导体聚合物通常表现出荧光猝灭,可归因于链间和链内π-π堆积的强相互作用,从而导致非发射性激子和激基复合物的形成[37-38].随着发射能量的降低,无辐射衰减率显著增加,很难获得高量子产率的NIR-Ⅱ荧光团.最近,Zhang等[39]提出了一种双重荧光增强机制来增强Pdots的NIR-Ⅱ荧光,通过分子工程策略开发了9种NIR-Ⅱ半导体聚合物.在该研究中,一方面利用吩噻嗪单元的聚集诱导发射特性来减少聚集态聚合物的非辐射衰变路径;另一方面引入了大量的侧链基团,通过空间位阻来减弱链间和链内π-π堆积产生的强相互作用,进一步增强荧光量子产率.基于这种双重增强策略制备的P3cPdots在水溶液中的荧光量子产率约为1.70%,比四氢呋喃溶液中的原始聚合物增强约21倍.活体小鼠头盖部荧光成像有显著改善,表明这种双重增强策略在设计活体荧光成像的NIR-Ⅱ荧光团方面具有潜在应用前景.
另外,针对Pdots在水溶液中往往会出现严重的荧光猝灭问题,Liu等[40]通过在聚合物受体的不同位置引入氟原子,利用分子调控NIR-Ⅱ荧光增强策略,减少聚合物与水分子的相互作用和非辐射越跃,从而提高NIR-Ⅱ荧光量子效率(图4).分别以苯并二噻吩(BDT)和三唑[4,5-g]-喹喔啉(TQ)衍生物为供体和受体,设计了两种含氟半导体聚合物.光物理实验结果显示:在808 nm光激发下,聚合物发射光谱覆盖了NIR-Ⅱ,肩峰延伸超过1 300 nm;随着氟化程度的加深,聚合物发射光谱红移.随后利用密度泛函理论表明氟化使激发态和基态之间的结构畸变减小,从而减少了非辐射弛豫,增强了Pdots的荧光量子产率.最后用Pdots进行小鼠颅骨肿瘤血管系统的活体荧光成像,获取了一系列高穿透深度和高信背比的荧光图像.

图4 纳米尺度氟化效应的示意图[40]
各种有机NIR-Ⅱ荧光探针的关键参数和应用总结于表1.

表1 有机NIR-Ⅱ荧光探针的比较
2 无机NIR-Ⅱ荧光探针
与NIR-Ⅱ有机小分子染料相比,NIR-Ⅱ纳米探针具有相对较高的量子产率和较低的光漂白敏感性,在肝脏、肾脏、大脑和肺成像等领域具有独特优势.目前,已开发如稀土纳米粒子(RENPs)、量子点(QDs)、金纳米团簇(AuNCs)、单壁碳纳米管(SWNTs)等材料作为NIR-Ⅱ探针[41-43].在此,介绍基于无机材料的NIR-Ⅱ荧光探针的开发及其在生物成像领域的应用,并重点关注近期新型无机NIR-Ⅱ荧光探针的研究进展.
2.1 稀土纳米材料
RENPs具有较大的斯托克斯位移、较小的光漂白、狭窄和多峰值的发射特性以及可忽略的激发-发射带重叠,因此受到越来越多的关注.此外,由于可通过掺杂不同的稀土金属离子来调谐发射波长和延长发光寿命[43-45],RENPs成为NIR-Ⅱ荧光成像的研究热点,有着很广泛的应用前景.
由于具有很长的荧光寿命(ms级别)以及很大的斯托克斯位移(≥200 nm),镧系RENPs作为荧光探针被广泛使用.最近,Li等[46]以77.5∶20.0∶2.5的摩尔比混合1,2-二棕榈酰磷脂酰胆碱(DPPC)、胆固醇(Chol)和聚乙二醇化脂质(DSPE-PEG2000)合成脂质体,然后使用该脂质体进一步包覆NIR-Ⅱ镧系荧光基团RENPs,得到在1 064和1 345 nm处双发射、大斯托克斯位移(分别为264和545 nm)的RENPs@Lips.RENPs@Lips在1 064 nm处的量子产率为7.90%,在808 nm激发下1 345 nm处的量子产率为4.10%.此外,RENPs@Lips显著增强了静脉排泄性和胶体稳定性,缩短了在网状内皮系统中的停留时间,并且超过90%的RENPs@Lips静脉给药后72 h内可以从肝脏排出.与之前报道的RENPs@DSPE-mPEG相比,RENPs@Lips的体内清除速度快且半衰期短;同时,未发现明显的RENPs@Lips骨积聚,这有助于减少骨系统滞留和加速静脉清除.这些结果表明RENPs@Lips具有良好的生物相容性、静脉内排泄性和优异的光化学性质,适合于临床前评估和监测生理和病理过程,可促进其未来的临床转化.
据报道,稀土元素Yb/Er共掺杂纳米颗粒(ErRENPs)具有NIR-Ⅱ波长的发光特性,并表现出斯托克斯位移大(高达450 nm)、寿命长、光稳定性好等优点,被认为是新一代近红外探针的优异候选者.然而,Er3+容易发生能量转移到纳米晶体表面的现象,导致严重的荧光猝灭.最近,Cao等[47]采用Nd3+敏化Yb3+的体系,在内部Ce3+的辅助下将能量转移到发光中心Er3+上.该研究中,在内核中掺杂Er3+作为激活剂,并在核心层和中间层混合Yb3+作为敏化剂,之后在NaYbF4:Er核纳米晶中进一步掺杂Ce3+以增强NIR-Ⅱ发射,并通过调节掺杂离子来优化纳米粒子的发光性能.引入PEG配体提高了纳米颗粒的水溶性(图5),实现了较长的血液循环时间.通过采集其NIR-Ⅱ荧光信号,该纳米探针可用于肿瘤的高分辨率追踪和成像.

UCL.上转换荧光.
2.2 QDs
QDs具有宽激发光谱、窄发射光谱、高量子产率、抗光漂白等优点,在活体生物成像中具有很高的时空分辨率,因此引起了人们的广泛关注.已有研究通过对PbS、CdSe、Ag2S等QDs的尺寸和形状进行微调,可以调节其药代动力学和组织分布[48-49].

PbS QDs具有多种独特的特性,包括窄带隙、大玻尔半径、在近红外区可调谐和强发射,使其广泛应用于光电子器件、传感器和活体成像等领域[48].目前胶体法制备窄粒径PbS QDs的方法已得到很好的发展,但在较高的温度下,该方法制备的纳米晶很不稳定.此外,由于表面易被氧化,其光学性质对空气和水相当敏感,限制了它们在生物成像中的应用.Shi等[51]通过阳离子掺杂工艺,制备了一系列高质量的锌掺杂PbS QDs,发现锌掺杂后可以形成掺杂态,降低了主体PbS的能隙,有效增强了PbS QDs的量子产率和光致发光寿命,并改善了QDs在高温下的荧光稳定性.这种阳离子掺杂策略为制备波长更长的更小粒子提供了一种新方案,可批量制备一系列波长覆盖整个NIR-Ⅱ的高质量QDs,为近红外光学成像提供了新工具;同时,PEG化的QDs可用于活体小鼠的脑血管无创高分辨荧光成像,实现了在毛细血管水平上高分辨率的脑血管无创近红外成像.
2.3 惰性金属纳米材料
惰性金属基(如Au和Pt)发射体不易引起荧光猝灭,因此很适用于NIR-Ⅱ成像.AuNCs是其中一个典型的代表,其具有比肾脏排泄阈值更小的尺寸、良好的光稳定性、易于修饰、优异的光热活性和多样性等多种独特优势,因此成为极具发展前景的新型NIR-Ⅱ 探针[52-53].考虑到胃肠道的酸性和酶生物环境可能会导致大多数纳米发射体的荧光猝灭,Wang等[54]提出合成惰性金属基发射体用于胃肠道近红外成像,以克服潜在的荧光猝灭问题.通过构建核糖核酸酶-A(RNase-A,由巯基和芳香族氨基酸组成)封装AuNCs,得到具有一个完美高斯型发射峰的RNase-A@AuNCs,峰中心位于1 050 nm,FWHM约为205 nm,与大多数报道的新型金属基成像剂相比,该发射峰相对狭窄,且RNase-A@AuNCs的量子产率为1.90%.将RNase-A@AuNCs暴露于胃肠道模拟液和哺乳动物细胞中以评估其稳定性和生物安全性,结果表明RNase-A@AuNCs具有高稳定性和良好的生物相容性.与两个已报告的近红外发射体(Ag2S和NaYF4:Er/Yb)相比,RNase-A@AuNCs胃肠道灵敏度提高了50倍以上.该研究首次将蛋白电晕技术应用在AuNCs上,将激发波长红移到NIR-Ⅱ,并使用一个肠癌模型来证明AuNCs作为肿瘤诊断显像剂的潜在效用.
近期,Li等[55]合成了粒径3.3 nm左右的具有25个Au原子和18个肽配体的新型AuNCs,即Au25(SG)18,可在NIR-Ⅱ发射.由于天冬氨酸和亚氨基二乙酸等羧酸可以作为天然骨靶向配体,研究人员假设Au25(SG)18中丰富的羧酸侧链能使其与骨结合,从而作为一种新型的骨显像NIR-Ⅱ探针.该研究首次发现Au25(SG)18与羟基磷灰石具有良好的体外结合能力.通过结合Au25(SG)18,NIR-Ⅱ荧光成像能高分辨率和高对比度地描绘出体内骨结构,并探讨了以Au25(SG)18作为骨组织术中NIR-Ⅱ荧光导航的潜在价值.
除具有NIR-Ⅱ成像能力外,带裸Au原子的AuNCs还可通过形成Au—S共价键与某些含巯基的物种如谷胱甘肽(GSH)发生反应[56].Yang等[57]开发出一种双功能的热释光纳米药物(AuNCs-Pt),利用AuNCs来递送Pt(Ⅳ)(图6).一方面,AuNCs-Pt的NIR-Ⅱ成像能力保证了高分辨率的肿瘤深部模型中Pt转运的有效可视化;另一方面,AuNCs-Pt通过Au—S键来结合GSH,以清除胞内GSH,从而有效地使肿瘤细胞对Pt类药物敏感.结果表明,AuNCs-Pt能够消除高危害的深部肿瘤,并减轻人体来源的肝癌异种移植的肿瘤负担.因此,AuNCs-Pt作为一种诊疗一体化纳米药物,在最大限度利用Pt依赖性化疗的同时,可通过高分辨率NIR-Ⅱ成像来监测Pt在深部组织中的运输.

EDC.1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐;NHS.N-羟基琥珀酰亚胺;HCC.肝细胞癌.
2.4 SWCNTs
SWCNTs直径约为1 nm,长度为几百至几千纳米,在分散剂的帮助下可溶解在水溶液中.SWCNTs的斯托克斯位移较大,在近红外波段具有良好的光稳定性和荧光发射,长期作为光学生物传感器.此外,得益于良好的光热转化效率和光敏特性,SWCNTs已广泛应用于光热和光动力疗法.近年来,由于其固有的宽NIR-Ⅱ荧光发射,SWCNTs越来越多地用于体内成像.例如,Welsher等[58]将SWCNTs作为第一代NIR-Ⅱ荧光探针应用于活体荧光成像,并在NIR-Ⅱ获得了更深层的组织穿透力和更高的时间和空间分辨率(<300 ms,约10 μm).此外,SWCNTs还应用于高性能血流动力学成像、全身血液循环和淋巴系统跟踪、肿瘤手术指导等领域[59].
由于NIR-Ⅱb(1 500~1 700 nm)具有最低的光散射,所以在NIR-Ⅱb进行活体生物成像能提供更高的空间分辨率、更深的组织穿透以及更好的信背比.目前,大多数基于高压一氧化碳转化(HiPCO)的NIR-ⅡSWCNTs直径分布为0.7~1.1 nm,荧光发射范围为1 000~1 400 nm[60-61];而具有更大直径的SWCNTs能够在更长波长区域实现高分辨率的荧光成像.最近,Diao等[62]通过激光气化(LV)合成了平均直径范围为0.96~1.24 nm的NIR-Ⅱ发射体SWCNTs,在LV合成过程中将炉温从950 ℃升高至1 125 ℃,使SWCNTs的平均直径从约0.9 nm变为1.4 nm.与先前广泛使用的HiPCO-SWCNTs相比,由于带隙较小和平均直径较大,LV SWCNTs在NIR-Ⅱb显示出更高的荧光.利用该SWCNTs作为体内NIR-Ⅱb荧光造影剂,发现小鼠后肢和大脑(颅骨和头皮完整)的活体血管成像的空间分辨率约4 mm,深度可达3 mm.
SWCNTs的体内潜在毒性问题是其临床转化的一大障碍,为了克服该问题,Takeuchi等[63]利用磷脂PEG包裹掺氧的SWCNTs得到O-SWCNT-PEG,并研究O-SWCNT-PEG给药后的生物反应.在980 nm光激发下O-SWCNT-PEG可以发射1 300 nm的NIR-Ⅱ荧光,适合用于体内NIR-Ⅱ荧光成像;将O-SWCNT-PEG经静脉注射到活体小鼠体内,作为血管成像的对比剂,研究了造影探针在体内的滞留时间、生物分布、毒性等生物学特征(图7).结果发现经尾静脉注射后,O-SWCNT-PEG在血管内循环时间约为3 h,大部分在1 d内从体内清除.此外,使用液相色谱-质谱联用对主要代谢物和脂质代谢进行分析,结果发现实验动物的免疫反应可忽略不计,并且几乎所有生物标记物在给药1个月后恢复到正常值.该研究表明O-SWCNT-PEG是一种生物相容性良好的探针,有效克服了SWCNTs的毒性问题,可用于NIR-Ⅱ波长范围内的血管造影成像.
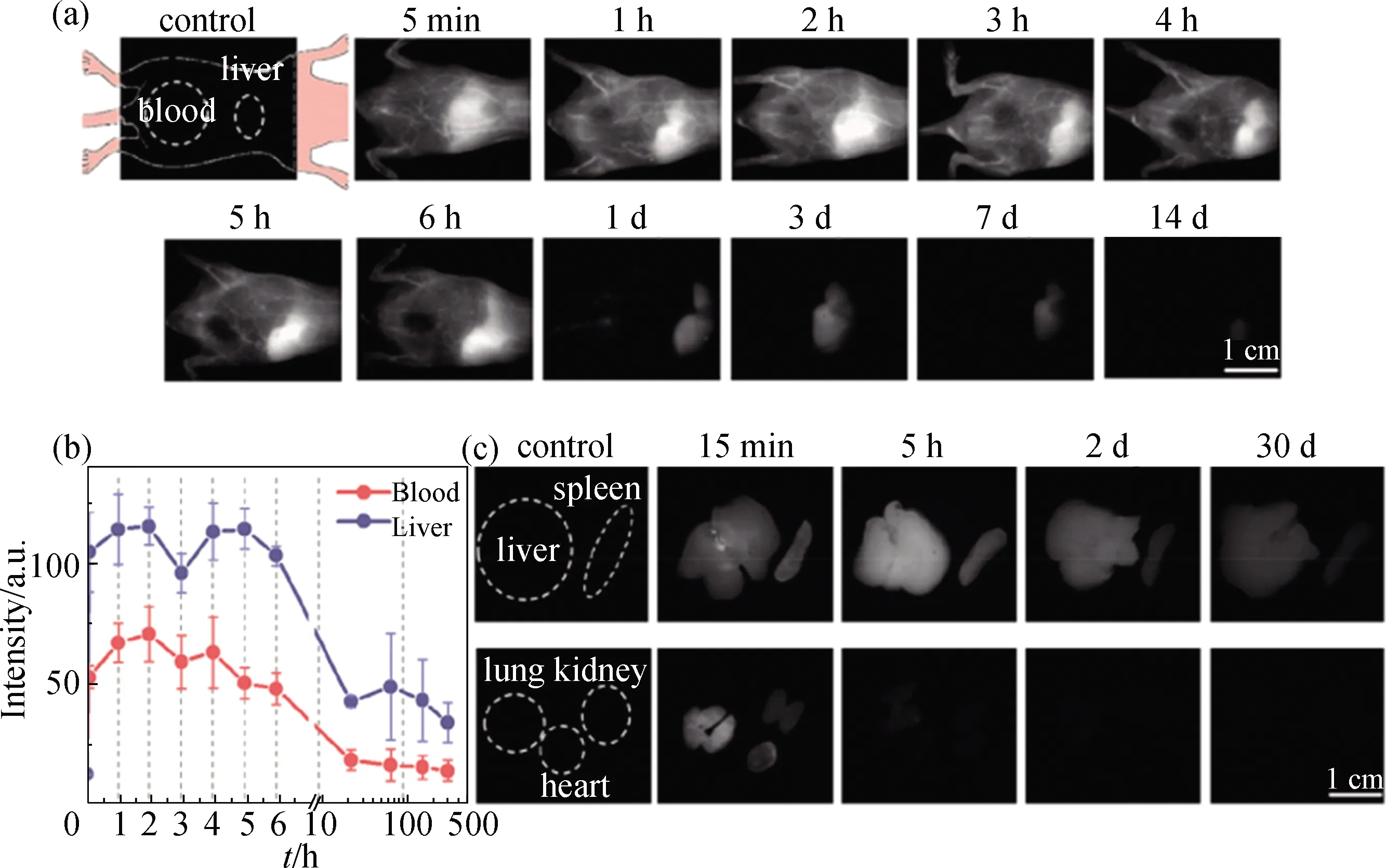
(a)注射30 μg O-SWCNT-PEG后的小鼠活体成像;(b)血液和肝脏随时间变化的荧光强度;(c)给药后肝脏、脾脏、肺、肾和心脏的离体荧光成像.
各种无机NIR-Ⅱ荧光材料的关键参数和应用总结于表2.

表2 无机NIR-Ⅱ荧光探针的比较
3 展 望
有机NIR-Ⅱ材料通过调节分子结构可以有效地优化光谱学性质,并且易降解,生物毒性小,在体内成像应用方面具有很大的潜力.花菁类NIR-Ⅱ荧光团合成过程相对简单,通过延长聚次甲基链、增加杂环的供体强度,可使发射波长红移.D-A-D型生色团具有较大的斯托克斯位移(约200 nm)和较高的成像质量,在1 000 nm 以上具有优异的光致发光和电致发光性能,并且通过调节D-A-D荧光团的受体和供体结构,可以有效地改变吸收和发射光谱特征.值得注意的是,上述两类小分子染料具有生物相容性好、循环时间短、体内代谢快等优点,避免了长期毒性问题;但存在量子产率较低、水溶性和生物体内稳定性较差等不足,往往需要通过改造来提高水溶性,例如将小分子染料包裹在聚合物基质中,但这大大增加了它们的大小,超过40 ku的肾脏清除阈值.因此,需通过合理的策略以消除上述障碍.共轭聚合物具有高度离域的π-共轭主链和可配置的侧链,这赋予了它们可调节的光物理性质和多功能性.此外,共轭聚合物通常具有吸收系数大、荧光量子产率高、光稳定性好等优点,但尚存在分子质量和分子结构不确定性等问题.总体而言,有机NIR-Ⅱ荧光团具有优良的光学性能、良好的生物相容性、较低的毒性等特点,并且其理化性质可通过结构修饰来调节,因此在未来临床中具有很大的应用前景.
近年来,国内外科学家开发出一系列性能优异的无机NIR-Ⅱ荧光纳米探针.与小分子荧光体相比,无机纳米荧光体如QDs和AuNCs,显示出较高的量子产率和较低的光漂白敏感性,常被用于肝脏、肾脏、大脑和肺成像;然而这些材料容易在肝/脾部位滞留和积累,不易被机体排泄.SWCNTs在NIR-Ⅱ具有强荧光性,能实现深层组织穿透和高空间分辨率荧光成像;但是其溶解度和生物相容性较差,这导致在表面改性之前无法直接用于生物成像.RENPs由于其大斯托克斯位移、窄和多峰的发射光谱、可忽略的激发-发射带重叠以及优异的光稳定性而受到越来越多的关注;但是与大多数报道的NIR-Ⅱ 无机纳米材料一样,在网状内皮系统中滞留时间长和无法从活体清除增加了其潜在的安全隐患,是未来生物医学应用和转化中不可忽视的障碍.
与传统的NIR-Ⅰ成像技术和其他医学成像方法相比,NIR-Ⅱ生物成像技术不仅成像深度更深,而且可以更好地避免组织自发荧光和光子散射等背景干扰.目前,已经成功合成和制备了有机小分子材料、共轭聚合物、无机纳米材料(稀土纳米材料、半导体QDs和SWCNTs)等多种NIR-Ⅱ材料.NIR-Ⅱ材料由于其独特的优异性,不仅可以作为生物医学造影剂,而且可用于光热和光动力治疗、药物递送、手术指导和移植干细胞的跟踪等领域.
本文概述了新型NIR-Ⅱ荧光材料的设计思路及其多样化的生物应用.虽然NIR-Ⅱ荧光材料的发展丰富了人们对NIR-Ⅱ生物成像领域的认识和应用,但是目前的工作主要集中在基础研究上,在临床上的应用还有很长的路要走.总体来说,NIR-Ⅱ荧光材料的开发设计要考虑以下几点:首先,最值得关注的问题是,生物相容性差及潜在的生物毒性可能会对人体生理功能产生影响,损害人体健康;其次,NIR-Ⅱ荧光材料的荧光量子产率低、发射波长短、化学合成过程繁琐耗时等缺点会阻碍其产业化发展;最后,除通过合理的策略消除上述障碍外,NIR-Ⅱ荧光材料在动物模型中的活性、毒理学和药代动力学评价测试,对于NIR-Ⅱ荧光成像的进一步发展至关重要.
