华东葡萄抗逆相关基因VpSBP16原核表达及功能初步分析
2022-04-28柴生樾王西平
柴生樾,王 浩,王西平
(1.西北农林科技大学 园艺学院,陕西 杨凌 712100;2.旱区作物逆境生物学国家重点实验室,西北农林科技大学,陕西 杨凌 712100)
随着葡萄(VitisviniferaL.)在世界范围内的栽培面积越来越广,其果实品质口感及经济价值成为了我们更加关注的话题。当今时代生物信息学和分子生物学迅速发展,利用现代分子生物技术快速提高葡萄的内在及外在品质,培育葡萄优良品种具有很大的意义及应用价值。SQUAMOSA启动子结合蛋白近年来受到了越来越多的关注,它是SBP基因编码的一种植物特异性的转录因子,包含一个大约76个氨基酸大小的SBP保守结构域和一个特殊的锌指结构,在蛋白与DNA结合的过程中起着重要的作用[1~3]。SBP-box基因最早是在金鱼草(Antirrhinummajus)的花序中被分离的,研究发现它通过调节MADS-box基因而结合在SQUAMOSA的启动子上,从而控制早期花的发育[3]。之后,拟南芥(Arabidposisthaliana)[4],单细胞藻类衣藻(Chlamydomonasreinhardtii)[5],水稻(Oryzasativa)[6],小立碗藓(Physcomitrellapatens)[7],玉米(Zeamays)[8]和葡萄(Vitisvinifera)[9]中的SBP-box基因相继被发掘出来。大豆中SBP-box基因成员数量最多,有111个[10~11],苹果中有SBP-box基因数量有42个[2]。而在拟南芥中有30个SBP-box基因,如AtSPL3可以调节拟南芥的芽发育[12],水稻中29个SBP-box基因,如水稻的OsSPL16是粒度、形状和品质的调节剂[13~14]。
根据对已经发现SBP-box基因的植物进行功能研究发现,SBP-box基因在增强植物生物及非生物胁迫抗性方面起着重要的作用。铜是有氧生物中必须的金属元素之一,故其代谢受到生命体严格的控制。铜信号传导的调控位点CRR1(铜响应调节剂)有一个名为SBP的植物特异性DNA结合域,是激活和抑制衣藻中铜和低氧传感途径的靶基因所必需的。研究表明具有SBP结构域的家族成员AtSPL7激活了参与铜的多个基因的转录,包括miR398,一些铜转运蛋白和CCH,是拟南芥中铜稳态的中央调节剂[15]。拟南芥AtSPL14参与对伏马毒素B1的敏感性而控制细胞凋亡[16]。此外SBP基因调控植物生长及发育[17],包括植物叶、花、果实形成等方面。研究发现SBP基因参与植物叶的形态建成并且是叶原基形成间隔期调控的基因[18]。另外SBP基因在植物花的形成及发育[19~20]方面也起着重要作用,可能促进了植物营养生长与生殖生长间的转换[21]并且影响着果实的发育与成熟[22~23],此外还涉及信号转导[24]等诸多方面。随着生物信息学的发展及葡萄基因组测序数据的完成,已经在葡萄中发现了18个SBP基因家族成员[9]。但在葡萄中对SBP-box基因的功能研究却鲜有报道。我们初步推测,葡萄SBP转录因子与已知的其他植物功能相似,可能在抗非生物胁迫方面、植物体生长发育及果实成熟方面起着重要作用。笔者实验室前期通过在拟南芥中过表达VpSBP16基因并进行干旱胁迫及高盐处理,结果表明在拟南芥中过量表达VpSBP16可能通过调节SOS信号和ROS信号来增加幼苗和成熟植株对盐和干旱胁迫的抗性[25]。为了更深入的研究SBP基因家族,揭示该基因家族的生物学功能及分子调控机制,笔者研究对VpSBP16基因进行原核表达,通过制备VpSBP16基因抗血清并对葡萄不同组织进行蛋白表达,这有利于对葡萄SBP基因家族进行更加全面的了解和分析,为进一步研究该基因家族提供了更有价值的信息。
1 材料与方法
1.1 材料
试验所用的叶片、花序、茎、卷须以及不同时期的果实均采自种植于西北农林科技大学葡萄种质资源圃的华东葡萄(V.pseudoreticulata)‘白河-35-1’及毛葡萄(V.quinquangularis)‘商-24’;新西兰雄性大白兔购于西北农林科技大学种兔场;大肠杆菌菌株Escherichia.ColiDH5α、Rosetta(DE3)、原核表达载体pGEX-6p-1均由西北农林科技大学旱区作物逆境生物学国家重点实验室保存;DNA聚合酶、DNA、蛋白质Marker、限制性核酸内切酶、均购自大连TaKaRa公司;连接试剂盒及质粒小提试剂盒由北京天根公司提供;增强型HRP-DAB底物染色试剂盒与抗GST鼠源单克隆抗体分别购于北京天根公司和南京金斯瑞公司。弗氏完全和不完全佐剂、CAPS、氨苄青霉素、牛血清蛋白、IPTG为美国Sigma公司产品。辣根过氧化物酶标记羊抗兔IgG抗体及辣根过氧化物酶标记羊抗鼠抗体分别购自为美国ABGENT公司和美国JACKSON公司。
1.2 方法
1.2.1 转录因子VpSBP16在大肠杆菌中的转化及融合蛋白诱导表达将构建好的T-Easy-VpSBP16与pGEX-6p-1载体用BamHI、XhoI双酶切后,回收产物过夜连接,转化大肠杆菌DH5α,菌液PCR鉴定测序结果正确后,提取pGEX-VpSBP16重组质粒,并进行酶切检测。将重组质粒转化表达菌株Rosetta(DE3),转化方法为热激法,转化完成后涂布于含100 mg/L氨苄青霉素的LB平板中,37℃过夜培养。挑取单菌落接种于LB液体培养基,37℃下培养16 h,菌液活化后进行PCR扩增检测条带位置是否正确。在超净工作台中,将5μL鉴定正确的菌液接种于30 mL LB液体培养基中,于37℃摇床内培养至OD600约为0.4~0.6,再次按1∶100(V/V)的比例吸取菌液加入到新的100 mL LB液体培养基后继续培养,当OD600为0.6时加入IPTG,用分光光度计测量此溶液终浓度达到0.6 mmol/L,于27℃培养箱诱导培养重组蛋白8 h;取诱导液1 mL,12 000 rmp/min离心1 min,沉淀中加入200 μL 1×SDS-PAGE上样缓冲液,在开水中煮沸10 min,室温下12 000 rmp/min离心3 min后吸取20 μL上清溶液上样,电泳检测后用考马斯亮蓝染液染色2 h后,加入适量的脱色液脱色对蛋白条带进行可视化分析。
1.2.2 GST-VpSBP16融合蛋白可溶性分析及纯化 取50 mL诱导菌液离心收集菌体,将离心管中的沉淀重悬于5 mL PBS缓冲液中,诱导菌液放置于冰上,超声波破碎约15 min至菌液粘稠透亮,将全部的细胞裂解物4℃下,9 000 rpm离心5 min分离菌体,将菌液上清吸取到2 mL离心管中,沉淀溶解于PBS缓冲液中充分震荡溶解。分别取等量上清与沉淀的溶解液,加入等体积上样缓冲液,通过SDS-PAGE电泳检测可溶性和不溶性部分的蛋白含量;以转化空载体的重组菌和未添加IPTG诱导的阳性重组菌为阴性对照。
为了纯化重组蛋白,再次将重组菌扩大培养后并用SDS-PAGE电泳检测。我们使用电透析,切胶的方式纯化蛋白,为便于切割必须使目的融合蛋白清晰可见,电泳结束后首先用考马斯亮蓝染色液染色10 min,再将配置好的KCl溶液置于冰上,再次染色直到背景清晰,用手术刀快速精确的将蛋白条带切于透析袋中。将少量Tris-Glycine缓冲液装入透析袋放置在水平电泳槽中,90V水平电泳3 h,反向电泳30 min。电泳结束后,取50 mL溶液液氮速冻,-80℃冰箱静置4 h,于冷冻冻干机冻干48 h。待纯化后的蛋白质充分冻干后,将粉末溶解于PBS缓冲液中,测定蛋白质溶液浓度后,通过SDS-PAGE电泳检测蛋白质是否被纯化。纯化的蛋白溶液可存放在4℃冰箱内在一周内使用,或者在-80℃冰箱中冷冻保存。
1.2.3 转录因子VpSBP16抗血清的制备与Western blot检测 用PBS缓冲液将保存的纯化蛋白稀释至1 500 mg/mL,取1.5 mL纯化蛋白溶液与等体积的完全弗氏佐剂混匀,充分乳化后作为注射所用的抗原。免疫接种选用新西兰大白兔,每隔10 d进行皮下注射,注射位点选用背部或腹股沟,每次注射400 g,共注射3次。第一次免疫后完全弗氏佐剂换为不完全弗氏佐剂,最后一次免疫7 d后心脏穿刺取血,常规方法获得抗血清,将获得的抗血清4℃储存。
根据美国伯乐半干转仪的说明,转膜时转膜仪上依次为厚滤纸-PVDF膜-胶-厚滤纸,转膜成功后在摇床上封闭3 h,倒掉封闭液,加入TBST缓冲液,并将所制备的抗血清按1∶20、1∶102、1∶103、1∶104、1∶105倍稀释作为一抗,一抗孵育完毕后,倒掉溶液,用TBST缓冲液洗脱,再用HRP标记的二抗孵育2 h,倒掉溶液,用TBST缓冲液冲洗三次后按照HRP-DAB底物显色试剂盒说明进行显色。
1.2.4 葡萄不同组织总蛋白的提取及VpSBP16蛋白的表达分析 将新鲜的葡萄组织加入液氮预冷的研钵中充分研磨,研磨完成后利用Tris-丙酮-酚法[26]提取葡萄不同组织及果实不同时期中的全蛋白,并在95℃加热5 min,使用含5%的浓缩胶10 mL,10%的分离胶15 mL,以‘商-24’葡萄的叶、茎、花序、卷须4种组织及果实发育中的6个时期的蛋白为样品,每个样品上样量为30μg,进行SDS-PAGE电泳检测,一抗添加3 μL的VpSBP16抗血清,Western blot与转印方法同前。
2 结果与分析
2.1 转录因子VpSBP16在大肠杆菌中的转化及融合蛋白诱导表达
将构建好的重组质粒pGEX-VpSBP16进行菌液PCR扩增和双酶切鉴定,并用1%的琼脂糖凝胶电泳检测获得了如图1所示的约1 674 bp的目标片段,序列比对结果正确。重组原核表达载体转化到大肠杆菌Rosetta中后,将阳性重组菌及对照菌于摇床培养至OD600为0.6时,于0.6 mmol/L的IPTG,27℃诱导培养8h。电泳结果(图2)表明,IPTG诱导的阳性重组菌高表达出约87 kD的特异条带(黑色箭头),与预期大小基本一致。与阴性对照对比可知,转化空载体的重组菌经诱导后则表达出分子量为26 kD的条带。这个条带的大小与GST标签蛋白大小一致,充分证明了华东葡萄转录因子VpSBP16蛋白诱导表达成功。
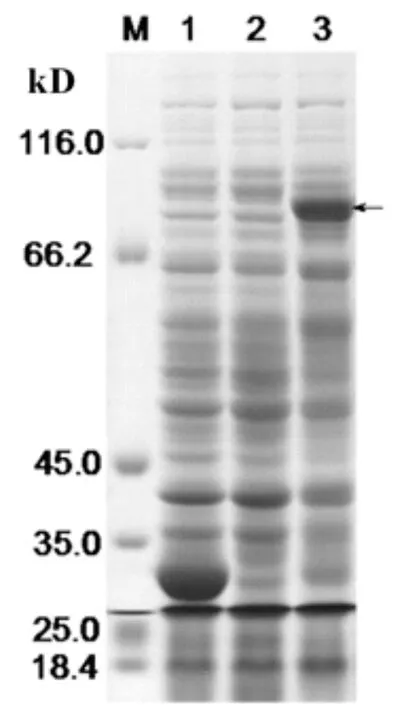
图2 pGEX-VpSBP16在Rosetta(DE3)菌株中经IPTG诱导的表达产物SDS-PAGE分析
2.2 GST-VpSBP16融合蛋白可溶性分析及纯化
SDS-PAGE电泳检测离心后收集的上清与沉淀,结果表明沉淀中融合蛋白表达量明显比上清中要高(图3,泳道5),而在上清中目的蛋白的表达非常微弱(图3,泳道4),这表明目的融合蛋白主要存在于在沉淀中,并且GST-VpSBP16融合蛋白的主要表达形式为包涵体。通过电透析法,切胶回收法将目的融合蛋白从凝胶中分离经SDS-PAGE发现GST-VpSBP16融合蛋白已经得到较好的纯化(图4)。
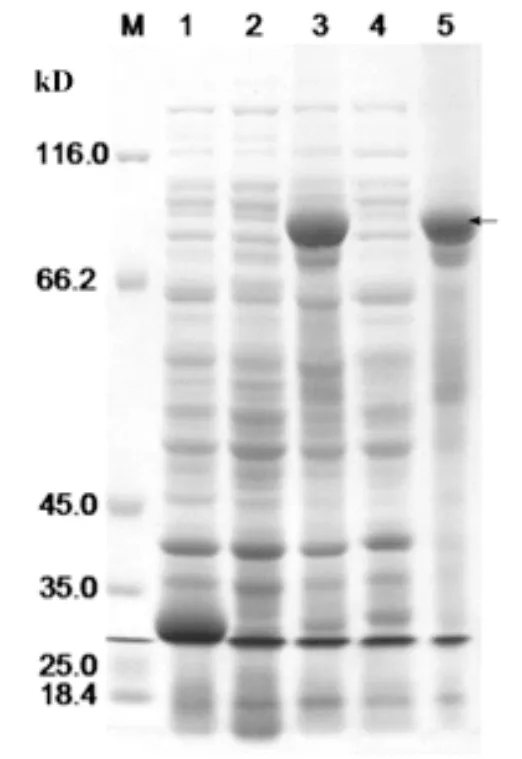
图3 转录因子VpSPB16原核表达蛋白的可溶性分析
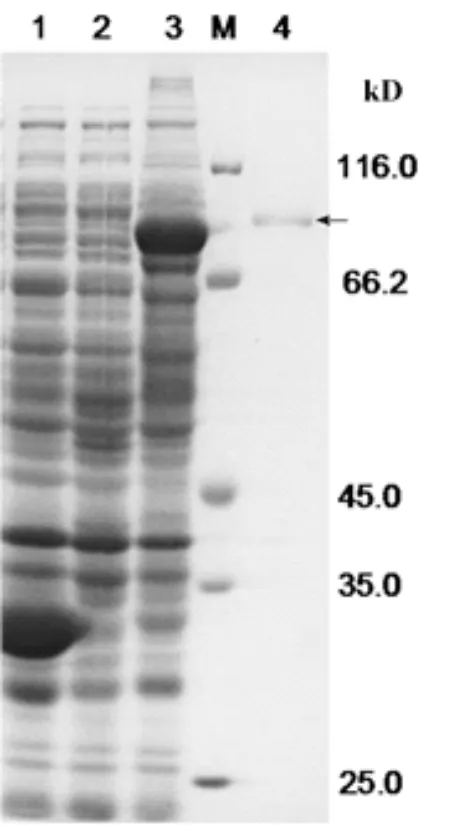
图4 GST-VpSBP16融合蛋白纯化产物的电泳分析
2.3 转录因子VpSBP16抗血清的制备与Western blot检测
抗原选用纯化后的GST-VpSBP16融合蛋白注射新西兰大白兔产生免疫应答,并且产生抗体,从而获得VpSBP16基因多克隆抗血清。从图5显示的结果可以看出,当用不同稀释倍数的抗血清进行Western blot分析时,均可以产生87KD,清晰且单一的杂交信号,这个结果充分表明以纯化蛋白包涵体形式所制备的抗血清可特异性地与抗原产生反应,而且泳道7的结果显示在稀释比例达到1:105时依然能够明显的检测到单一的蛋白条带。阳性对照在检测目的融合蛋白时以GST鼠源单抗进行孵育,阴性对照选用pGEX-6p-1空载经IPTG诱导后的表达产物并且用目的蛋白抗血清进行孵育。
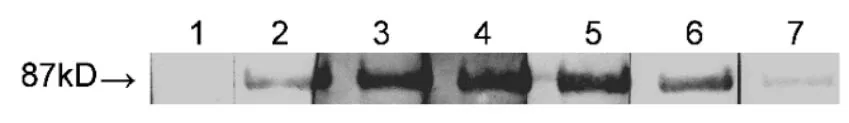
图5 转录因子VpSBP16多克隆抗血清的Western blot分析
2.4 VpSBP16基因在葡萄不同组织中的Western blot检测
为了进一步验证所得抗体是否可以检测到葡萄中的VpSBP16基因表达蛋白,我们提取了毛葡萄‘商24’中5个不同组织的总蛋白,利用Western blot检测葡萄花,果实,茎,卷须,叶中的VpSBP16蛋白表达情况。结果表明,实验中制备的抗体可以特异性的与‘商24’中的VpSBP16表达蛋白结合,并在染色后显示出清晰的蛋白条带。不仅如此,我们还观察到在葡萄生长发育时期卷须中的VpSBP16蛋白表达含量最高而花序中的VpSBP16蛋白表达含量最低,在葡萄果实发育时期的绿果期相较于花后45~100 dVpSBP16蛋白表达含量偏高。(如图6)。
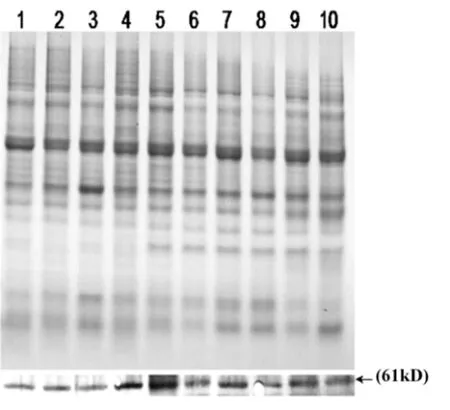
图6 毛葡萄‘商-24’不同组织中VpSBP16蛋白的表达分析
3 讨论与结论
实验构建表达质粒pGEX-VpSBP16转化菌株后,在27℃培养的条件下经IPTG诱导8 h可以使融合蛋白稳定表达,纯化后的蛋白通过免疫新西兰大白兔制备抗血清。结果表明我们获得了纯化的目的融合蛋白GST-VpSBP16,还制备了效价高达105的特异性抗血清。研究表明重组菌能否被成功诱导表达,经诱导后表达产物的多少及存在形式是制备抗体的重要环节,故表达载体、菌株选择、诱导时间和诱导物IPTG浓度都是实验中需要考虑的重要因素[27]。研究选用pGEX-6p-1载体是由于该载体上含有一段GST标签,使得融合蛋白的产量和可溶性得到提高,其次便于检测和纯化目的融合蛋白。Rosetta(DE3)菌株具有众所周知的遗传背景,并包含对氯霉素具有抗性的质粒[28]有利于外源基因在大肠杆菌内的顺利表达。采用27℃过夜诱导的表达条件,是因为在22~37℃的范围之内降低诱导温度可提高可溶性蛋白的含量[29]。根据前人研究经验,宿主细菌蛋白酶随诱导时间的延长会对表达蛋白质的降解作用增加,所以达到蛋白表达最大量后蛋白增加将不明显[30],故笔者实验采用IPTG浓度为0.6 mmol/L,8 h过表达目标融合蛋白,根据Western blot检测结果显示该条件足以满足后期蛋白质回收,纯化和抗原制备的要求。由于包涵体蛋白复性会造成二硫键错配使蛋白质失活[30],所以研究采用切胶,电透析的方式获得高效价的纯化蛋白。
SBP转录因子家族具有一个共同的脱氧核糖核酸结合域(SBP域)和一个不同寻常的锌指结构,这一类转录因子中的许多基因被认为在植物生长发育及抗非生物胁迫中起着重要的作用[9]。笔者实验室前期在拟南芥上过表达VpSBP16基因发现该基因可以提高拟南芥对干旱及高盐胁迫的抗性。为深入探索VpSBP16的功能,笔者试验制备VpSBP16多克隆抗血清并运用Western blot技术对毛葡萄果实,花序,茎,叶,卷须等不同器官的目的蛋白表达量进行检测,结果显示VpSBP16多克隆抗血清可以与目的基因蛋白杂交出特异性的条带,这表明我们所制备的多克隆抗血清可以运用于后续VpSBP16功能研究试验。通过观察VpSBP16蛋白表达条带发现花序的蛋白表达量偏低,而花后15~30 d的绿果期含量偏高,这与之前报道的SBP-box基因家族影响果实发育和成熟的结论一致[22],可能暗示着VpSBP16转录因子同样也参与葡萄果实成熟的调控机制,且在葡萄从营养生长到生殖生长的转换过程中发挥着重要作用。此外,在葡萄生长发育时期,卷须中的VpSBP16蛋白表达含量最高可能暗示着VpSBP16转录因子调控葡萄卷须的生长发育,具体调控机理需进一步深入研究。
总之,我们获得了具有生物活性的重组蛋白,制备了VpSBP16基因的多克隆抗血清,它能够特异的识别天然的VpSBP16表达蛋白,在蛋白水平上利用此抗血清对毛葡萄中VpSBP16基因功能进行了进一步的探索,为下一步开展VpSBP16基因功能的深入研究奠定了理论基础,为研究葡萄SBP家族的分子机制及蛋白功能提供了依据。
