食品中玉米赤霉烯酮检测结果测量不确定度的评定
2022-04-28徐宏岩
徐宏岩
(阜阳市产品质量监督检验所,安徽阜阳 236000)
玉米赤霉烯酮是玉米赤霉病的代谢产物,又称为F-2霉素,广泛存在于小麦、玉米等谷类作物中,是主要由禾谷镰刀菌产生的一种次级代谢产物,对人体和动物健康非常不利。玉米赤霉烯酮具有雌激素的作用,对雌性动物的生殖系统破坏性大,可引起动物出现流产、死胎等现象。同时,其具有潜在致癌性,可导致免疫系统及肝肾损伤[1]。
玉米赤霉烯酮分子式为C18H22O5,是一种酚的二羟基苯酸的内酯结构,不溶于水、四氧化碳和二硫化碳,但能溶于醇类、乙酸乙酯、乙醚和碱性水溶液,微溶于石油醚。目前,对玉米赤霉烯酮的检测方法有生物传感器法、酶联免疫法、气相色谱法和高效液相色谱等[2]。本文按照《食品安全国家标准 食品中玉米赤霉烯酮的测定》(GB 5009.209—2016)中的液相色谱法测定小麦粉中的玉米赤霉烯酮含量,并建立数学模型,对各不确定度分量进行评定。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
实验用小麦粉样品为中国检验检疫科学研究院测试评价中心提供的能力验证样品;标准品玉米赤霉烯酮(纯度≥98.0%,加拿大TRC公司);甲醇;乙腈;氯化钠;氯化钾;磷酸氢二钠;磷酸二氢钾;叶温-20;盐酸;玻璃纤维滤纸(直径11 cm,孔径1.5 μm,无荧光特性)。
1.1.2 仪器与设备
1260高效液相色谱仪(配有荧光检测器,美国安捷伦公司);ST 8R高速粉碎机(转速≥12 000 r/min);均质器(转速≥12 000 r/min);高速匀质器(转速18 000 r/min~22 000 r/min,德国IKA公司);氮吹仪(美国ThermosFisher公司);空气压力泵;玻璃注射器(10 mL);天平(感量0.000 1 g和0.01 g,瑞士METTLER TOLEDO公司);玉米赤霉烯酮免疫亲和柱(柱规格1 mL或3 mL,柱容量≥1 500 ng,或等效柱)。
1.1.3 试剂配制
①提取液配制。乙腈-水(9+1,V/V)。②PBS清洗缓冲液配制。称取8.0 g氯化钠、1.2 g磷酸氢二钠、0.2 g磷酸二氢钠和0.2 g氯化钾,加入990 mL水将试剂溶解,用盐酸溶液调节pH至7.0,加水定容至1 L。③PBS/吐温-20缓冲液配制。称取8.0 g氯化钠、1.2 g磷酸氢二钠、0.2 g磷酸二氢钠和0.2 g氯化钾,加入900 mL水将试剂溶解,用盐酸溶液调节pH至7.0,加入1 mL吐温-20,加水定容至1 L[3]。
1.2 实验方法
1.2.1 标准溶液配制
①标准储备液。称取适量标准品放入乙腈中溶解,标准品需精确到0.000 1 g,按照100 μg/mL的标准配制标准储备液,避光保存,温度在-18 ℃以下。②系列标准工作液。吸取适量标准储备液,用流动相稀释,配制成10 ng/mL、50 ng/mL、100 ng/mL、200 ng/mL和500 ng/mL的系列标准工作液,避光保存,温度为4 ℃。③样本加标。称取小麦粉样品40 g,加入100 μg/mL的标准储备液0.10 mL,混合均匀。
1.2.2 测定方法
试样用乙腈溶液提取,经免疫亲和柱净化后,使用高效液相色谱荧光检测器测定。小麦粉中玉米赤霉烯酮含量测定步骤如图1。
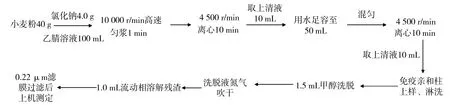
图1 小麦粉中玉米赤霉烯酮测定步骤
1.2.3 色谱条件
色 谱 柱:Agilent XDB C18,10 cm×0.3 cm,1.8 μm;流动相:乙腈-水-甲醇(46∶46∶8,V/V);流速:0.6 mL/min;检测波长:激发波长274 nm,发射波长440 nm;进样量:10 μL;柱温:35 ℃。
1.2.4 数学模型
玉米赤霉烯酮的含量按公式(1)计算:

式中:X为试样中玉米赤霉烯酮的含量,μg/kg;c为由标准曲线求得进样液中玉米赤霉烯酮的浓度,ng/mL;V为试样的定容体积,mL;V1为移入免疫亲和柱的滤液体积,mL;m为样品的质量,g。
2 结果与分析
2.1 标准溶液测定结果
配制玉米赤霉烯酮标准浓度为10 ng/mL、50 ng/mL、100 ng/mL、200 ng/mL和500 ng/mL,进行分析测试,结果见表1。根据表1作标准工作曲线,线性方程为y=6.515×10-4x-7.983,相关系数r=0.998 1。将加标后的小麦粉样品在相同实验条件下测量6次,测定结果见表2。

表1 标准溶液系列测定结果
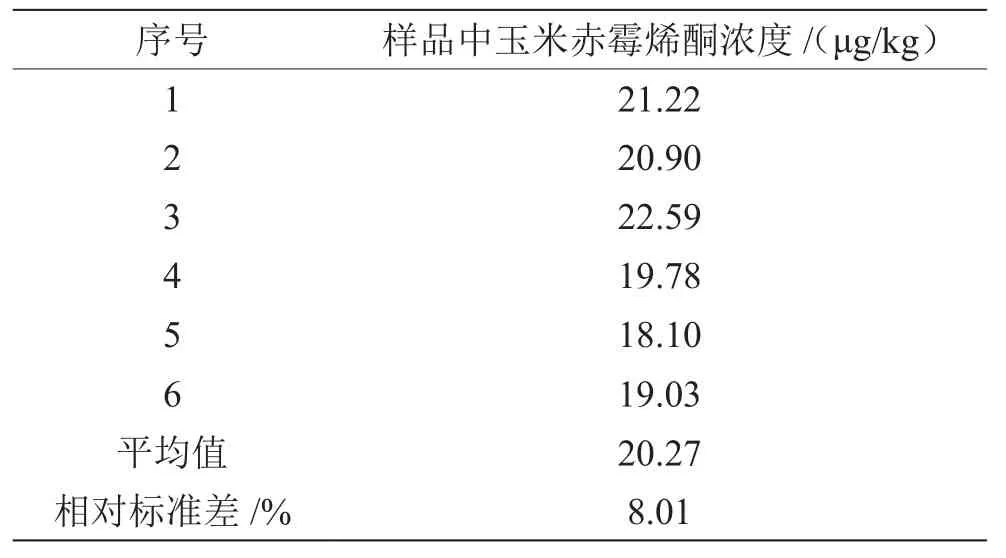
表2 样品重复性测定结果
2.2 不确定性来源分析
玉米赤霉烯酮含量的测定过程包括制备标准液、制备样品和仪器测定。测量不确定度可能来源于玉米赤霉烯酮标准溶液校正;玉米赤霉烯酮标准品纯度及样品称量;样品称量和配制测量液定容;实验重复性测量等[4]。不确定度来源见图2。
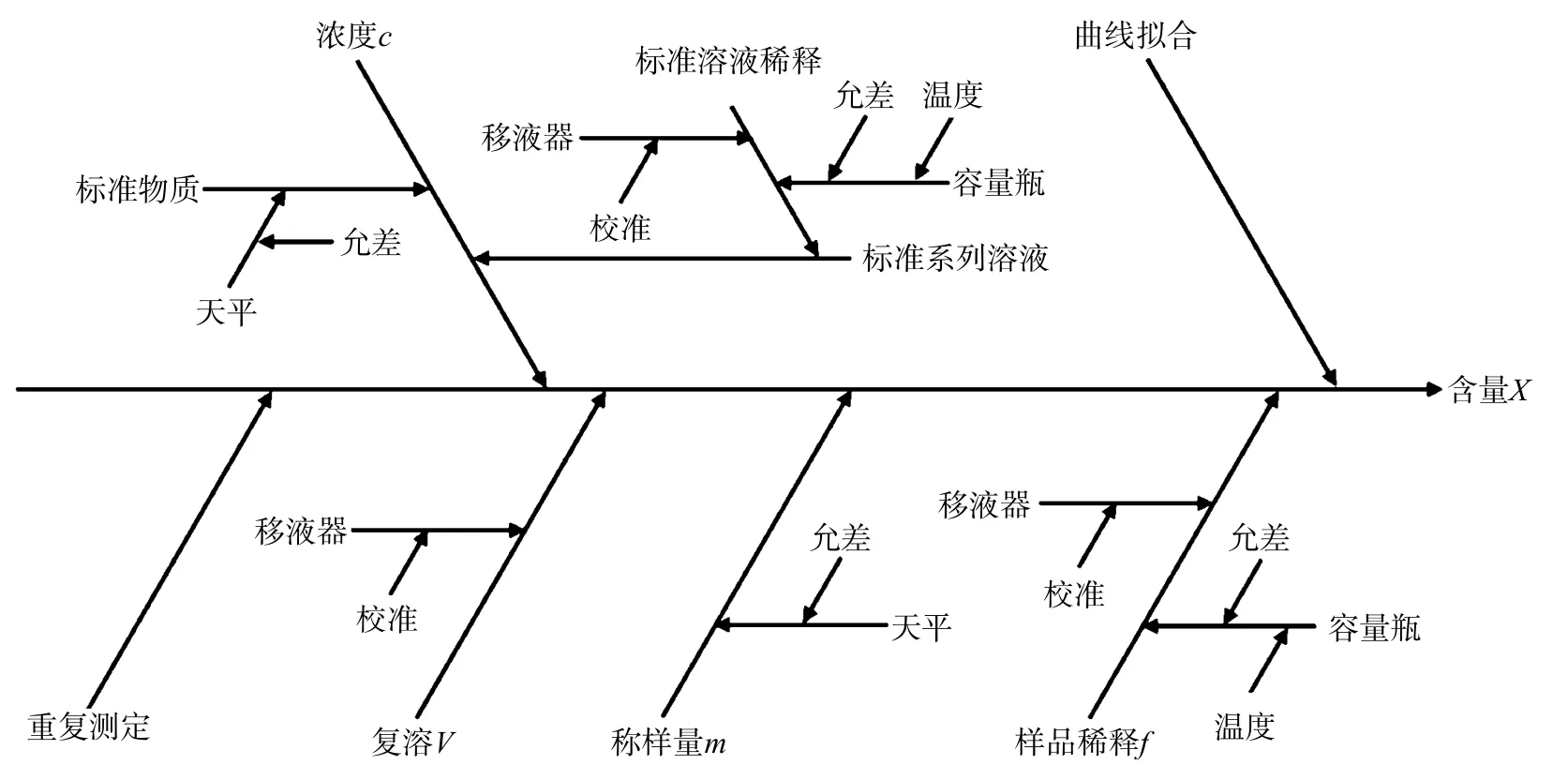
图2 小麦粉中玉米赤霉烯酮不确定度来源
2.3 拟合标准工作曲线求值引入的不确定度
绘制标准工作曲线,横坐标为标准溶液浓度X,纵坐标为标准品峰面积Y。残余标准差S和自变量偏差平方和Sxx,计算公式如下:
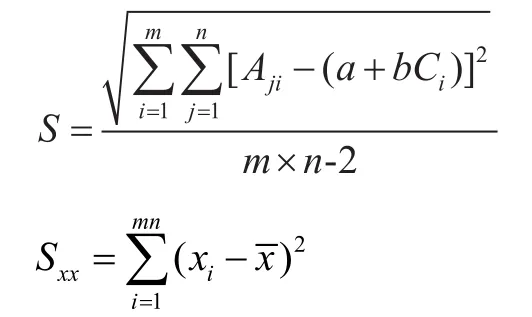
测量样品溶液6次,由拟合标准工作曲线求值引入的不确定度计算公式如下:
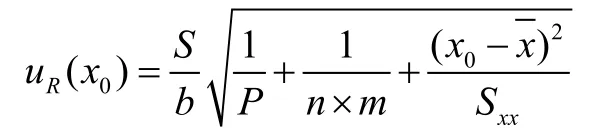
P=6,根据表1、表2数据,计算得到拟合标准工作曲线求值的相对标准不确定度urel(R)=0.35%。
(1)标准品纯度及称量引入的不确定度。根据标准物质证书,玉米赤霉烯酮标准样品的纯度为100.0 μg/mL,纯度偏差为 ±1.2 μg/mL,按照正态分布估算,取包含因子为2,则标准样品纯度的相对标准不确定度urel(n)=1.2%。标准物质为液体,无需电子天平称量,标准品称量的相对标准不确定度urel(m1)=0。
(2)使用移液枪定容引入的不确定度。根据检定规程,标准溶液配制过程中使用移液枪移取
2.4 标准液浓度引入的测量不确定度
液体,取矩形分布。配制过程中使用10 mL移液枪1次和1 mL移液枪7次,移液枪引入的不确定度分量见表3,移液枪引入的相对不确定度为urel(V1)=1.54%。

表3 移液枪引入的不确定度分量
2.5 样品配制测量引入的测量不确定度
(1)样品称量引入的不确定度。电子天平按照附机参数和检定说明确定线性和重复性分别为±1 mg,假设其服从矩形分布[5]。称量样品约为40 g,实际测量时,使用电子天平进行去皮前后2次测量,测量结果强相关,样品称量带来的标准不确定度其相对标准不确定度urel(m2)=0.004%。
(2)样品移取与体积定容引入的不确定度。本次实验使用了2次10 mL移液枪,移液枪引入的相对不确定度为urel(V)=0.08%。实验室温度变化范围为±5 ℃,水的膨胀系数为2.1×10-4/℃,属于B类不确定度,假设为矩形分布,实验室温度引入的不确定度为u(t)=0.061%。因此,样品体积引入的相对不确定度
2.6 实验重复性测量引入的不确定度
实验重复性测量引入的不确定度采用A类评定。根据表2数据,格拉布斯检验0.95置信水平下无粗大异常值。根据贝赛尔公式,计算出6次测量的标准差的相对值为。实测时以双实验平均值表示测量结果,测量结果的A类相对标准不确定度为
2.7 相对合成标准不确定度和相对扩展不确定度
将不确定度的A类评定结果和各分量评估结果合成,得出相对合成标准不确定度:

以任意2次测量结果平均值为检测结果(如第1次测量和第5次测量),玉米赤霉烯酮=19.66 μg/kg,取包含因子k=2,则玉米赤霉烯酮残留含量的测量结果及其相对扩展不确定度可表征为=19.66 μg/kg,Urel=12.1%。
3 结论
通过对小麦粉中玉米赤霉烯酮不确定度进行评定分析,发现实验重复性测量引入的不确定度最大,其次为标准品纯度及标准品称量引入的不确定度;样品称样和样品体积定容中10 mL移液枪引入的不确定度较小,在实际计算中可忽略不计。因此,进行实验时应注意重复性测量及标准品的选择,设置合理的标准曲线范围。实验人员应规范操作,在复杂的样品处理过程中尽量降低不确定度,提高检测精度和质量。
