六味地黄汤含药血清对CoCl2诱导HK-2细胞后E-cadherin、α-SMA表达的影响
2022-04-28王茜成细华刘春燕徐文峰张熙张海英王晖唐群
王茜 成细华 刘春燕 徐文峰 张熙 张海英 王晖 唐群
〔摘要〕 目的 觀察六味地黄汤含药血清对CoCl2缺氧后HK-2细胞中的上皮-间充质转化(epithelial-mesenchymal transition, EMT)标志物E-钙黏蛋白(E-cadherin)和α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)的影响。方法 体外培养HK-2细胞,分为3组:正常组(10%空白血清)、模型组(10%空白血清+200 μmol·L CoCl)、含药血清组(10%含药血清+200 μmol·L CoCl)。CCK-8法检测不同浓度空白血清、含药血清(2.5%、5%、10%、20%、40%)在24、36 h对HK-2细胞存活率的影响;以及不同浓度CoCl2 (150、200、300、600 μmol·L)在24 h的最佳干预浓度。qRT-PCR法和Western blot法分别检测各组E-cadherin、α-SMA 的mRNA和蛋白表达水平;免疫荧光观察各组E-cadherin、α-SMA蛋白表达情况。结果 CCK-8法确定含药血清和空白血清的最佳干预浓度和干预时间分别为10%和24 h;CoCl2的最佳干预浓度为200 μmol·L。与正常组比较,模型组E-cadherin的mRNA和蛋白表达水平均明显降低(P<0.01)、α-SMA明显升高(P<0.05);与模型组比较,含药血清组E-cadherin的mRNA和蛋白表达水平均明显升高(P<0.01)、α-SMA明显降低(P<0.01)。结论 缺氧能诱导HK-2细胞发生EMT,六味地黄汤含药血清能够降低α-SMA的表达,升高E-cadherin的表达,从而缓解肾小管EMT。
〔关键词〕 六味地黄汤;缺氧;上皮-间充质转化;肾纤维化
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.04.007
Influence of Liuwei Dihuang Decoction durg-containing serum on expression of
E-cadherin and α-SMA in HK-2 cells induced by CoCl
WANG Xi CHENG Xihua LIU Chunyan XU Wenfeng ZHANG Xi ZHANG Haiying WANG Hui TANG Qun
(1. Medical College of Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The First Affiliated
Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 3. Hunan Brain Hospital,
Changsha, Hunan 410021, China)
〔Abstract〕 Objective To observe the biomarkers E-cadherin and α-smooth muscle actin (α-SMA) of epithelial-mesenchymal transition (EMT) in HK-2 cells after CoCl2 hypoxia with Liuwei Dihuang Decoction drug-containing serum. Methods HK-2 cells were cultured in vitro and divided into 3 groups: normal group (10% blank serum), model group (10% blank serum+200 μmol·L-1 CoCl), and drug-containing serum group (10% drug-containing serum+200 μmol·L CoCl). The CCK-8 method was used to detect the effects of different concentrations of blank serum and drug-containing serum (2.5%, 5%, 10%, 20%, 40%) on the survival rate of HK-2 cells at 24 and 36 h; and the best intervention concentration of different concentrations of CoCl (150, 200, 300, 600 μmol·L) in 24 h. qRT-PCR and Western blot method were used to detect the expression of E-cadherin and α-SMA protein and mRNA in each group. The expression of E-cadherin and α-SMA protein in each group was observed by immunofluorescence. Results CCK-8 method determined that the best intervention concentration and time of drug-containing serum and blank serum was 10% and 24 h, and the best intervention concentration of CoCl was 200 μmol·L. Compared with normal group, the mRNA and protein expression level of E-cadherin in model group were significantly decreased (P<0.01), and α-SMA expression was increased (P<0.05). Compared with model group, the mRNA and protein expression level of E-cadherin were significantly increased (P<0.01), and α-SMA expression was significantly decreased (P<0.01) in drug-containing serum group. Conclusion Hypoxia can induce EMT in HK-2 cells. Liuwei Dihuang Decoction drug-containing serum can reduce the expression of α-SMA and increase the expression of E-cadherin, thus alleviating EMT in renal tubule.
〔Keywords〕 Liuwei Dihuang Decoction; hypoxia; epithelial-mesenchymal transition; renal fibrosis
慢性肾脏病(chronic kidney disease, CKD)以长期肾小球滤过率降低、尿白蛋白排泄率增加为特征。一项发布在The Lancet上的慢性肾脏疾病负担的研究显示:自1990年以来,全球CKD全年龄患病率增加了29.3%(95%不确定区间26.4~32.6),2017年,全球患病率为9.1%(8.5~9.8)[1],有效防治CKD已成为肾脏疾病研究领域的焦点之一。肾脏纤维化(renal fibrosis, RF)是CKD的基本病理过程[2],纤维化过程会逐渐损害肾功能直至肾功能完全丧失,最终可导致终末期肾病(end stage renal adisease, ESRD)和肾衰竭[3]。上皮-间充质转化(epithelial-mesenchymal transformation, EMT)是肾脏纤维化发生和发展的重要机制。寻找与肾脏纤维化发生发展相关的靶向因子和介导因子是延缓肾功能恶化和改善预后的关键环节[4]。缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)的表达,促进肾小管EMT从而导致肾脏纤维化,目前有大量证据支持HIF-1α对EMT的促进作用[5-6]。HIF-1α对EMT的调节主要表现在对EMT转录因子(EMT transcription factors, EMT-TFs)的调节,如Snail、Slug、Twist1、Zeb1、SIP1等,以及对EMT标记物的调节,如E-钙黏蛋白(E-cadherin)、α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)。六味地黄汤具有抗氧化、耐缺氧等作用,可延缓肾间质纤维化[7]。本研究通过体外实验探讨六味地黄汤含药血清对CoCl2诱导的人肾小管上皮细胞HK-2缺氧模型中EMT相关标记物E-cadherin、α-SMA的影响。
1 材料与方法
1.1 动物及细胞
取健康SPF级雄性和雌性SD大鼠各10只,体质量220~250 g,由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2019-0004,动物实验伦理合格证号:LLBH-202009250003。HK-2(人肾皮质近曲小管上皮)细胞株(批号:CL-0109,武漢普诺赛生命科技有限公司)。实验经过湖南中医药大学实验动物伦理委员会审查(编号为LLBH-202105100002)。
1.2 药物
中药六味地黄汤配方:熟地黄24 g(批号:20111443A)、山药12 g(批号:CK21051705)、山茱萸12 g(批号:TH21051705)、泽泻9 g(批号:SX21090610)、茯苓9 g(批号:CK21092703)、牡丹皮9 g(批号:CK21083006),均购自湖南中医药大学第一附属医院。
1.3 试剂与仪器
CCK-8试剂盒(Biosharp公司,批号:BS350B);TC处理细胞爬片24孔板(北京索莱宝科技有限公司,批号:YA0350);E-cadherin抗体(批号:20874-1-AP)、α-SMA抗体(批号:55135-1-AP)、GAPDH抗体(批号:10494-1-AP)、羊抗兔-HRP(批号:SA00001-2)、羊抗兔-CL594(批号:SA00013-4)、灵敏ELC化学发光试剂盒(批号:PK10002)均购自Proteintech公司;BCA蛋白定量试剂盒(批号:CW0014S)、快速去基因逆转录预混液(批号:CW2020M)、UltraSYBR Mixture(批号:CW0957M)均购自康为世纪生物科技股份有限公司;总RNA快速抽提试剂盒(上海飞捷生物技术有限公司,批号:Cat#220011);一抗稀释液(批号:P0256)、二抗稀释液(批号:P0258)均购自上海碧云天生物技术有限公司。
酶标仪(瑞士Tecan公司,型号:Spark 20M);电泳/转膜装置(美国Bio-Rad公司,型号:Power Pac Basic);Chemi-DoC-XRS+化学发光成像分析仪(美国Bio-Rad公司,型号:721BR17573);正置荧光显微镜(型号:Axioscope)、倒置荧光显微镜(型号:vert.A1)均购自德国Carl·Zeiss公司;实时荧光定量RCR仪(瑞士Roche公司,型号:LightCycler 96)。
1.4 含药血清的获取
按照随机数字表将20只大鼠分为2组:空白对照组、六味地黄汤组,每组10只。六味地黄汤组分别以33.75 g/(kg·d)六味地黄煎液灌胃(相当于70 kg成人剂量的5倍),药材加入5倍体积的水浸泡2 h,煮沸,再文火煎熬30 min,过滤后收集煎液,原药渣加少量水煎煮,取二煎液。两次煎液混匀后放入水浴恒温器中浓缩为3 g/mL(即每毫升药液含生药3 g)。空白对照组以10 mL/(kg·d)蒸馏水灌胃。适应性饲养3 d后开始灌胃,灌胃5 d后,提取血清。取血方法:每只大鼠麻醉前90 min灌胃,大鼠麻醉、固定,腹主动脉取血,静置2 h,2000 r/min,4 ℃离心15 min,离心半径17.3 cm。离心后用微孔滤膜防止微生物感染,血清分装储存于-70 ℃备用。
1.5 血清浓度及干预时间的筛选
采用CCK-8法将细胞以2×104个/mL、200 μL/孔的密度接种在96孔板中,在37 ℃、5%CO2箱中培养24 h,移出孔板,吸弃完全培养基,分别加入200 μL/孔含有2.5%、5%、10%、20%、40%浓度含药血清的基础培养基;分别于24、36 h干预后取出96孔板;倾去旧培养液,基础培养基和CCK-8反应溶液以9∶1配制;在37 ℃、5%CO箱中继续孵育2 h;用酶标仪测量450 nm处的吸光度(OD),并通过细胞存活率判定各种浓度下的细胞增殖活性,选择适当的血清浓度和缺氧时间。
1.6 化学缺氧剂CoCl浓度的筛选
称取0.143 g CoCl·6H2O,溶于50 mL纯水中,混匀,0.22 μm微孔滤膜过滤除菌,配制母液浓度为12 000 μmol·L,4 ℃保存。取对数生长期细胞制备细胞悬液,以5×10/孔接种于96孔板,待细胞贴壁后每孔分别加入终浓度150、200、300、600 μmol·L CoCl溶液,培养24 h。CCK-8法检测细胞活力,筛选最佳造模浓度。
1.7 细胞模型建立及分组、干预
使用HK-2细胞株,将体外培养的HK-2细胞分为正常组(10%空白血清)、模型组(10%空白血清+200 μmol·L CoCl)、含药血清组(10%含药血清+200 μmol·L CoCl)。3组细胞分别用空白、含药血清预先干预3 h,模型组、含药血清组随后加入200 μmol·L CoCl模拟肾内缺氧环境,继续培养24 h。
1.8 qRT-PCR法检测E-cadherin、α-SMA mRNA的表达
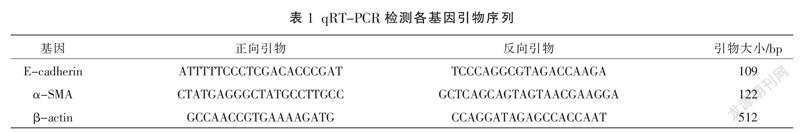
采用快速提取RNA法提取各组HK-2细胞的总RNA,分光光度仪测定总RNA含量及浓度,再使用逆转录酶试剂盒将RNA逆转录到cDNA,根据qRT-PCR法试剂盒说明书进行扩增。扩增条件:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸32 s,40个循环。以β-actin为内参,采用2法计算E-cadherin、α-SMA基因相对表达量。引物序列见表1,实验重复3次。
1.9 Western blot法检测E-cadherin、α-SMA蛋白的表达
25 cm细胞培养瓶收集各组细胞,分别加入50 μL蛋白裂解液;细胞刮刀将细胞刮下后,4 ℃下 12 000 r/min离心20 min,离心半径20 cm,取上清液;采用BCA蛋白濃度测定试剂盒测定蛋白质浓度;根据浓度测定结果对蛋白浓度进行调整,保证不同组别之间蛋白浓度一致,每孔上样量为10 μg,与适量SDS-PAGE Loading Buffer混匀,95 ℃、10 min 后进行上样。制备电泳胶、上样电泳、转膜、封闭、孵一抗4 ℃冰箱过夜[用一抗稀释液稀释相应的一抗,E-cadherin(1∶3000)、α-SMA(1∶700)];室温孵二抗2 h [用二抗稀释液稀释相应的二抗(1∶15 000)]、ECL化学发光试剂激发荧光,X片曝光,显影、定影,用凝胶图像分析系统扫描分析条带,比较目的条带相对灰度值。实验重复3次。
1.10 免疫荧光检测E-cadherin、α-SMA的蛋白表达情况
将HK-2细胞以5×10个/mL、500 μL/孔密度分别接种于24孔板爬片中;待细胞生长至80%密度后,将各组细胞分组造模;每孔滴加4%多聚甲醛进行细胞固定10~15 min;0.1%曲拉通通透10 min;5% BSA在37 °C封闭30 min;加入一抗[用PBS稀释一抗,E-cadherin(1∶200)、α-SMA(1∶500)]4 °C冰箱孵育过夜;室温静置30 min;加入荧光二抗 [用PBS稀释二抗(1∶200)] 37 °C避光孵育1 h;滴加DAPI核染色2 min(上述每个步骤结束后需用PBST漂洗5 min×3次);抗荧光淬灭剂封片。每组拍摄3次,重复3次。用Image J软件分析各组HK-2细胞E-cadherin、α-SMA的平均荧光强度。
1.11 统计学分析
用SPSS 26.0软件进行统计学分析,双侧检验,P<0.05为差异有统计学意义。计量资料用“x±s”表示。先进行正态性及方差齐性检验,若数据呈正态分布,且方差齐,则进行单因素方差分析。若不满足正态性要求,则采用非参数检验。
2 结果
2.1 血清最佳干预浓度及时间的确定
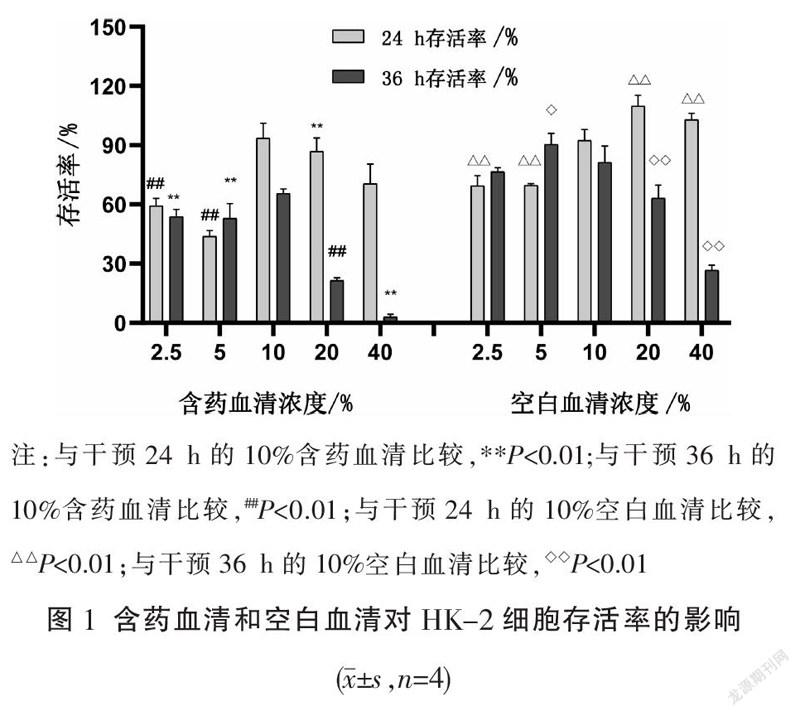
含药血清和空白血清在干预24 h的存活率趋势更好,其中10%含药血清干预24 h的存活率为93.6%±7.7%,10%空白血清干预24 h的存活率为92.4%±5.5%,故选择10%为两组血清的干预浓度。见图1。
2.2 CoCl最佳干预浓度的确定
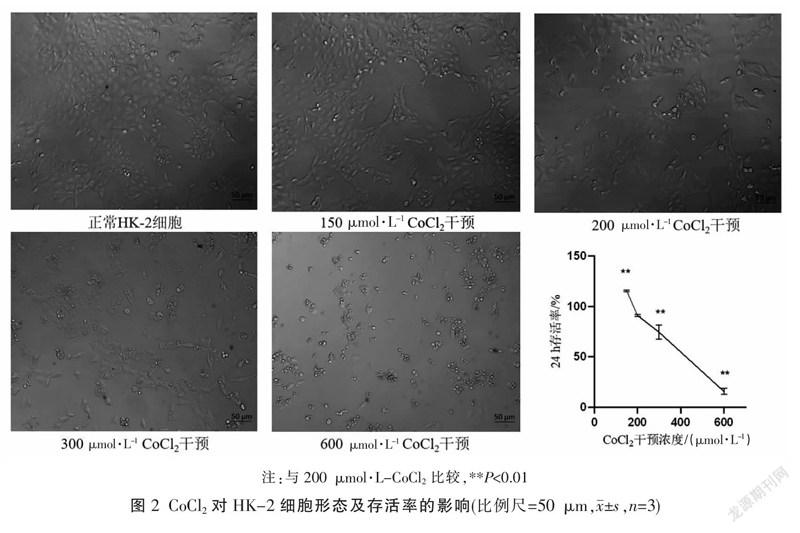
随着CoCl作用浓度增加,HK-2细胞形态发生变化,由正常的鹅卵石铺板状椭圆形,到缺氧后呈长梭形改变。CCK-8测得150、200、300、600 μmol·L
CoCl2干预HK-2细胞的存活率,分别为115.1%±0.7%、91.0%±0.9%、74.3%±7.0%、15.6%±3.0%。根据实验结果选择200 μmol·L CoCl作为干预浓度。见图2。
2.3 qRT-PCR法检测各组E-cadherin、α-SMAmRNA相对表达量
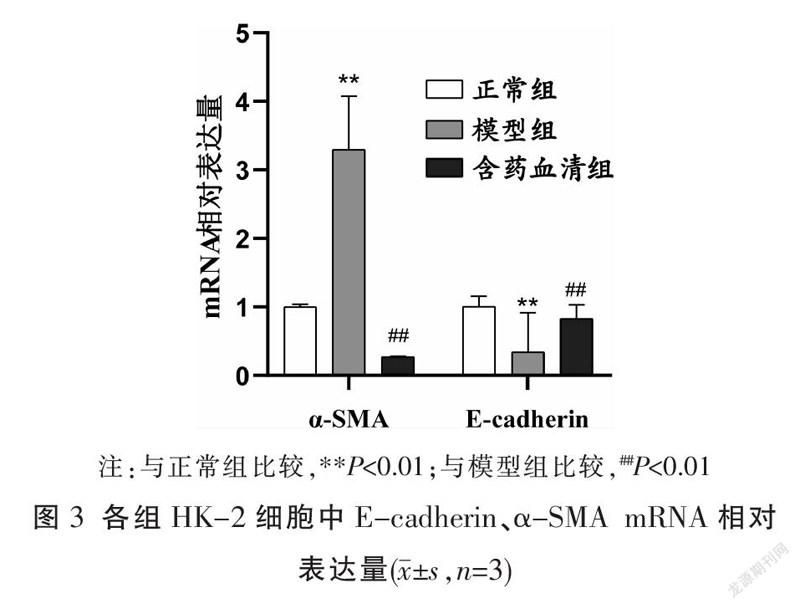
与正常组比较,模型组E-cadherin相对表达量降低(P<0.01)、α-SMA相对表达量增加(P<0.01);与模型组比较,含药血清组E-cadherin的相对表达量升高(P<0.01)、α-SMA的相对表达量明显降低(P<0.01)。见图3。
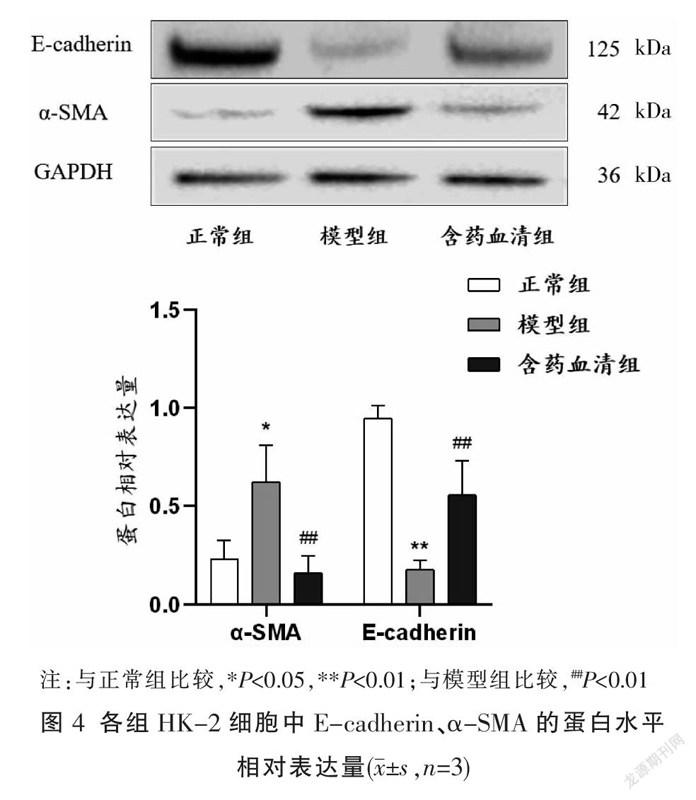
2.4 Western blot法检测各组HK-2细胞中E-cadherin、α-SMA 蛋白水平表达情况
与正常组比较,模型组E-cadherin蛋白表达量降低(P<0.01)、α-SMA蛋白表达量增加(P<0.05);与模型组比较,含药血清组的E-cadherin的蛋白表达量明显升高(P<0.01)、α-SMA的蛋白表达量明显降低(P<0.01)。见图4。
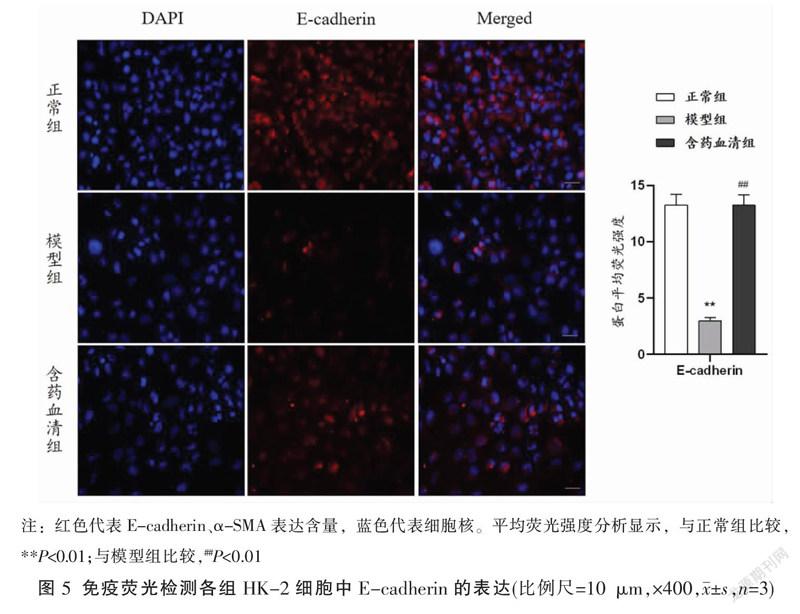
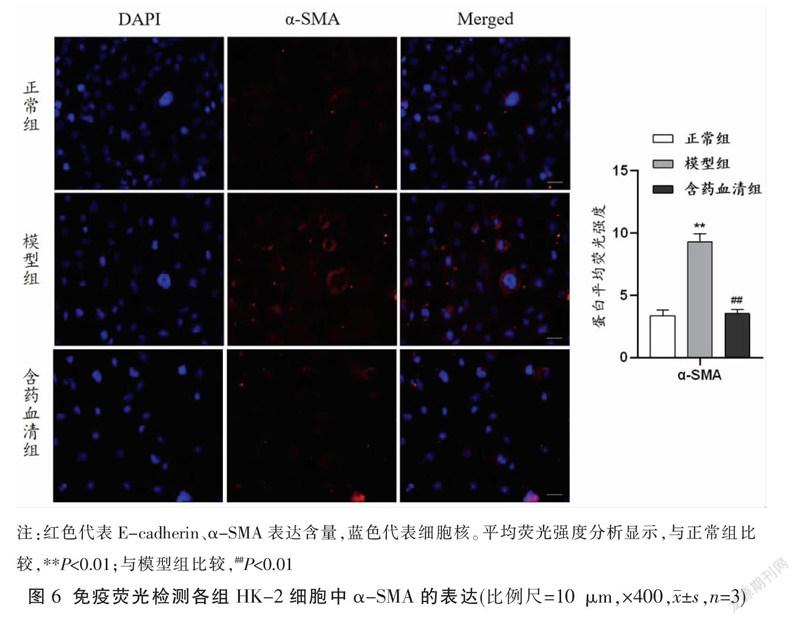
2.5 免疫荧光检测各组HK-2细胞中E-cadherin、α-SMA蛋白水平表达
与正常组比较,模型组E-cadherin蛋白的平均荧光强度减少、α-SMA蛋白的平均荧光强度增加(P<0.01);与模型组比较,含药血清组E-cadherin蛋白的平均荧光强度增加、α-SMA蛋白的平均荧光强度减少(P<0.01)。见图5-6。
3 讨论
肾纤维化是指肾单位破坏,间质中成纤维细胞大量增生、肌成纤维细胞形成、细胞外基质过度沉积导致肾小球硬化、肾小管间质纤维化。EMT指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,是导致肾间质纤维化的重要机制之一。而缺氧对EMT有促进作用,这一发现在肿瘤领域[8-9]以及相关器官的纤维化[10-11]都得到了验证。E-cadherin是一种钙依赖的跨膜糖蛋白,主要介导细胞间的黏附。缺乏钙黏蛋白是EMT的核心,从而导致失去上皮细胞极性、附着力不稳定、细胞骨架结构的变化[12]。α-SMA是血管平滑肌细胞内肌动蛋白异构体,是EMT时间叶组织表型常用标志物之一[13],在纤维化进程中起关键作用。EMT过程中,E-cadherin表达进行性下降,α-SMA蛋白表达增强[14]。
六味地黄汤出自宋代钱乙(钱仲阳)著《小儿药证直诀》,是以《金匮要略》中肾气丸减附子、肉桂而成。方中组成:熟地黄24 g,山茱萸12 g、干山药12 g,泽泻、牡丹皮、白茯苓各9 g。六味地黄汤“三补三泻”的特点,可补脾肾之虚。目前,六味地黄汤已被广泛运用于慢性肾炎[15]、高血压[16]、糖尿病[17]等脾肾阴虚证者。
团队前期研究发现,六味地黄汤可明显降低5/6肾切除大鼠血尿素氮、肌酐水平,减轻肾组织病理变化,减少间质胶原纤维增生,减少肾组织中Ⅰ型、Ⅲ型胶原、纤连蛋白表达水平[18]。体内实验发现,六味地黄汤可下调在5/6肾切除大鼠肾组织HIF-1α的表达,后者下调Twist的表达,上调E-cadherin表达,从而延缓肾纤维化[19]。本研究在前期研究基础上,进一步通过体外实验,探讨六味地黄汤抗纤维化机制是否与抑制肾小管上皮细胞间充质转化有关。
本研究通过CCK-8实验,首先确定正常大鼠血清和含药血清的最佳干预浓度,2.5%、5%浓度过低干预效果不明显,40%浓度过高细胞存活率不佳,选取最佳干预浓度为10%,干预时间越长,细胞存活率越低,24 h的存活率明显高于36 h,因此选择干预时间为24 h。同时进行CoCl2浓度筛选,并选择24 h CoCl2干预的浓度为200 μmol·L。结合先前大量研究结论:调控EMT相关分子标志物的表达,可以挽救肾纤维化[20-21]。本研究通过qRT-PCR、蛋白印迹和免疫荧光实验结果显示,上皮细胞标志物E-cadherin在模型组HK-2细胞中蛋白水平和mRNA表达均低于对照组,而间叶细胞标志物α-SMA在模型組HK-2细胞中蛋白和mRNA表达水平均高于对照组,且差异均有统计学意义(P<0.01),说明CoCl2可诱导HK-2细胞缺氧发生EMT。研究结果还显示,与模型组相比,含药血清组E-cadherin蛋白和mRNA表达水平均明显升高,而α-SMA蛋白和mRNA表达水平均明显降低,且差异均有统计学意义(P<0.01),说明六味地黄汤可通过调节EMT相关分子标志物E-cadherin、α-SMA的表达改善肾小管EMT。
综上所述,本研究初步证实了CoCl2可诱导HK-2缺氧发生EMT,六味地黄汤含药血清能下调α-SMA的表达,上调E-cadherin的表达,从而缓解肾脏EMT,为肾脏纤维化的治疗提供实验依据。
参考文献
[1] GBD Chronic Kidney Disease Collaboration. Global, regional, and national burden of chronic kidney disease, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017[J]. The Lancet, 2020. 395(10225): 709-733.
[2] DJUDJAJ S, BOOR P. Cellular and molecular mechanisms of kidney fibrosis[J]. Molecular Aspects of Medicine, 2019, 65: 16-36.
[3] SZETO H H. Pharmacologic approaches to improve mitochondrial function in AKI and CKD[J]. Journal of the American Society of Nephrology, 2017, 28(10): 2856-2865.
[4] HUMPHREYS B D. Mechanisms of renal fibrosis[J]. Annual Review of Physiology, 2018, 80: 309-326.
[5] SHU S Q, WANG Y, ZHENG M L, et al. Hypoxia and hypoxia-inducible factors in kidney injury and repair[J]. Cells, 2019, 8(3): E207.
[6] WEI X J, ZHU X Y, JIANG L L, et al. Recent advances in understanding the role of hypoxia-inducible factor 1α in renal fibrosis[J]. International Urology and Nephrology, 2020, 52(7): 1287-1295.
[7] 赖虹伊,黄 磊,黄仁发.六味地黄汤及其加味治疗肾间质纤维化的研究进展[J].广西中医药大学学报,2016,19(4):80-83.
[8] ZHANG J Y, ZHANG Q, LOU Y, et al. Hypoxia-inducible factorα/interleukinβ signaling enhances hepatoma epithelial-mesenchymal transition through macrophages in a hypoxic-inflammatory microenvironment[J]. Hepatology, 2018, 67(5): 1872-1889.
[9] SU Q, FAN M, WANG J, et al. Sanguinarine inhibits epithelial-mesenchymal transition via targeting HIF-1α/TGF-β feed-forward loop in hepatocellular carcinoma[J]. Cell Death & Disease 2019, 10(12): 939.
[10] ZHU Y, TAN J T, XIE H, et al. HIF-1α regulates EMT via the Snail and β-catenin pathways in paraquat poisoning-induced early pulmonary fibrosis[J]. Journal of Cellular and Molecular Medicine, 2016, 20(4): 688-697.
[11] EVANS R G. Introduction: renal hypoxia in kidney disease[J]. Seminars in Nephrology, 2019, 39(6): 517-519.
[12] SOMMARIVA M, GAGLIANO N. E-cadherin in pancreatic ductal adenocarcinoma: A multifaceted actor during EMT[J]. Cells, 2020, 9(4): E1040.
[13] SONG S, QIU D J, LUO F W, et al. Knockdown of NLRP3 alleviates high glucose or TGFB1-induced EMT in human renal tubular cells[J]. Journal of Molecular Endocrinology, 2018, 61(3): 101-113.
[14] SERRANO-GOMEZ S J, MAZIVEYI M, ALAHARI S K. Regulation of epithelial-mesenchymal transition through epigenetic and post-translational modifications[J]. Molecular Cancer, 2016, 15: 18.
[15] 周衛东,张永平,范树强,等.补中益气汤合六味地黄汤治疗慢性肾小球肾炎临床观察[J].光明中医,2021,36(11):1805-1807.
[16] 孙福泽,詹继红.六味地黄汤联合黄葵胶囊治疗阴虚夹湿型高血压肾病临床疗效观察[J].医学理论与实践,2021,34(4):604-606.
[17] 姜金玲.六味地黄汤对糖尿病肾病患者的治疗效果[J].中国城乡企业卫生,2021,36(10):147-148.
[18] 唐 群.从HIF-1信号通路探讨六味地黄汤干预5/6肾切除大鼠肾间质纤维化实验研究[D].长沙:湖南中医药大学,2013.
[19] 董 翔,胡 爽,王 茜,等.六味地黄汤对5/6肾切除大鼠肾脏缺氧诱导因子-1α及Twist和E-cadherin表达的影响[J].北京中医药大学学报,2020,43(11):927-934.
[20] LOVISA S, LEBLEU V S, TAMPE B, et al. Epithelial-to-mesenchymal transition induces cell cycle arrest and parenchymal damage in renal fibrosis[J]. Nature Medicine, 2015, 21(9): 998-1009.
[21] LIU L M, ZHANG P, BAI M, et al. p53 upregulated by HIF-1α promotes hypoxia-induced G2/M arrest and renal fibrosis in vitro and in vivo[J]. Journal of Molecular Cell Biology, 2019, 11(5): 371-382.
