宫颈病变筛查中检测方法的联合应用探讨
2022-04-27卞美璐袁记方陈庆云贺桂芳刘红刚
李 茜,卞美璐⋆,马 莉,陈 曦,袁记方,陈庆云,贺桂芳,刘红刚
(1.中日友好医院 妇产科,北京 100029;2.广东省人乳头瘤病毒HPV 相关疾病分子诊断工程技术研究开发中心,广东广州 521000;3.首都医科大学附属北京同仁医院 病理科,北京 100730)
宫颈癌目前仍然是全球女性的第四大常见肿瘤[1]。 据报道[2],我国每年约有新发病例13 万,约占世界宫颈癌新发病例总数的1/4。现已明确人乳头瘤病毒(human papillomavirus,HPV)感染尤其是高危型HPV 持续感染是诱发宫颈癌的明确病因之一,其致癌作用与HPV DNA 和宿主DNA 的整合有关[3~6]。90%的单纯HPV 感染者可在2年内自然转阴, 尤其是<30 岁女性。 从感染到宫颈癌变,一般要5~20年。
宫颈上皮的癌变过程包括许多基因和表观基因的改变,DNA 甲基化是最常见的表观遗传学改变,常发生于肿瘤抑制基因的启动子区域,造成该基因的转录失活,从而促使肿瘤的发生[7]。 本研究旨在探讨宫颈癌基因甲基化检测、高危型HPV 检测对宫颈癌筛查的分流作用, 甲基化选取的是PAX-1 和SOX-1 基因。
1 资料与方法
1.1 临床资料
选取2020年3月~12月间中日友好医院宫颈病变诊疗中心门诊就诊的机会性筛查女性34例,年龄24~67 岁,平均41.5 岁;其中<35 岁人群占41.18%(14/34)。 34 例均有行阴道镜检查的指征, 患者同时进行了性传播疾病(sexually transmitted disease,STD)十联检、高危型HPV17 分型检测、甲基化检测及组织病理学检测。以组织病理学诊断为金标准,评价不同检测方案的筛查效果。
1.2 实验方法
1.2.1 STD 十联检测
STD 试剂盒(hybrid bio,中国),使用专门的宫颈分泌物取样器,获取宫颈细胞学样本,采用导流杂交技术检测宫颈细胞标本中10 种STI 病原体,包括淋球菌、沙眼衣原体、微小脲原体的1、3、6、14 型、人型支原体、生殖支原体、解脲脲原体和单纯疱疹病毒Ⅱ型感染。
1.2.2 高危型HPV17 分型检测
采用聚合酶链反应 (polymerase chain reaction,PCR)+导流杂交技术检测宫颈细胞标本中17 种HPV 基因型感染, 包 含HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、 HPV45、HPV51、HPV52、HPV56、HPV58、HPV59、HPV66、HPV68,HPV82、 HPV6、HPV11,共17 种亚型。
1.2.3 甲基化检测
DNA 分离和亚硫酸氢盐处理根据制造商的建议,用DNA 迷你试剂盒(hybrid bio,中国)从收集到的宫颈脱落细胞样本中提取基因组DNA。使用NanoDrop One/One c (Thermoscientific,Wilmington,美国)测定DNA 浓度。 DNA 产量为>200ng的样品被考虑用于进一步的测试。 亚硫酸氢盐处理纯化基因组DNA 时, 根据制造商的建议使用DNA 甲基化试剂盒(hybrid bio,中国)。
DNA 甲基化测试利用ABI7500 PCR 系统(Life Technologies,Thermo Fischer Scientific, 美国)扩增taqman 为基础的定量甲基化-特异性聚合酶链反应(QMSP),测定SOX1 和PAX1 的甲基化水平。 我们设计了Actin Beta 基因(ACTB)作为内参,并对每个标本进行了检测。 如果标记ACTB的Ct 值≤35,则认为样品具有足够的质量。 总反应体积25μl:包含2μl modifified 模板DNA,23μl定制TaqMan 试剂。 PCR 在以下条件进行:95℃10min,95℃10s 45 个循环,60℃(根据引物集)20s。 如果甲基化SOX1 的Ct 值≤38.6,或者甲基化PAX1 的Ct 值≤38, 则认为整个DNA 甲基化试验为阳性。
1.3 组织病理学诊断
组织病理学诊断标准依据WHO(2014)宫颈病变的分级系统[22],所有样本的组织病理学诊断均由2 名专业医师独立诊断分析。
1.4 统计学方法
应用SPSS22.0 软件,计数资料采用率或百分比(%)进行统计描述,组间比较采用字2检验。
2 结果
STD 十联检测、甲基化检测与高危型HPV 检测对本组患者宫颈病变的诊断结果见表1。 表2示,三者联合检测均阳性的患者中87.5%(7/8)为组织病理学诊断高级别鳞状上皮内病变 (high-grade squamous intraepithelial lesion,HSIL), 具有阴道镜检查指征的病例中有55.9%(19/34)为HSIL。
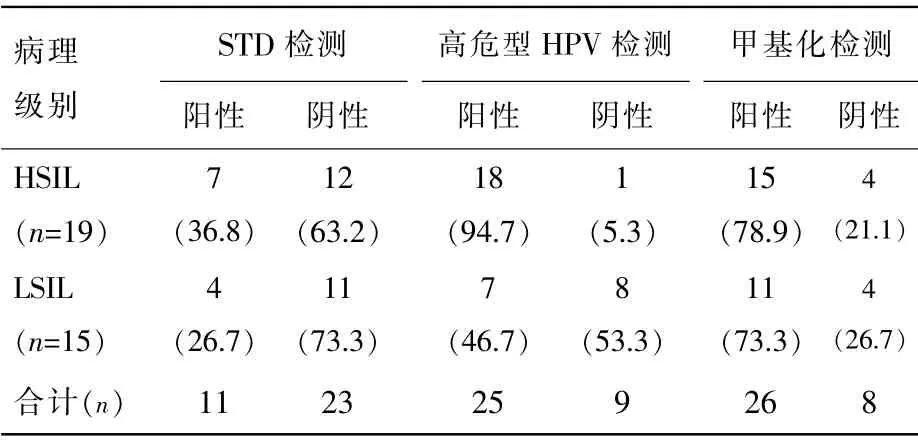
表1 3 种检测结果与组织病理学诊断结果的比较n(%)

表2 STD 十联检、高危型HPV 检测、甲基化检测对宫颈病变筛查的分流
3 讨论
3.1 宫颈病变的筛查方法
筛查宫颈癌前病变, 当前使用最广泛的是液基细胞学和HPV 检测,二者均有各自的优势和局限性。 液基细胞学有较高的特异性但是敏感性较低,因为它受到取样、制片、阅片等多方面因素影响,主观依赖性强,对筛查人员的要求高,培养周期长, 且缺乏规范化的质量控制;HPV 检测具有较高的敏感性, 但是它不能区分一过性感染和持续性感染,在性活跃的育龄女性中,检出率较高,绝大多数的HPV 感染在几年内可以自动清除,而这种一过性感染与宫颈癌的进展无关[23]。
高危型HPV 检测在筛查子宫颈病变中,具有重要意义,高危型HPV(16/18 型)感染伴或不伴有细胞学异常、高危型HPV(非16/18 型)感染伴有细胞学异常、高危型HPV(非16/18 型)持续性感染伴或不伴有细胞学异常, 均是阴道镜检查的指征, 根据阴道镜检查病理结果判断宫颈病变程度,并采取相应的治疗措施,已成为宫颈病变诊断及治疗指南的一部分。
宫颈上皮的癌变过程包括许多基因和表观基因的改变,DNA 甲基化是最常见的表观遗传学改变,常发生于肿瘤抑制基因的启动子区域,造成该基因的转录失活,从而促使肿瘤的发生[7]。
3.2 PAXl 基因和SOX-1 基因
国内外学者虽已对宫颈癌的多个基因异常甲基化进行了检测,对DNA 甲基化与肿瘤发生发展的关系进行了研究和探讨。 但同一基因在不同研究中存在较大差异,且大部分研究样本量较少。本研究中甲基化选取的是PAX-1 和SOX-1。PAX-1基因隶属于配对盒基因家族, 定位于染色体20p11, 是一种重要的转录调控因子,主要参与生骨节的分化, 在哺乳动物脊柱和胚胎细胞的增殖控制过程中发挥关键作用[8]。早在2008年,有研究发现[9],PAX-1 基因在宫颈癌中因启动子趋于甲基化而表达抑制失活, 经去甲基化处理后基因可重新表达,PAX-1 基因甲基化改变在宫颈上皮内瘤 变(cervical intraepithelial neoplasia,CIN)Ⅲ级及浸润性宫颈癌患者的宫颈脱落细胞中被检测到。 PAX-1 在宫颈癌组织中的甲基化频率非常高,且随病情的演变呈现明显的上升趋势。近年来多项研究发现[10~13]在浸润性癌的鉴别中PAX-1 基因检测的甲基化指数特异性更佳, 而在CINⅢ以上病变的筛查中特异度亦具有明显的优势。
SOX-1 为性别决定区域Y1,它定位于染色体13q34 上, 具有参与胚胎发育的调节以及决定细胞存亡的功能[14~16]。 既往有研究表明,SOX-1 基因在肺癌[17]、肝癌[18]、卵巢癌[19]、食管癌[20]等多种恶性肿瘤中甲基化水平增高, 在宫颈鳞癌组织和正常宫颈组织中存在差异表达, 其在肿瘤组织中甲基化水平异常升高, 而且其甲基化程度与宫颈上皮内瘤变分级相关。2016年的一项Meta 分析表明[21]SOX-1 基因甲基化在宫颈癌检测中具有较高的敏感性, 可望成为一个潜在的宫颈癌筛查的分子标志物。
3.3 3种检测联合应用的优劣势
由于在STD 检测阳性病例中再进行HPV 分型检测的阳性者需要进行阴道镜检测, 同时予以甲基化检测后, 发现其阳性病例的组织病理学分级与阴道镜活检后的组织病理学分级结果高度吻合,考虑可对那些HPV 高危型阳性,且无阴道镜活检条件的患者进行分流。如不便随诊患者、依从性差的患者,预测其罹患HSIL 的风险,制定治疗方案,不失为一种新的临床评估手段,有望成为一项未来可期的替代筛查方案。
由于STD 十联检测、 甲基化检测与高危型HPV 检测这3 类检测均可进行自动化操作,并可同时对大量的标本进行操作, 无需人工参与及单独、繁琐地检测每份标本,从而大大降低了工作量和人工成本。进行三者联合检测,可以在短时间内获得检测结果, 本研究中三者同时阳性的患者中87.5%(7/8)组织病理学诊断为HSIL,但因存在漏诊的可能性, 所以具有阴道镜检查指征的患者还是应尽可能行阴道镜检查。在今后的研究中,我们将继续扩大检测样本量,以得到更佳的筛选方案。
