载姜黄素纳米金微球的制备及缓释性能研究*
2022-04-26冯建海徐雪梅覃乙棉罗雪玲李胜英
冯建海, 徐雪梅, 黎 姿, 覃乙棉, 罗雪玲, 李胜英
纳米粒子作为一种新型药物载体, 具有载体材料易制备、多样、 载药量高、 可缓控释、 能靶向给药、 生物利用度高等特点, 已受到科研工作者的广泛关注, 且具有广阔的发展前景[1-2], 如金纳米颗粒(Au NPs)、 银纳米颗粒(Ag NPs)、 C60等。 在上述纳米材料中, Au 纳米颗粒是一种理想的适用于生物学研究的选择对象。 金纳米粒子拥有高化学稳定性, 易于合成, 粒径分布窄且精确可控, 具有可调控的光热性质及良好的生物相容性, 表面易修饰, 表面经过功能化的Au 纳米颗粒在细胞诱导、 药物载体、 临床诊断及抗体标记等方面尤为有效[3-5]。 如Chen 等[6]利用硫醇化的聚乙二醇和聚丙烯酸对金纳米棒进行修饰, 负载阿霉素, 可获得一种具有较好药物传输的纳米材料, 而Li 等[7]用巯基琥珀酸(MSA)和巯基丙酸(MPA)对纳米多孔金纳米粒子表面进行合理的改性, 发现MSA 修饰的NP-AuNPs 有效地控制了阿霉素的释放, 这些研究表明改性纳米Au 做为药物载体有减缓药物的释放作用。
姜黄素(Curcumin, Cur)是姜科植物姜黄的主要活性成分之一, 据前人研究表明姜黄素具有良好的治疗作用, 包括抗肿瘤、 抗菌、 抗氧化、 抗艾滋病病毒和抗炎作用[8-10]。 对于抗癌方面, 在临床上已有用于乳腺癌, 胰腺癌、 结肠癌等的治疗[11-12]。 然而, 姜黄素在水中溶解性差、 稳定性差、 难吸收、 易被机体代谢, 系统快速清除等缺点, 严重阻碍其临床应用[13-15]。纳米材料负载药物构建纳米递药系统具有较好的生物相容性和靶向性, 有助于药物的缓慢释放从而提高药物的安全性和治疗效果, 而成为近年引人瞩目的新技术和研究热点。
本研究采用晶种生长法制备Au 纳米微球, 经硅烷偶联剂表面修饰并进一步装载姜黄素, 探讨Au 纳米微球负载Cur 的载药及缓释性能, 以期改善姜黄素进入体内的缓释过程, 提高药物的生物利用度, 为癌症的积极诊治提供思路。
1 实验部分
1.1 试剂与仪器
氯金酸(HAuCl4, 分析纯), 上海贤鼎生物科技有限公司;姜黄素(分析纯), 阿达玛斯试剂有限公司; 十六烷基三甲基溴化铵(CTAB, 分析纯), 阿达玛斯试剂有限公司; 硼氢化钾(CP, 分析纯), 国药集团化学试剂有限公司; 抗坏血酸(分析纯), 西陇科学股份有限公司; 无水乙醇(分析纯), 西陇科学股份有限公司; N-氢乙基-r-氨丙基甲氧基硅烷(硅烷偶联剂KH-792, 分析纯), 上海麦克林生化科技有限公司; 硅酸四乙酯(TEOS, 分析纯), 上海麦克林生化科技有限公司。
Phenom G5 pure 台式扫描电镜, 复纳科学仪器(上海)有限公司; NICOLET 6700 傅里叶变换红外光谱仪, 美国赛默飞世尔; Agilent 8453 紫外可见分光光度计, 安捷伦科技有限公司;MINIFLEX 60 X 射线衍射仪, 深圳市莱雷科技发展有限公司;DF-101S 集热式恒温加热磁力搅拌器, 上海力辰邦西仪器科技有限公司; TGL·18C 高速台式离心机, 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 Au 种的合成
在圆底烧瓶中加入10 mL 0.10 mol/L 的CTAB 溶液和0.25 mL 0.01 mol/L 的HAuCl4溶液, 磁力搅拌均匀后缓慢加入冰水配制的0.60 mL 0.01 mol/L 的KBH4溶液, 快速搅拌2 min, 溶液于30 ℃放置2 h 后, 即得Au 种溶液。
1.2.2 Au 纳米微球的合成
取1.2.1 中所制得的Au 种溶液250 μL, 加入到50 mL 0.10 mol/L 的CTAB 和5 mL 0.01 mol/L 的HAuCl4混合溶液中,在35 ℃水浴快速搅拌下, 加入3 mL 1mol/L 的抗坏血酸溶液,并维持恒温快速搅拌6 h, 经10000 r/min 离心10 min, 弃去上清液, 沉淀用超纯水离心洗涤数次, 沉淀置于60 ℃下干燥,即得Au 纳米微球。
1.2.3 硅烷化Au 纳米微球
取1.2.2 中所制得的Au 纳米微球超声分散于5 mL 超纯水中, 加入10 mL 体积比为7∶3 的乙醇水溶液, 在35 ℃水浴快速搅拌下, 加入0.02 mL TEOS, 反应2 h 后, 加入0.02 mL N-氢乙基-r-氨丙基甲氧基硅烷, 维持恒温快速搅拌4 h, 反应完成后, 经10000 r/min 离心10 min, 弃去上清液, 沉淀用超纯水离心洗涤数次, 沉淀置于60 ℃下干燥, 即得硅烷化Au 纳米微球。
1.2.4 Cur-Au 纳米微球的制备
取硅烷化的Au 纳米微球20 mg 置于250 mL 锥形瓶中, 加入10 mL 1 mg/mL 的姜黄素乙醇溶液, 放于恒温摇床中, 25 ℃恒温避光摇晃反应48 h 后, 10000 r/min 离心15 min, 保留上清液, 沉淀经无水乙醇洗涤数次后避光干燥, 即得Cur-Au 纳米微球。 称重, 记为W1。 以未经硅烷化修饰的Au 纳米微球作为对照组, 平行试验3 次。
1.3 测试与表征
(1)将未经过离心的纳米Au 溶液用超纯水稀释一定的倍数后, 以未加含Au 元素的反应溶液为空白液, 在紫外-可见光吸收光谱仪波长300 ~1100 nm 进行全波长扫描, 记录其紫外图谱。
(2)扫描电镜观察Au 和Cur-Au 的表面形貌。
(3)采用X 射线衍射仪, 选择10° ~90°进行扫描, 得到Au和Cur-Au 的相应图谱, 对相关材料进行成分分析。
(4)Au 和Cur-Au 的FTIR 分析: 采用溴化钾压片, 扫描范围4000 ~400 cm-1, 比较相关材料结构变化。
(5)采用差热分析仪测定Au 和Cur-Au 的失重情况, 测定的温度范围为20 ~800 ℃, 升温速率为10 ℃/min。
1.4 包封率和载药量、 缓释实验测定
1.4.1 姜黄素乙醇溶液的标准曲线测定
配制浓度分别为1、 2、 3、 4、 5、 6 mg/L 的姜黄素乙醇标准液, 用紫外分光光度计测定各浓度样品在427 nm 检测波长下的吸光度。 吸光度(A)为纵坐标, 以浓度(C, mg/L)为横坐标, 绘制其标准曲线。
1.4.2 包封率和载药量的测定
精密吸取适量1.2.4 中经反应离心后所得上清液, 稀释适当倍数后测定其吸光度, 通过标准曲线计算出相应浓度, 进而推算姜黄素乙醇溶液中未被纳米粒子吸附的Cur 含量, 记为W2, 10 mL 1 mg/mL 的姜黄素乙醇溶液所含姜黄素质量为W3;根据下列公式分别计算包封率和载药量。

1.4.3 Cur-Au 纳米微球体外释药
取Cur-Au 纳米微球20 mg, 用无水乙醇适当稀释后, 置于预处理好的透析袋中; 另取与Cur-Au 中等质量的纯姜黄素,同样方式处理后, 分别放置于25 mL pH 6.86 的磷酸盐缓冲液中, 37 ℃下恒温摇床振荡。 分别于0.5、 1、 2、 4、 6 h 测定透析液的吸光度。
2 结果与讨论
2.1 材料形貌结构的分析
2.1.1 Au 纳米微球的UV-Vis 光谱图分析
图1 表示Au 纳米微球溶液的紫外-可见光吸收光谱图, 从图1 可知, 在波长为545 nm 处有明显的强吸收峰, 与参考文献中所制备的Au 纳米微球特征吸收波长一致[16-17], 证实Au 纳米微球的存在。
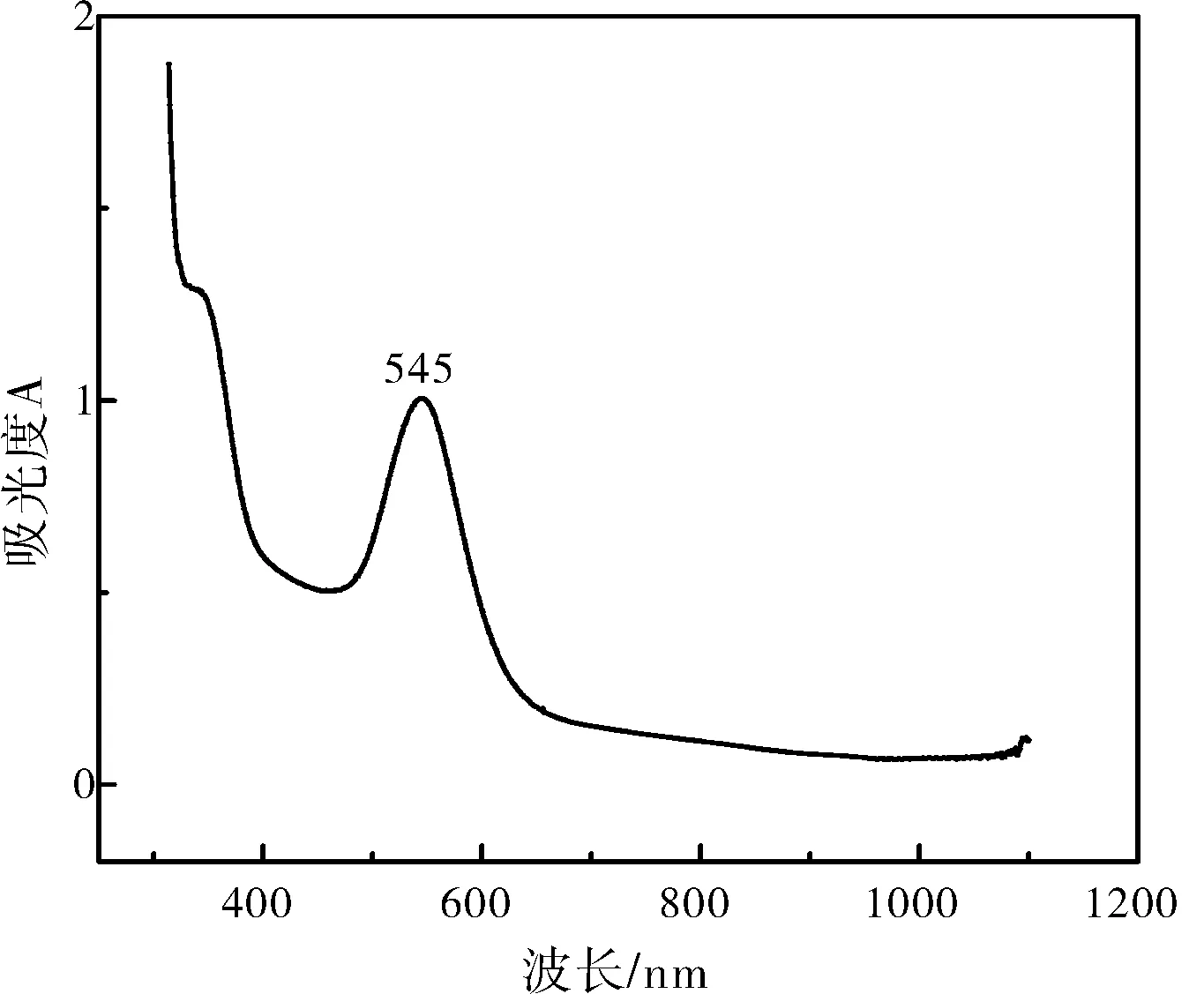
图1 Au 纳米颗粒溶液的紫外可见光谱图Fig.1 UV-Vis spectra of Au nanoparticles' solution
2.1.2 Au 和Cur-Au 的SEM 分析
图2 为Au 和Cur-Au 纳米微球材料的SEM 图, 从图2 可看出, Au 颗粒主要为球形, 粒径大小较均一, 而负载姜黄素后的Au 纳米微球粒径有变大趋势, 可能为姜黄素的黏连作用导致。

图2 Au 和Cur-Au 材料的SEM 图Fig.2 SEM diagram of Au and Cur-Au materials
2.1.3 Au 和Cur-Au 纳米微球的XRD 图分析图3 为Au 和Cur-Au 材料的X 射线衍射图, 由图3 可知,Au 在2θ 为37.88°、 44.1°、 64.42°、 77.34°, 81.68°出现尖锐的衍射峰, 其中2θ 在37.88°处为最强峰。 通过与Au 的标准XRD 衍射数据对比, 证实采用晶种生长法制备得到了粒径分布比较窄的Au 纳米颗粒, 无其他杂质峰, 说明制备的Au 具有较高的纯度和结晶度。 而载姜黄素Au 纳米颗粒的XRD 谱图出峰与Au 纳米颗粒的XRD 谱图一致, 说明姜黄素并没有改变Au基底物质结构。

图3 Au 和Cur-Au 材料的XRD 图Fig.3 XRD of Au and Cur-Au materials
2.1.4 Au、 Cur 和Cur-Au 的FTIR 分析图4 为Cur、 Au、 Cur-Au 材料的红外光谱图分析图。 由图4可知, 三种材料的红外谱图除在2300 cm-1处出峰不一致外,其余出峰基本一致, 但Cur-Au 的红外谱图出峰强度增大, 特别是在1460 cm-1处明显增强。 其中2300 cm-1处的出峰可能是由于硅烷偶联剂修饰所引起的, 1460 cm-1处的出峰强度增强是由于姜黄素的引入引起的。
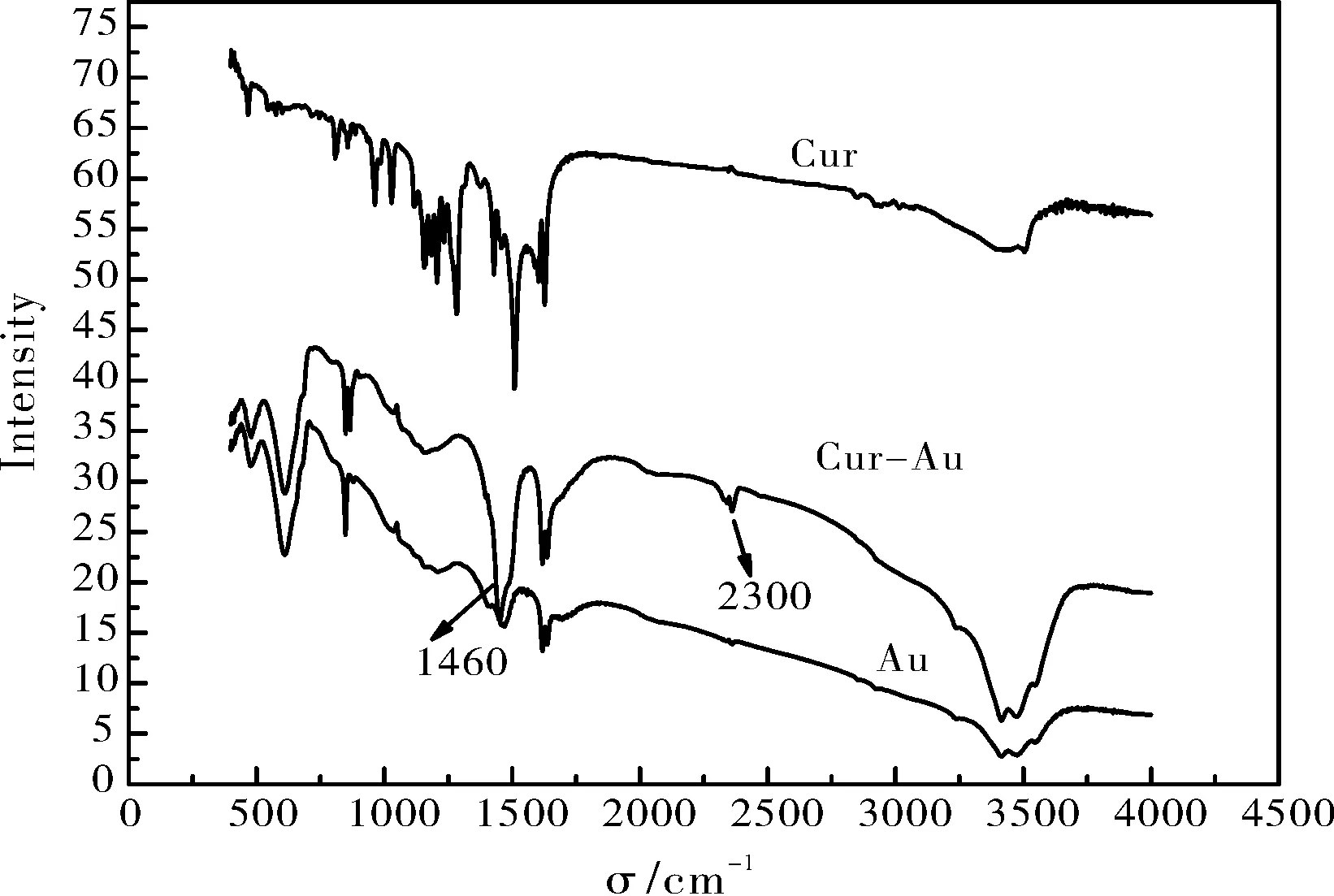
图4 Au、 Cur 和Cur-Au 材料的红外吸收光谱图Fig.4 Infrared absorption spectra of Au, Cur and Cur-Au's materials
2.1.5 Au 及Cur-Au 材料的热重图分析
图5 为Au 和Cur-Au 材料的热重图, 由图5 可知, Au 材料在经过高温灼烧后, 失重百分比由100%到93.73%, 热重损失6.27%。 而Cur-Au 材料经过相同处理后, 失重百分比由100%到88.72%, 热重损失11.28%, 考虑到由于负载姜黄素的热损失影响, 对比简单推算, 计算该载姜黄素Au 纳米微球的载药量为5.01%。

图5 Au 和Cur-Au 材料的热重图Fig.5 Thermogravimetric diagram of Au and Cur-Au's materials
2.2 材料载药和缓释的性能分析
2.2.1 姜黄素乙醇溶液标准曲线的结果与分析
图6 为姜黄素乙醇溶液标准曲线图, 从图6 可知, 其线性回归方程为A=0.1534C+0.0208(R2= 0.9993), 姜黄素乙醇溶液的浓度在1 ~6 mg/L 之间线性关系良好。

图6 姜黄素乙醇溶液的标准曲线图Fig.6 Standard curve of curcumin ethanol's solution
2.2.2 Cur-Au 材料的包封率和载药量分析
表1 为硅烷化修饰前后Au 纳米微球包封率和载药量的数据表, 由表1 可得, 硅烷化修饰后Cur-Au 纳米微球包封率的平均值为9.097%, 载药量的平均值为4.351%, 对比硅烷化修饰前的Au 纳米微球, 其负载姜黄素的载药量有明显提高。

表1 硅烷化修饰前后Cur-Au 材料的包封率和载药量(n=3)Table 1 Encapsulation and drug loading of Cur-Au before or after silanization (n=3)
2.2.3 材料的载药缓释性能分析
图7 为Cur 和Cur-Au 纳米微球的体外释药性能分析图,由图7 可知, 等质量的Cur 在1 h 处的释放率为16.06%, 1 h后的释放率快速增高, 有突释现象, 在6 h 内基本完全释放。而Cur-Au 纳米微球在0.5 h 释放率为2.35%, 6 h 仅为17.39%, 释放率低, 释放速度慢, 对比纯姜黄素的突释, Cur-Au 纳米微球具有一定的缓释作用。

图7 Cur 和Cur-Au 材料的缓释图Fig.7 Sustained release diagram of Au and Cur-Au materials
3 结 论
实验研究表明, 采用晶种生长法, 以HAuCl4为Au 源,CTAB 作为表面活性剂能够制得形貌和粒径较均匀的Au 纳米微球, 经硅烷偶联剂表面修饰后的Au 纳米微球对姜黄素具有较好的载药性能, 包封率和载药量分别为9.097%和4.351%, 姜黄素体外释放结果表明, 经修饰后的Au 纳米微球作为载体具有较好的药物缓释作用, 可为今后进一步的体内外药效试验研究提供参考依据。
