盆底功能障碍中胶原蛋白代谢机制及电针对胶原蛋白的调节
2022-04-26冉津川胡静陈炳力李超楠阮铄荃杨梦伊屈之榆侯文光
冉津川,胡静,陈炳力,李超楠,阮铄荃,杨梦伊,屈之榆,侯文光
(上海中医药大学附属岳阳中西医结合医院,上海 200437)
盆底功能包括封闭骨盆出口、承载和支持盆腔内器官、增加性快感、分娩、排大小便等,当盆底受到解剖损伤、功能退化或神经功能失调时,就可能会发生盆底疾病(pelvic floor disorders, PFDs)[1-2]。PDFs的患病率高,盆腔脏器脱垂(pelvic organ prolapse,POP)、压力性尿失禁(stress urinary incontinence,SUI)最为常见,给患者带来自卑、社交困难等影响,增加了社会经济负担[3-5]。随着研究的深入,盆底功能障碍发病机制的研究逐渐从盆底整体理论、吊床理论等解剖结构的改变聚焦到超微结构和功能的研究,目前基础和临床研究显示,盆底支持组织韧带和筋膜主要细胞成分成纤维细胞合成和分泌的Ⅰ型、Ⅲ型胶原蛋白结构变化、含量减少和其比例失调是盆底韧带、筋膜解剖结构张力降低并最终引发PFDs的原因之一[6-9]。研究显示,电针治疗盆底功能障碍疾病有效[10-11],可通过调节盆底支持组织中赖氨酰氧化酶(lysyl oxidase,LOX)、核心蛋白聚糖(decorin, DCN)、转化生长因子(transforming growth factor, TGF)-β、基质金属蛋白酶(matrix metalloproteinases, MMPs)和组织金属蛋白酶抑制物(TIMPs)、钙蛋白酶(calpain)来改变胶原结构,增加盆底支持组织中Ⅰ型胶原蛋白和Ⅲ型胶原蛋白的含量,改善盆底支持组织中Ⅰ型/Ⅲ型胶原蛋白比例,以此达到改善盆底功能障碍的目的[12-17]。盆底组织中胶原蛋白代谢和电针对胶原的调节情况如下。
1 盆底支持组织中胶原蛋白结构与代谢的影响
胶原蛋白是三股螺旋结构,胶原分子与分子之间通过醛缩合交联、醛胺缩合交联和醛醇组氨酸交联,作为细胞外基质的成分,对肌腱和韧带的功能均有影响,使胶原具有相应的力学性能[9,18-19]。Ⅰ型胶原蛋白、Ⅲ型胶原蛋白是膀胱、尿道韧带、盆底筋膜的主要蛋白成分,Ⅰ型胶原直径粗,具有高抗张强度,Ⅲ型胶原蛋白直径细,与弹性相关[6-9,20]。胶原蛋白合成和分解是胶原代谢的过程,胶原蛋白由成纤维细胞合成和分泌,通过糖基化、羟基化等,最终由胶原蛋白酶分解。LOX可调节胶原纤维的形成和形态[9,21],TGF-β能合成胶原蛋白并抑制胶原蛋白分解,DCN能通过与TGF-β结合抑制胶原蛋白合成[7,22],Calpain、MMPs和TIMPs主要分解盆底支持组织中胶原蛋白[23-24]。详见图1。

图1 胶原蛋白代谢示意
1.1 盆底支持组织中的LOX
LOX是一种铜依耐性的氧化酶,可介导不同类型胶原端肽和三螺旋结构域之间的共价交联,有助于提高组织的硬度和力学性能[9,21]。LOX可参与胶原和弹性蛋白交联的第一步,催化底物中赖氨酰残基和羟基赖氨酰残基氧化脱氨形成α-氨基己二酸δ-半醛,这些活性醛基可自发地与其他活性醛基或赖氨酰残基和羟基赖氨酰残基形成共价交联,进一步缩和形成三向、四向、五向交联产物,形成稳定的网状结构,提高ECM和组织的机械性能、胶原蛋白的拉伸强度[9,21]。
盆底支持结构组织中 LOX含量减少,可能影响胶原纤维结构和形态,引起PDFs。研究显示,SUI、POP、SUI+POP患者阴道前壁组织中 LOX蛋白较非 SUI或POP患者含量减少,可能促使胶原质量、数量下降,使盆底支持作用和控尿能力减弱[25]。POP患者子宫主韧带中弹性蛋白mRNA及蛋白的表达与LOX水平表达呈直线正相关[26]。
1.2 盆底支持组织中的TGF-β和DCN
TGF-β是一组具有多种功能的蛋白多肽,有TGF-β1、TGF-β2、TGF-β3、TGF-β1β2 共 4 种亚型,能促进成纤维细胞大量合成、分泌胶原蛋白,并抑制胶原蛋白酶的分泌、刺激胶原蛋白酶抑制剂的表达来抑制组织中胶原蛋白分解[7]。TGF-β可上调胶原蛋白的产生,加强肌肉的修复[27]。DCN是一种小分子硫酸软骨素类蛋白聚糖,主要分布于胶原蛋白丰富的组织,能通过结合 TGF-β抑制其活性,延迟胶原的组装,阻止胶原三股螺旋间正常融合,抑制胶原纤维的进一步增粗[7,22]。患者盆底支持组织中 TGF-β含量变化、DCN增高会引起盆底支持组织中胶原蛋白的含量变化,引起 PDFs[28]。研究发现,POP、SUI患者阴道前壁组织中Ⅰ型、Ⅲ型胶原蛋白均减少,且阴道前壁组织中TGF-β1含量较非SUI患者降低[29-30]。中老年女性SUI患者盆底组织中Ⅰ型胶原蛋白含量减少,TGF-β1含量亦减少[31]。且 SUI越严重,Ⅰ型胶原蛋白和Ⅲ型胶原蛋白含量越少,TGF-β1表达越多[32]。有研究发现SUI患者尿道周围结缔组织中Ⅲ型胶原含量减少,且 SUI患者尿道周围结缔组织中Ⅲ型胶原蛋白含量与DCN mRNA表达水平呈负相关[14]。激活尿道组织中TGF-β1信号传导,可增加Ⅰ型胶原、Ⅲ型胶原和弹性蛋白合成,改善尿道功能[33]。
1.3 盆底组织中Calpain
Calpain是一族钙离子依耐性水解酶,依据其激活时需要的浓度可分为 Calpain-1、Calpain-2,其广泛存在于盆底支撑性结缔组织中。在病理状态下,钙蛋白酶被过度激活,导致起细胞支撑作用的胶原蛋白被破坏,降解肌原纤维,引起盆底组织松弛[23]。
患者 Calpain-2的表达增高,或可减少盆底支持组织中胶原蛋白含量,引起PDFs。女性SUI患者尿道周围组织中 Calpain-2表达较非 SUI患者高,Calpain-1则无明显差异。SUI患者尿道周围组织中Calpain-1 mRNA未见明显异常,Calpain-2 mRNA高于非SUI患者[34]。
1.4 盆底组织中MMPs和TIMPs
MMPs家族是ECM降解过程中的重要酶类,现已发现 28种,可降解盆底基质中的胶原蛋白,降低盆底组织的机械功能,从而诱发盆底功能障碍,正常稳定状态组织中MMPs表达极少[24,35]。TIMPs是MMPs的天然抑制剂,主要通过与活化的MMPs分子以1:1比例非共价结合,抑制MMPs对Ⅰ型、Ⅲ型胶原的降解[24,35]。
盆底支持组织中MMPs和TIMPs表达的变化会引起胶原蛋白代谢改变,引起PDFs。POP和SUI患者盆底组织中MMP-1、MMP-2、MMP-3、MMP-4表达增加,TIMP-1、TIMP-2在盆底支持组织中降低[24]。SUI患者尿道周围阴道壁组织和培养的阴道成纤维细胞中总胶原蛋白浓度和Ⅰ型胶原蛋白含量较正常人明显降低,TIMP-1、TIMP-2、TIMP-3的表达水平显著降低,MMP-1、MMP-2、MMP-9的mRNA表达显著增加[36]。且SUI越严重,MMP-1、MMP-2含量越多,TIMP-1含量越少[32]。而内括约肌缺乏的女性SUI患者尿道下组织中MMP2 mRNA明显高于尿道过度活动的患者[37]。
1.5 雌激素受体(ER)与盆底支持组织
雌激素可影响纤维母细胞对胶原代谢酶的表达[9,38],绝经后女性POP患者阴道前壁组织中ER、Ⅰ型胶原蛋白、Ⅲ型胶原蛋白均减少[39]。在SUI、POP患者盆底组织中ER降低时,其胶原代谢酶也有相关变化。SUI和POP患者阴道前壁中ER与TGF-β1均减少,且雌激素受体(ER)与Ⅰ型胶原蛋白表达呈正相关[31];绝经前后的SUI、POP、SUI合并POP患者与对照组相比阴道前壁组织中LOX蛋白减少与ER表达量减少显著相关[40];绝经后 SUI患者阴道前壁组织中 TGF-β1及 ER降低[41],ERβ表达与MMP-2 mRNA呈正相关[42]。因此,ER与胶原代谢酶可能存在某种联系,但研究尚不深入。因此,探究雌激素受体与盆底组织中胶原代谢酶的关系及电针的作用仍需进一步探究。
综上所述,LOX、TGF-β、DCN、Calpain、MMPs、TIMPs、ER含量的变化会引起人体盆底支持组织中胶原蛋白含量和结构,引起PDFs的发生。
2 电针对盆底支持组织中胶原代谢的影响
电针能通过不同电针参数刺激如关元、气海、肾俞、曲骨、膀胱俞、肾俞、三阴交等穴位,增加盆底组织中 LOX的表达,抑制 Calpain、DCN的表达,影响TIMP-1/MMP-1、TIMP-2/MMP-2、TIMP-3/MMP-3的比值来增加盆底组织中胶原的合成,抑制胶原蛋白的分解,可能强化胶原蛋白结构的稳定性,从而改善盆底功能。
邢艳丽等[12]研究发现电针可使大鼠盆底耻骨联合和尾骨之间走行的耻骨肌和尿道下阴道壁、耻骨尿道韧带和尿道周围结缔组织中 LOX表达明显上调,且盆底Ⅰ型、Ⅲ型胶原蛋白含量明显增加,SUI大鼠最大膀胱容量增大。夏梦[14]使用膀胱围刺及电针疗法后发现SUI大鼠耻骨肌中LOX表达明显上升,且最大膀胱容量增大;即电针或可通过增加盆底组织中LOX的含量,提高胶原蛋白结构的稳定性,以此达到改善压力性尿失禁的症状。但该研究只对胶原蛋白含量进行检测,未对胶原蛋白结构进行更加深入的研究。张淑静等[15]研究发现电针治疗可降低SUI大鼠尿道下阴道壁、耻骨尿道韧带、耻骨尾骨肌和尿道周围结缔组织中DCN mRNA表达,表明针灸可通过减少盆底组织中DCN的含量,以此增加胶原蛋白的合成减少胶原蛋白结构的不稳定性,以此增加盆底组织的支持作用,改善盆底功能。但目前对电针治疗盆底功能障碍的 TGF-β1研究较少。邢艳丽等[13]研究显示电针治疗后发现SUI大鼠盆底组织耻骨肌和尿道下阴道壁、耻骨尿道韧带和尿道周围结缔组织中Calpain表达较SUI模型大鼠明显下降,同时盆底筋膜与韧带中Ⅰ型胶原蛋白、Ⅲ型胶原蛋白表达明显上升。针灸能减少盆底组织中 Calpain酶的表达,减少Ⅰ型、Ⅲ型胶原蛋白的分解,以此来改善盆底功能。电针能影响盆底组织中MMPs和TIMPs的表达。张淑静等[15]研究发现电针治疗可降低SUI大鼠尿道下阴道壁、耻骨尿道韧带、耻骨尾骨肌和尿道周围结缔组织中MMP-1 mRNA的表达。汤康敏等[16]研究发现电针治疗后 SUI大鼠尿道下阴道前壁组织中 MMP-1 mRNA、MMP-2 mRNA、MMP-3 mRNA、TIMP-1 mRNA、TIMP-2 mRNA、TIMP-3 mRNA表达水平降低,其中,TIMP-1/MMP-1、TIMP-2/MMP-2基因表达比值均升高,而TIMP-3/MMP-3基因表达因穴位不同而出现表达差异。总体而言,电针可降低盆底组织中 MMPs和 TIMPs的含量,影响TIMPs/MMPs的比值,减少胶原蛋白的降解,增加盆底组织的支持作用,从而改善控尿能力。详见图2。
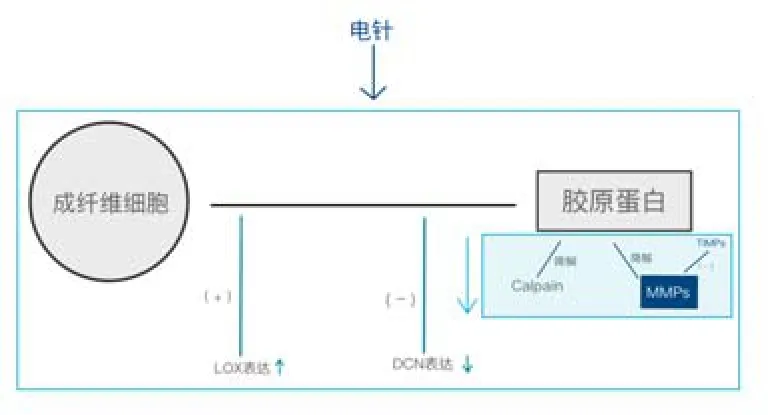
图2 电针对盆底胶原蛋白代谢的影响示意图
3 讨论
在盆底功能障碍中,盆底支持组织中胶原蛋白代谢异常将导致胶原蛋白含量减少和结构异常。电针调的含量,促进胶原蛋白合成、抑制胶原蛋白分解,改善盆底功能。目前,盆底功能障碍疾病的治疗多局限在症状管理和手术疗法[43-45],对盆底组织胶原代谢及电针对胶原代谢的调节的研究为盆底功能障碍疾病的科研和临床提供了更丰富的思路。
尽管盆底功能障碍中盆底支持组织中胶原代谢及电针对胶原的研究取得了很大的进展,但仍可进一步研究。首先,SUI的治疗选穴多样,但现针对电针的胶原代谢研究穴位多采用局部选穴,而研究发现不同穴位对胶原代谢相关酶影响不同,如电针会阳穴较肾俞穴对 TIMPsMMPs调控更为明显[16,46-48],今后应针对不同组穴,如远端选穴和局部取穴对胶原代谢的影响展开探究。第二,电针治疗SUI效果长期有效,电针治疗盆底功能障碍疾病的胶原代谢研究虽取材时间不一,部分揭示了电针治疗盆底功能障碍的近、远期疗效,为电针改善压力性尿失禁的近期疗效提供了依据,但尚不全面,缺乏对治疗结束后随访的观察,远期疗效仍需进一步研究[12-17,49];动物实验可增加观察的时间节点,探索电针治疗的时效性,在治疗结束后增加随访期的观察。最后,当前对于盆底功能障碍的电针治疗研究进展缓慢,文献研究较少,今后应积极开展相关研究,科学设计方案,为揭示针灸学在盆底疾病中的作用,提供可靠依据。
