合生元制剂对小鼠抗氧化能力和肠道菌群的影响
2022-04-25王涵刘倩郭子晨王韵婷王伶毓赵江燕张连中孙雅煊
王涵,刘倩,郭子晨,王韵婷,王伶毓,赵江燕,张连中,孙雅煊*
(1.北京联合大学生物化学工程学院,北京 100023;2.北京联合大学应用文理学院保健食品检验中心,北京 100191;3.北京鸿测科技发展有限公司,北京 100176)
肠道菌群是肠道中寄生的微生物总称,可以分为有益菌群、中间菌群和有害菌群,各个菌群相互制约,相互依赖,能够维持肠道内的微生态平衡,对保持机体健康极其重要[1]。多项研究表明,肠道微生态紊乱与许多人类疾病有关,肠道菌群失调会导致糖尿病、心血管疾病和阿尔茨海默病等疾病[2-4]。因此,机体肠道菌群的良好共生关系与机体健康有着密切的联系。
益生菌是对人体健康有益的活性微生物,可用来调节肠道内菌群平衡,促进肠道营养的吸收[5]。乳酸杆菌和双歧杆菌等益生菌可以通过积极参与宿主物质代谢的调控、免疫防御等方式建立肠道菌群的平衡,具有增强免疫力、改善血糖和血脂代谢、预防和改善酒精肝损伤等生理活性[6-9]。合生元是对宿主产生有益影响的益生菌和益生元混合物,通过促进益生菌在宿主肠道内定植增殖,同时发挥益生菌的生理活性和益生元的促生长作用,更有利于宿主健康,可以维持肠道微生物菌群平衡,改善肝硬化患者肝功能,提高免疫调节能力等[10-11]。
乳双歧杆菌V9(Bifidobacterium animalissub sp.lactisV9)是一种从健康儿童粪便中分离出来的动物双歧杆菌乳酸亚种,具有良好耐酸、耐胆盐特性[12-14]。V9菌株可以通过调节肠道菌群,刺激抗体和细胞因子的分泌,增强机体免疫力改善腹泻,也可以增加肠道内双歧杆菌和乳杆菌数量从而缓解便秘[15-16]。干酪乳杆菌Zhang(Lactobacillus casei Zhang)具有抗氧化、增强免疫、改善血脂和调节脂质代谢等功能[17-19]。此外,干酪乳杆菌Zhang还可以增加肠道中的乳杆菌属、罗氏菌属、粪球菌属等有益菌和抑制布劳特氏菌属、雷尔氏菌属等有害菌的生长,起到调节肠道菌群作用[20-21]。植物乳杆菌 P-8(Lactobacillus plantarum P-8)是从牧民传统发酵的奶制品中分离得到的一株益生菌,广泛应用于发酵食品,能够在体外抑制大肠杆菌生长,在临床试验中口服植物乳杆菌P-8能够增加肠道中的双歧杆菌,减少致病菌[22-23]。鼠李糖乳杆菌R9639分离自天然发酵酸马奶,具有良好的耐受性,能够以活的状态进入人体肠道。上述几种益生菌在调节肠道菌群方面表现出良好活性,因此研究者对这些菌株复配后的活性进行分析。白晓晔[16]利用干酪乳杆菌Zhang、乳双歧杆菌V9混合受试于便秘患者,发现混合益生菌有助于调节炎症因子,进而改善便秘;Xu等[24]利用干酪乳杆菌Zhang、植物乳杆菌P-8和乳双歧杆菌V9灌胃幼犬,发现其具有改善腹泻的功效。上述复配菌剂的活性多集中在便秘腹泻方面,鲜有研究将4种益生菌与益生元复配后对于抗氧化性、肠道菌群调节活性进行研究。本研究按比例混合4种益生菌与低聚果糖,探究合生元制剂对小鼠肠道菌群影响及其抗氧化作用,为益生菌功能食品的开发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
48只18 g~22 g BALb/c健康SPF级雄性小鼠、基础饲料[许可证号:SCXK(京)2019-0008]:北京华阜康生物科技股份有限公司。实验动物饲养于北京联合大学应用文理学院保健食品功能检测中心SPF级动物室,实验动物使用许可证号:SYXK(京)2017-0038。本研究动物实验设计和实施方案已通过了北京联合大学伦理委员会审核和批准(实验动物伦理委员会意见书编号2021-5)。
1.1.2 实验菌株
鼠李糖乳杆菌R9639、植物乳杆菌P-8、干酪乳杆菌Zhang、乳双歧杆菌V9:北京鸿测科技发展有限公司。
1.1.3 实验仪器
Infinite M NANO TECAN酶标仪:广州深华公司;UV-4802紫外可见分光光度计:尤尼柯仪器有限公司;CPA225D电子分析天平:美国Sartorius公司;Centrifuge 5702 RH-低速离心机:德国Eppendorf公司;Hula Dancer basic涡旋混合仪:德国IKA公司;Milli-Q EQ 7000实验室超纯水机:法国Millipore公司。
1.1.4 试剂
伊红美蓝琼脂、叠氮钠-结晶紫-七叶苷琼脂、乳杆菌选择性培养基、双歧杆菌选择性培养基、氯化钠:麦克林试剂公司;冰乙酸、低聚果糖:海阿拉丁生化科技股份有限公司;谷胱甘肽测定试剂盒、谷胱甘肽过氧化物酶测定试剂盒、总超氧化物歧化酶测定试剂盒、丙二醛测定试剂盒:南京建成生物工程研究所;白介素-6试剂盒、白介素-1β试剂盒:武汉华美生物工程有限公司。以上试剂均为分析纯。
1.2 方法
1.2.1 样品处理及动物分组
将乳双歧杆菌V9、植物乳杆菌P-8、干酪乳杆菌Zhang和鼠李糖乳杆菌R9639混匀(活菌数占比:V9为62.5%,Zhang为12.5%,R9639为12.5%,P8为12.5%),制备混合菌剂。48只雄性小鼠适应性喂养一周后,将其随机分为4组,每组12只,记为对照组、L组(0.2×107CFU/kg+0.05 g/kg低聚果糖)、M 组(0.4×107CFU/kg+0.1 g/kg低聚果糖)和H组(1.2×107CFU/kg+0.3 g/kg低聚果糖),每日灌胃一次,连续灌胃14 d。每天记录小鼠体重与摄食量。
1.2.2 脏器系数测定
灌胃14 d后,小鼠眼眶采血,脱颈处死,分别取小鼠心脏、肝脏、脾脏、肺、肾、胸腺和小肠并测定质量,计算脏器系数。
1.2.3 细胞因子测定
各组小鼠眼眶采血至离心管中,制备血清,严格按照ELISA说明书检测白介素-6(interleukin-6,IL-6)、白介素-1β(interleukin-1β,IL-1β)水平。
1.2.4 抗氧化指标测定
取出各组小鼠肝脏、小肠,将0.9%生理盐水和样品按9∶1的体积比进行匀浆,严格按照试剂盒说明书进行操作测定肝脏、小肠组织中的丙二醛(malondialdehyde,MDA)含量、总超氧化物歧化酶(T-superoxide dismutase,T-SOD) 活性、谷胱甘肽(glutathione,GSH)含量、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性。
1.2.5 菌群计数
第0天给予灌胃前和第14天给予灌胃后24 h,在无菌条件下捡取适量小鼠粪便,在稀释液中充分振荡混匀,10倍系列稀释至10-8。所用培养基和培养条件如表1所示。

表1 肠道菌群检验用培养基、培养条件Table 1 Medium and culture conditions for intestinal flora test
1.2.6 粪便中肠道菌群的16S rDNA高通量测序分析
灌胃合生元制剂14 d后,收集4组小鼠的新鲜粪便0.5 g以上,提取并检测样本的基因组DNA,利用引物 341F(5’-CCTAYGGGRBGCASCAG-3’)和 806R(5’-GGACTACNNGGGTATCTAAT-3’)对细菌16S rDNA的V3-V4区进行扩增。琼脂糖胶电泳纯化的聚合酶链式反应(polymerase chain reaction,PCR)产物,选择主带大小在400 bp~450 bp之间的序列,割胶回收目标条带,使用Illumina公司TruSeq DNA PCR-Free Library Preparation Kit建库试剂盒构建文库,通过定量和文库检测上机测序。
1.2.7 数据处理
使用SPSS 19.0进行数据统计分析,通过单因素方差分析对照组与各剂量组之间显著性差异。小鼠肠道菌群计数,各剂量组与空白组间采用独立样本t检验,各组自身前后比较采用成对t检验。
2 结果与分析
2.1 合生元制剂对小鼠体重与摄食量的影响
小鼠体重与摄食量见图1。

图1 合生元制剂对小鼠体重和摄食的影响Fig.1 Effect of synbiotics on body weight and food intake of mice
由图1可知,与对照组相比,给予合生元制剂各组的小鼠的体重、摄食量差异不明显。
2.2 合生元制剂对小鼠脏器影响
小鼠脏器系数见表2。
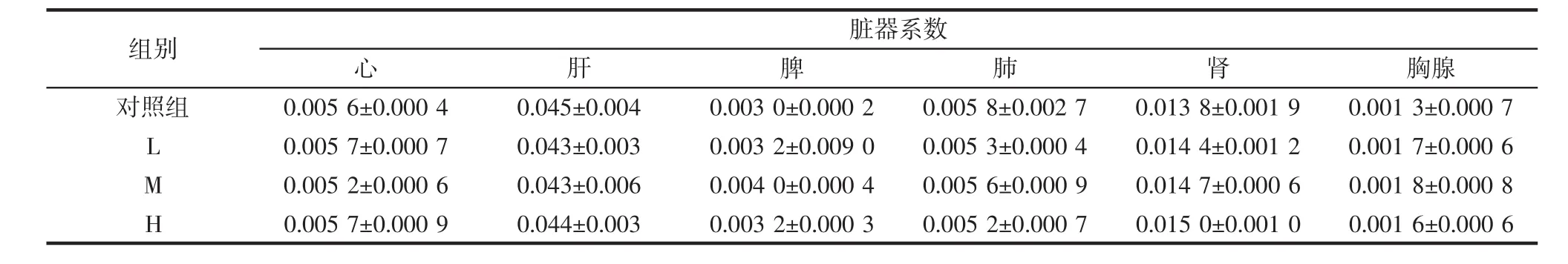
表2 小鼠脏器系数Table 2 Mouse organ coefficient
由表2可知,与对照组相比,各组小鼠的心、肝、脾脏、肺、肾和胸腺脏器系数无显著差异。
2.3 合生元制剂对炎症因子的影响
小鼠血清中IL-1β含量和血清中IL-6含量见图2。

图2 血清中IL-1β含量和血清中IL-6含量Fig.2 Serum IL-1β and IL-6 levels
由图2可知,与对照组相比,H组IL-1β含量显著下降(p<0.05),IL-6含量有下降趋势,但无显著差异(p>0.05)。IL-6参与体内各种炎症反应介导的免疫损伤,并在病毒感染及其进展中发挥重要作用[25]。IL-1β是由单核细胞和其他细胞分泌的细胞因子,可诱导关节内细胞产生其他炎症介质,加重炎症反应[26]。有相关研究发现,高脂饮食导致血清IL-1β和IL-6含量显著增加,在给予乳双歧杆菌V9后抑制了血清中IL-1β和IL-6 的产生[12]。Zheng等[27]发现,给予 1×105CFU 的干酪乳酸菌Zhang给哺乳期小鼠可以减少小鼠乳腺组织中炎症因子IL-1β和IL-6的表达。本研究中IL-1β水平显著降低,说明合生元制剂可能影响促炎因子的产生。
现如今国内的电力企业使用监测系统时结合自动化技术具有重要的影响作用,合理使用自动化在线检测,可以及时找出设备运行期间的故障,并可对设备运行的安全性起到保障作用,进而实现供电系统中的数据采集工作。通常情况下,国内的自动化监测系统在监测技术研究领域一直使用到大量的人力、物力,且监测技术的开发和利用更是为实现电力系统的自动化管理,并在减少成本的同时还可以有效提升我国电力企业的经济效益和运行效率。
2.4 合生制剂对抗氧化指标的影响
小鼠小肠及肝脏组织抗氧化指标见表3。

表3 合生元制剂对小鼠小肠及肝脏组织抗氧化指标Table 3 Antioxidant indexes of small intestine and liver tissues in mice administrated with synbiotics
由表3可知,在小肠和肝脏组织中,与对照组相比,各个剂量组T-SOD活力、GSH含量和GSH-Px活力均有明显的升高,其中,H组有极显著升高(p<0.01)。小肠组织中的M、H组MDA含量显著降低(p<0.05),肝脏组织中的H组MDA含量显著降低(p<0.05),说明合生元制剂有着较好的抗氧化能力。李欣益等[28]曾探讨益生菌双歧杆菌V9对高脂饮食诱导的非酒精性脂肪肝大鼠肝功能、氧化应激及脂代谢的影响,研究发现灌胃V9的大鼠肝脏MDA含量显著降低,SOD活力显著升高。
2.5 益生菌对小鼠肠道微生物的影响
2.5.1 合生元制剂对常见肠道微生物的影响
小鼠肠道微生物含量见表4。

表4 对小鼠肠道微生物含量的影响Table 4 Effect of synbiotics on mouse intestinal flora lg CFU/g
由表4可知,各组灌胃前各类微生物含量均无明显差异。灌胃14 d后,对照组灌胃前后对比无差异。各剂量组的肠杆菌、肠球菌这两种有害菌灌胃前后对比无显著差异,L组的乳杆菌和双歧杆菌这两种有益菌灌胃前后对比显著增加(p<0.05),M、H组乳杆菌、双歧杆菌胃前后对比极显著增加(p<0.01)。
与对照组相比,灌胃14 d后,各剂量组的肠杆菌、肠球菌均无显著差异(p>0.05)。各剂量组乳杆菌、双歧杆菌都明显增加,M、H组效果极显著(p<0.01)。
综上可以说明灌胃合生元制剂可以促进有益菌的增长,有助于调节肠道菌群的平衡。
2.5.2 对肠道微生物多样性的影响

图3 各组小鼠肠道菌群门水平的物种相对丰度Fig.3 Effect of synbiotics on relative abundance of dominant phyla
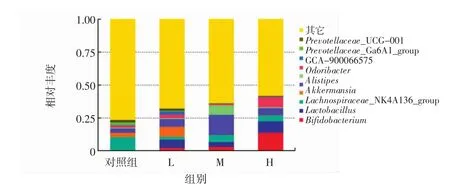
图4 各组小鼠肠道菌群属水平的物种相对丰度Fig.4 Relative abundance of intestinal microflora in mice
如图3、图4所示,经过各组的数据分析发现:在门水平上,各组主要由Firmicutes和Bacteroidota组成,与对照组相比,各个组Actinobacteriota丰度明显增加,L组 Verrucomicrobiota明显增加,M、H组 Verrucomicrobiota明显减少。在属水平上,对照组主要包括Bacteroides、Alistipes、Akkermansia、Lachnospiraceae_NK4A136_group,L组主要包括 GCA-900066575、Bacteroides、Alistipes、Akkermansia、Lachnospiraceae_NK4A136_group、Lactobacillus、Bifidobacterium,M、H 组主要包括 Bacteroides、Alistipes、Lachnospiraceae_NK4-A136_group、Lactobacillus、Bifidobacterium。与对照相比各剂量组Lactobacillus、Bifidobacterium均明显增多,Lachnospiraceae_NK4A136_group减少。
差异物种相对丰度聚类热图见图5。

图5 差异物种相对丰度聚类热图Fig.5 Heat map of relative abundance of differential taxa
由图5可以看出,与对照组相比,L组Rikenella显著增加(p<0.05)、achnospiraceae_NK4A136_group和Lachnospiraceae_UCG-001显著减少(p<0.05)。M组Roseburia、Muribaculum 显著减少(p<0.05),Bifidobacterium 显著增加(p<0.05),GCA-900066575、Lachnospiraceae_UCG-001 极显著减少(p<0.01),Rikenella、unidentified_Ethanoligenenaceae、Alistipes、Odoribacter、Lac -tobacillus极显著增加(p<0.01)。H组Bacteroides显著减少,Bifidobacterium、Helicobacter、Lactobacillus、Rikenella、Alistipes显著增加(p<0.05)。
M、H 组中 Alistipes、Bifidobacterium 和 Lactobacillus显著增加(p<0.05),Alistipes可能与肝纤维化、结肠炎、癌症免疫治疗和心血管疾病相关[29]。Sung等[30]将患有退补偿性肝硬化的患者与急性肝脑病患者之间的粪便微生物群进行比较时,发现Alistipes丰度减少与肝脑病复发的增加有关。双歧杆菌(Bifidobacterium)是人类胃肠道中的优势菌群之一,可以有效抑制肠道病原体的抑制和轮状病毒感染[31]。乳酸菌(Lactobacillus)可以改善胃肠道功能、抑制肠道内有害菌生长、提高机体免疫力等功能[32]。
MRPP分析,主要是用于分析高维度数据组间相似性的统计方法。MRPP分析见表5。

表5 MRPP分析Table 5 Multi-response permutation procedure(MRPP)analysis
对组间群落结构差异进行MRPP分析,A>0表示各组间差异大于组内差异,组间差异大,显著性小于0.05说明差异显著[33]。由表5可知,与对照组相比,各个组的组间差异均大于组内差异,其中对照组与M、H组有极显著差异(显著性<0.01)。
3 结论
根据各组小鼠肠道中菌群含量变化差异及菌群结构分析结果可知,合生元制剂可以增加小鼠肠道中双歧杆菌及乳杆菌,增加有益菌丰度,与此同时抑制炎症因子产生,增强抗氧化能力。本次研究结果进一步探究了益生菌在肠道中的作用,为研究合生元制剂在功能食品中的开发与研究提供帮助。
