天目湖流域沟塘湿地脱氮速率的时空差异
2022-04-25王子聪朱广伟朱梦圆康丽娟赵星辰
王子聪,许 海,詹 旭,朱广伟,朱梦圆,康丽娟,3,赵 锋,唐 伟,赵星辰,3
1. 江南大学环境与土木工程学院,江苏 无锡 214122
2. 中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,江苏 南京 210008
3. 中国科学院大学,北京 100049
氮是水生态系统重要的生源要素[1],通常被认为是水体初级生产力的关键限制因子之一[2]. 近30年来,人类活动使得大量活性氮进入水体,显著改变了水体的氮平衡,导致水体富营养化加剧、有害藻类水华扩张[3]. 面源污染是湖库(如太湖、滇池、巢湖)氮素的主要来源[4],50%以上的氮负荷都来自面源污染[5-7].因此,削减流域面源污染是湖库富营养化控制的关键.
湿地与森林、海洋并列为全球三大生态系统类型,其在涵养水源、蓄洪调峰、净化水质、维护生物多样性等方面起到了重要作用[8-10]. 在以农业用地为主的水库流域中,分布着大量天然或人工排水的沟渠、池塘,其能够通过截留、沉积和净化作用减少向下游输入的污染物负荷,以达到改善水质的目标[11-13]. 反硝化[14-16]与厌氧氨氧化[14,17-18]作用是厌氧菌利用水中溶解性无机氮(DIN)进行生物反应,最终将DIN转化为N2排出水体的脱氮反应,是水体氮净化的关键过程. 然而,目前关于沟塘湿地的脱氮报道多局限于氮的表观去除率方面,深入具体脱氮机制的报道较少[12-13,19];而且,沟塘湿地的脱氮机制研究多集中于农田池塘、养殖塘、果园沟渠等的反硝化作用[20-23],对厌氧氨氧化作用研究偏少[24-25]. 由于不同沟塘湿地的底物浓度、形态构造、生物组成等都可能存在差异,进而影响其脱氮能力[11,26-27],故需要加强对不同沟塘湿地脱氮速率及脱氮机制的深入研究.
天目湖沙河水库地处长江中下游流域,属于典型的丘陵山区农业流域,流域主要土地利用类型为林地(占比为54%)、农田(占比为16%)、茶园(占比为10%)[13,28]. 流域内茶园氮污染严重,单位公顷有机肥施用达到958.5 kg(以N计),是农业施肥的两倍,氮流失强度可达103.08 kg/(hm2·a)[29-30];果园氮污染同样严重,氮肥施用可高达1 400 kg/hm2(以N计)[22];在江浙丘陵地区农村,生活污水大多都直接排放或经过化粪池简单处理后排放进入环境,对地表水环境造成较大压力[31]. 目前,茶园、果园这类高污染土地利用类型周边沟塘湿地的反硝化与厌氧氨氧化作用研究较少,导致在水库流域氮管理方面缺乏相应依据.
基于此,该研究于天目湖沙河水库主要入库河流-平桥河流域,采集了流域内典型土地利用类型下沟塘湿地无扰动泥-水柱进行流动培养,并利用同位素配对技术结合膜接口质谱仪,测定反硝化速率与厌氧氨氧化速率,以阐明流域内各沟塘湿地脱氮速率及厌氧氨氧化作用对脱氮的贡献,同时探讨影响脱氮的限制性因素,以期深入了解沟塘湿地的氮滞留机制,为流域氮污染控制和水质目标管理提供科技支撑.
1 材料与方法
1.1 流域概况与采样点布设
天目湖流域位于我国东南丘陵山区,地处亚热带季风区,降雨强度大,且多集中于3~9月,除生活建设用地外,流域内主要土地利用类型已由农田、养殖塘转变为林地,主要经济作物为茶叶与果树[30,32]. 天目湖主要有3条入库河流,分别为平桥河、下宋河和中田河,平桥河流域是沙河水库流域上游的一个重要水源涵养地,流域水质主要受茶园种植、农业生产、生活污水和畜禽养殖影响[28]. 因此,在平桥河流域分别选取了流域内典型土地利用类型周边的沟渠、池塘作为研究对象,分别为茶园退水池塘、果园排水沟渠、生活污水排放池塘和入湖口河流湿地,分别简称为茶园池塘、果园沟渠、生活池塘和入湖河流(见图1).其中,茶园池塘位于茶园种植区且周边无其他因素影响;果园沟渠位于果园种植区中心地带;生活池塘处于平桥村中心,周边即为平桥村小学及居民生活区.
不同沟塘湿地基本结构如表1所示,各沟塘夏季水深有所升高,但总体变化不大,茶园池塘、果园沟渠、生活池塘和入湖河流平均水深分别为1.5、0.35、1.95、2.8 m. 湿地面积从大到小依次为入湖河流、生活池塘、茶园池塘,其中果园沟渠由于纵横分布且宽度较小,故未统计面积. 果园沟渠周边水生植物主要为菖蒲属和苦草属植物;入湖河流两岸水生植物主要为芦苇属和荇菜属植物;茶园池塘和生活池塘周边无水生植物,主要为陆生植物. 除生活池塘外,其余类型湿地均为非混凝土结构.

图 1 天目湖流域采样点的空间分布Fig.1 Spatial distribution map of sampling points in Tianmuhu Lake Basin

表 1 不同沟塘湿地的基本结构Table 1 Basic structure of different types of ditches and ponds
1.2 样品采集与分析
该研究分别于2021年春季(3月)与夏季(6月),在天目湖沙河水库平桥河流域,使用有机玻璃柱状采泥器(内径79 mm)于各类型沟塘湿地中间位置采集无扰动原状泥-水柱样品,每个点位采集4根,每根原状泥-水柱采集距离不超过1 m,其中沉积物深度为12~15 cm. 3根泥柱的两端使用橡皮塞塞紧并注满原位水,带回实验室进行流动培养,另1根现场切表层2 cm泥样,放入自封袋带回实验室分析. 每个点位采集上覆水30 L作为流动培养用水,并使用多参数水质测定仪(YSI 6600 V2,美国Yellow Stone公司)测定上覆水温度、pH和溶解氧(DO)浓度等.
水质指标测定参考文献[33],分别测定总氮(TN)、总磷(TP)、溶解性总氮(DTN)、溶解性总磷(DTP)、叶绿素(Chla)及溶解性有机碳(DOC)浓度;使用Skalar连续流动分析仪(荷兰Skalar公司,SAN++型)测定硝态氮(NO3--N)、亚硝态氮(NO2--N)、氨氮(NH4+-N)和磷酸根(PO43--P)浓度,其中NO3--N、NO2--N及NH4+-N浓度之和记为溶解性无机氮(DIN)浓度;根据参考文献[34],测定沉积物中总氮(STN)及总碳(STC)含量;利用膜进样质谱仪(MIMS)测定试验水体中溶解的28N2、29N2及30N2的信号值[35].
1.3 室内流动培养
为尽可能地还原沉积物脱氮环境,试验使用了原状沉积物柱芯流动培养法[36]结合同位素配对技术,使沉积物处于一个封闭并且有持续进出水的体系中,以获得更贴合实际的反硝化与厌氧氨氧化速率.
采集的原状泥-水柱运回实验室后,静置于与现场水温一致的恒温水浴槽中,预培养一晚,使培养体系稳定. 整个试验装置如图2所示,将带有硅胶圈的O型密封圈塞入有机玻璃泥柱中,在沉积物上方构成一个270 mL上覆水的密闭体系. 活塞上方连有Peek管供体系进出水,其中进水管位于沉积物上方约1 cm处,出水管位于O型密封圈顶端,在保证进水不扰动沉积物的前提下,整个体系上覆水能够充分混合. 进水管连接进水袋,在进水袋中加入0.4 mg/L的NaNO3,用以测定反硝化与厌氧氨氧化速率,同时避免高浓度的硝酸盐破坏原位环境[37]. 出水管连接蠕动泵,流速设置为90 mL/h,赵锋等[25]指出,该流速下培养体系较为稳定. 上述操作完成后,将培养泥-水柱放置于恒温水浴槽中,恒温避光培养3 d,每12 h取一次样. 每次取样时,使用Labco顶空进样瓶(12 mL)同时采集进水与出水样,并立即注射0.1 mL质量分数为50%的ZnCl2停止微生物反应,随后使用膜进样质谱仪(MIMS)测定水样中溶解的28N2、29N2和30N2的信号值.

图 2 原位泥-水柱流动培养示意Fig.2 Schematic diagram of in situ mud-water column flow culture
1.4 反硝化速率、厌氧氨氧化速率及厌氧氨氧化贡献率的计算
近年来由于厌氧氨氧化作用的发现,经典的同位素配对技术不再适用. Risgaard-Petersen等[38]指出,由于厌氧氨氧化与反硝化过程的吸收动力学相似,故添加的硝态氮不会改变反硝化与厌氧氨氧化之间的比例.
Thamdrup等[39]指出,厌氧氨氧化作用生成N2所需的两个氮原子分别由NO3--N与NH4+-N提供,而该试验中NH4+-N并未被同位素标记,故厌氧氨氧化作用仅会利用14NO3--N和15NO3--N分别生成28N2和29N2. 因此,总厌氧氨氧化速率( Atot)可由式(1)计算得到:

式中:P29′与P′30分别为出水时29N2和30N2的信号值,μmol/L;P29与P30分别为进水时29N2和30N2的信号值,μmol/L;Fn为15N同位素丰度;υ为蠕动泵流速,mL/h;S为有机玻璃泥柱横切面积,m2;μmol/(m2·h);Atot为总厌氧氨氧化速率,μmol/(m2·h).
经典的同位素配对技术提出时,并未发现厌氧氨氧化的存在,故试验生成的29N2实际上由反硝化与厌氧氨氧化作用共同生成,所以由反硝化作用生成29N2的速率需要总29N2生成速率(r29)减去厌氧氨氧化作用产生29N2的速率(A29)[40]:

式中:r29、r30分别为分子质量为29和30时N2的产生速 率,μmol/(m2·h);D14、D15分 别 为 利 用14NO3--N和15NO3--N进行反硝化作用的反硝化速率,μmol/(m2·h);D29、A29分别为反硝化与厌氧氨氧化作用产生29N2的速率,μmol/(m2·h). 最终,利用未被同位素标记的14NO3--N进行反应,反硝化速率(Dr)和厌氧氨氧化速率(Ar)分别如式(8)(9)所示,二者之和记为脱氮速率. 厌氧氨氧化作用对脱氮的贡献率(Ra,简称“厌氧氨氧化贡献率)如式(10)所示:

1.5 数据分析
首先对所需要分析的数据进行Shapiro-Wilk正态性检验和Levene方差齐性检验,然后对符合正态分布及方差齐性的数据利用单因素方差分析,探究不同沟塘湿地的脱氮速率是否存在显著性差异. 利用Spearman相关性分析,探究沟塘湿地脱氮速率的影响因子.
2 结果与分析
2.1 不同沟塘湿地上覆水和沉积物的理化指标
各水体的理化性质如表2所示,春季(3月),果园沟渠的TN浓度最高,为3.48 mg/L,入湖河流次之,生活池塘与茶园池塘最低. 在生活池塘中,TN浓度及NO3--N浓度最低,氮污染主要以有机氮为主,TP、NH4+-N、Chla和DOC浓度均最高.
夏季(6月),TN浓度仍是果园沟渠最高达4.36 mg/L,茶园池塘TN浓度超过生活池塘,略低于入湖河流;所有类型水体NH4+-N浓度均较低,最大值仅为0.05 mg/L. 在生活池塘中,TP、Chla和DOC浓度依然最高,NO3--N浓度最低. 随着温度的上升,夏季各水体溶解氧均有所下降,其中茶园池塘上覆水中DO浓度仅为4.82 mg/L.
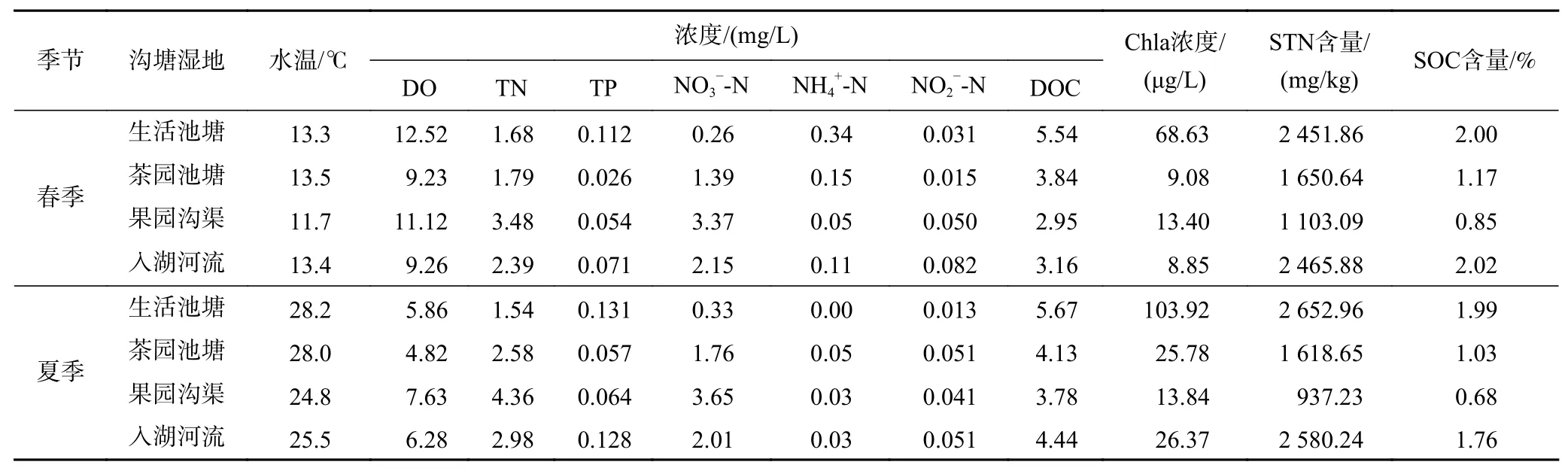
表 2 不同沟塘湿地上覆水及沉积物的理化参数Table 2 Physical and chemical parameters of overlying water and sediment in different ditches and ponds
各水体沉积物性质在春季与夏季无明显变化,生活池塘和入湖河流的STN、SOC含量均最高,茶园池塘次之,果园沟渠由于较快的水流使得其STN、SOC含量最低.
2.2 不同沟塘湿地脱氮速率

图 3 春季和夏季不同沟塘湿地的脱氮速率Fig.3 Nitrogen removal rates of different ditches and ponds in Spring and Summer
如图3所示,各沟塘脱氮速率差异性显著. 春季反硝化速率和厌氧氨氧化速率在生活池塘中均最低,分 别为(2.97±0.46)和(7.62±0.68) μmol/(m2·h),远小于其他沟塘湿地. 而反硝化速率在果园沟渠中最高,为(87.78±17.93) μmol/(m2·h),厌氧氨氧化速率在入湖河流中最高,为(46.68±14.56) μmol/(m2·h). 脱氮速率从大到小依次为果园沟渠、入湖河流、茶园池塘、生活池塘,范围为(10.59±2.45)~(107.65±37.44) μmol/(m2·h),平均值为70.73 μmol/(m2·h).
夏季,随着温度的升高,脱氮速率有所升高. 反硝化速率和厌氧氨氧化速率在生活池塘中依然最低,分别为(17.50±1.90)和(14.57±3.05) μmol/(m2·h).不同于春季,夏季反硝化速率在茶园池塘最高,达(108.92±18.53) μmol/(m2·h),而厌氧氨氧化速率在入湖河流中最高,为(63.77±7.03) μmol/(m2·h),脱氮速率范围为(32.07±2.89)~(150.1±38.09) μmol/(m2·h),平均值为112.36 μmol/(m2·h).
由图4可见,春季生活池塘和茶园池塘的厌氧氨氧化贡献率较高,夏季分别下降了26.82%、14.98%;果园沟渠和入湖河流的厌氧氨氧化贡献率在春季和夏季变化不大,平均值分别为21.17%、48.99%. 春季和夏季不同沟塘湿地的厌氧氨氧化贡献率范围分别为18.93%±8.13%~71.93%±4.09%、23.42%±4.95%~49.27%±4.1%,平均值分别为45.45%、36.26%.

图 4 不同沟塘湿地厌氧氨氧化作用对脱氮的贡献率Fig.4 Contribution of anammox to nitrogen removal of different ditches and ponds
3 讨论
3.1 不同沟塘湿地脱氮能力的主要控制因素
相关性分析结果(见表3)表明,反硝化速率与NO3--N浓度呈显著正相关(P<0.05),即上覆水中NO3--N浓度是反硝化速率的限制性因素,这在水塘[7]、入海口[16]、河流[26]、湖泊[41]等中均有报道. 春季和夏季生活池塘的反硝化速率均较低,这主要是受到了NO3--N浓度的限制,而春季生活池塘的反硝化速率仅为2.97 μmol/(m2·h),显著低于其他水体,这主要是其较低的NO3--N本底值限制了反硝化作用的进行;同时,春季生活池塘较高的NH4+-N浓度会使亚硝酸盐氧化作用受到抑制,导致硝化作用停止于NO2--N阶段[42],NO3--N供应的限制也是其反硝化速率极低的原因.

表 3 反硝化速率、厌氧氨氧化速率与环境因子间的相关性Table 3 Correlation between Denitrification and Anammox rates and environmental factors
如表3所示,DOC浓度与反硝化速率并不相关,SOC含量则与反硝化速率呈负相关. 其他研究多报道反硝化速率与有机碳浓度呈正相关[21,26,43],但Zhong等[44]在太湖梅梁湾的沉积物添加碳源试验中发现,碳对反硝化速率无明显作用;李如忠等[7]在巢湖的研究发现,添加碳源对反硝化速率有明显抑制作用,这一方面可能是与有机碳的有效性有关,另一方面可能是脱氮底物不足导致. 在夏季茶园池塘中,反硝化速率为108.93 μmol/(m2·h),高于其他水体,但其NO3--N和有机碳浓度均非最值,说明在不受其他环境因素的限制下,水体较低浓度的DO能够为沉积物反硝化过程提供合适的反应环境[7].
已有研究表明,厌氧氨氧化受到NO2–-N浓度的限制[16-17,45-46],该研究的厌氧氨氧化速率也与NO2–-N呈显著正相关(P<0.05). 春季生活池塘的厌氧氨氧化速率最低,为7.62 μmol/(m2·h),这可能是由于春季生活池塘较高的NH4+-N浓度会对厌氧氨氧化产生抑制作用[46];同时,由于厌氧氨氧化菌不仅可以利用NO2–-N作为电子受体,还可以利用NO3–-N作为电子受体[25,47],而春季生活池塘较低的NO3–-N浓度也会限制厌氧氨氧化作用的进行. 春季和夏季入湖河流厌氧氨氧化速率的平均值为55.23 μmol/(m2·h),显著高于其他研究水体,这一方面是由于入湖河流有着相较于其他水体最高的NO2–-N浓度;另一方面由于入湖河流较高的SOC含量能够促进厌氧氨氧化反应底物的生成,从而提高厌氧氨氧化菌的生物量[48-49].
总的来说,作为反硝化与厌氧氨氧化作用的反应底物,DIN浓度是各类型水体脱氮的主要限制因素(见表3、图3),SOC含量在一定程度上也会影响脱氮速率的高低,较高的气温与较低的DO浓度均有利于反硝化作用和厌氧氨氧化作用的进行. 反硝化速率与厌氧氨氧化速率在不同水深、面积、植物覆盖及结构特征方面并无明显差距.
3.2 厌氧氨氧化在不同沟塘湿地的脱氮贡献率
反硝化早期一直被认为是水体彻底脱氮的唯一生物途径,直到21世纪伊始,厌氧氨氧化被发现存在于淡水水体中[17],国内外学者由此展开大量研究并分析其对脱氮的贡献率. 目前,沉积物反硝化速率和厌氧氨氧化速率测定方法多样,其中常用的乙炔抑制法虽然方法简单,但反硝化速率被低估早有报道[40];而泥浆试验尽管可以处理大量样本,但其破坏了水-土界面的微环境,且添加高浓度同位素,也会对厌氧氨氧化贡献率有所低估[37,50]. 已有研究[25,36]表明,采用流动培养法能够极大地还原沉积物的原位环境,可获得更贴合实际的反硝化速率和厌氧氨氧化速率.
该试验结果显示,不同沟塘湿地的厌氧氨氧化贡献率范围为18.93%~71.93%,说明不同沟塘湿地的沉积物间有着很强的差异性. 而在国内外的已有研究中,厌氧氨氧化贡献率在不同类型水体中有着较大的变化,最低几乎为0,最高可达90%[24],如闽江入海河口为5.7%~29%[15]、上海城市河道为22.2%~48.0%[45]、白洋淀为0.67%~20.65%[18]、河床沉积物中最高可达58%[51]等. 该试验采用的原位流动培养法即保留了水-土界面的微环境,也保证了沉积物在纵向上的完整性,同时添加了较低浓度的同位素,使得厌氧氨氧化贡献率不被低估[38,50,52].
春季不同沟塘湿地的厌氧氨氧化贡献率波动较大,范围为18.93%~71.93%,最大值在生活池塘,最小值在果园沟渠;夏季生活池塘和茶园池塘的厌氧氨氧化贡献率分别下降了26.82%和14.98%,而果园沟渠和入湖河流的厌氧氨氧化贡献率变化不大. 由式(11)及图3可见,厌氧氨氧化速率较反硝化速率季节性变化较小,因此不同季节的厌氧氨氧化贡献率受反硝化速率变化的影响更大. 有研究指出,不同生境下脱氮细菌的最佳温度并不相同[24],但通常在一定范围内,随着温度的上升,脱氮速率不断升高[11]. 试验结果显示,反硝化速率和厌氧氨氧化速率均随着温度的上升而上升,但反硝化速率在生活池塘与茶园池塘上升更加迅速,使得池塘中的厌氧氨氧化贡献率在夏季有所下降,说明在池塘这种相对静止的水体中,反硝化菌对温度上升的响应可能更加强烈.
3.3 沟塘湿地脱氮能力对流域氮管理的启示
在水库型水源地中,藻类的异常增殖常常威胁着水库的水质安全,朱广伟等[53]对天目湖沙河水库的研究表明,当TN浓度低于1 mg/L时能有效限制藻类的生长,对流域氮的截留是控制天目湖藻类异常增殖的重要手段. 尽管流域内的沟塘湿地具有较高的脱氮速率[12-13],但这些沟塘湿地往往种类较多且分散,给管理带来很多困难[54]. 因此,该研究量化了流域内一些典型土地利用类型下沟塘湿地的脱氮速率,为天目湖沙河水库流域氮管理以及沙河水库水质管理提供参考;同时,在区域管理尺度上也是一个重要的补充.
以流动培养法为前提,夏季作为对比,沟塘湿地的脱氮速率大于多数水体,包括入海河口[55]、湖泊[25,41]、海湾[56]、微咸河流[57](见表4),体现出流域内沟塘湿地脱氮的高效性. 根据各水体春季和夏季平均脱氮速率计算可得,生活池塘、茶园池塘、果园沟渠和入湖河流水体单位面积的脱氮能力分别为10.43、53.90、60.16和55.11 g/(m2·a)(以N计). Zhang等[13]指出,天目湖流域氮负荷约为2 186 t,据此计算,占地面积约为流域面积0.1%的入湖河流湿地就可脱除流域0.5%的氮负荷. 因此,建议在茶园、果园这类高污染土地利用类型周边,可适当增加排水沟渠和退水池塘,以第一时间削减面源氮负荷;入湖河流湿地是面源污染进入水库的最后一道屏障,应当有效推行退耕还湿,增加湿地面积以提高入湖水质;尽管生活池塘脱氮速率相对较低,但仍高于部分湖泊、河口及海湾[42,55-56],也应受到重视.
总之,流域内这种小型的、分散的、天然或半人工的沟塘湿地是应对农业流域面源氮污染的重要手段,其能够有效削减流域面源氮负荷以减少入库氮素,进而减轻水库内的水华风险,这种低投入高收益的用地应当受到重视及正确的管理.

表 4 夏季不同类型沉积物的脱氮速率和单位面积脱氮能力Table 4 Nitrogen removal rates and nitrogen removal capacity per unit area of different types of sediment in summer
4 结论
a) 天目湖流域茶园、果园的种植造成周边水体氮素污染严重,主要以NO3--N为主;相比之下,农村生活区池塘氮污染以有机氮为主,且其DOC、TP浓度及STN、SOC含量均较高.
b) 天目湖流域内各沟塘湿地的脱氮速率均较高且季节性差异显著,DIN浓度是脱氮的主要限制因素.
c) 天目湖流域内各沟塘湿地以反硝化作用与厌氧氨氧化作用共同脱氮,二者在河流相湿地中速率相当,而池塘、沟渠主要以反硝化作用脱氮.
d) 持续的氮供应使得天目湖流域内沟塘湿地始终保持较高的脱氮速率,说明沟塘湿地是重要的脱氮热点之一,在该流域内应针对性地增加沟塘湿地.
