基于恒温隔绝式荧光RT-PCR技术现场检测牛纽布病毒方法的建立及应用
2022-04-24崔雨晨
崔雨晨,岳 华,汤 承
(西南民族大学畜牧兽医学院,成都 610041)
纽布病毒(nebovirus, NeV)可引起小牛的肠道损伤和严重水样腹泻,是导致犊牛腹泻的重要病原[1-2]。迄今为止,已有13个国家报道了NeV的存在和流行,地域上涵盖美洲、亚洲、欧洲和非洲[3-10]。作者实验室于前期已在四川、新疆、辽宁和陕西等多地检出NeV,检出率为12%~55%,证实NeV在国内奶牛和牦牛广泛存在,属于国内新发致牛腹泻病毒,且具备遗传多样性[10-12]。
NeV是嵌杯病毒科(Caliciviridaefamily)纽布病毒属(Nebovirusgenus)的唯一成员,为无囊膜的单股正链RNA病毒,基因组全长7 453~7 460 bp[13],具有两个开放阅读框(ORFs):ORF1和ORF2,两个非编码区(5′-UTR和3′-UTR)和一个多聚腺苷酸尾(ployA)。由于RdRp基因3′端相较其他基因更不易突变,多作为检测引物的设计靶点[14]。根据目前GenBank数据库中仅有的8条完整的NeV RdRp核苷酸序列的系统发育树可分为4个基因型:NB-like基因型(4条),NA1-like基因型(1条),SC-yak基因型(2条),和SC-yak-like 1基因型(1条)[13-14],4条NB-like型间的核苷酸相似性86.2%~88.0%、2条SC-yak型间的毒株核苷酸相似性90.2%;NB-like型与NA1-like型之间的毒株核苷酸相似性78.9%~85.0%,NB-like型与SC-yak型间的核苷酸相似性68.0%~68.7%,NB-like型与SC-yak-like 1型之间的核苷酸相似性69.0%~69.6%。其中,NB-like型毒株是世界范围内奶牛、肉牛和牦牛中主要流行基因型;NA1-like型毒株在我国未检出;SC-yak型和SC-yak-like 1型毒株仅在中国牦牛中检出[13,15]。
目前,有7个检测NeV的RT-PCR方法报道:4种常规RT-PCR、2种荧光定量RT-PCR和1种巢式RT-PCR[9-11,16-19],迄今尚未见基于探针法检测NeV的方法报道。由于我国NeV毒株显示出独特的进化趋势,且有新型毒株的出现,使得国外报道的检测方法对国内NeV毒株的检出效果不佳[11,19]。恒温隔绝式RT-PCR(insulated isothermal RT-PCR, iiRT-PCR)是一种基于荧光探针水解的绝缘等温RT-PCR技术,配套使用PetNAD试剂盒和POCKITTM系列手持式核酸分析仪,已广泛用于多种动物疫病的现场检测[20-26]。由于SC-yak型与其他型的核苷酸相似性只有61.8%~68.7%,因此无法和其他型毒株建立通用引物,本研究旨在建立检测NB-like和NA1-like及SC-yak-like 1基因型NeV的iiRT-PCR方法,为国内NeV的快速检测提供新的工具。
1 材料与方法
1.1 病毒(菌)株与临床样本
NeV阳性核酸由本实验室保存;进行特异性检验的阳性样本:牛冠状病毒(bovine coronavirus, NeV, SWUN-7907)、牛诺如病毒(norovirus, NoV)、牛病毒性腹泻病毒(bovine viral diarrhea virus, BVDV, SWUN-2011)、牛A群轮状病毒(bovine rotavirus A, BRVA, SWUN-6554)、牛凸隆病毒(bovine torovirus, BToV);牛大肠埃希菌(SWUN-4007)、牛都柏林沙门菌(SWUN-4790)、牛产气荚膜梭菌(SWUN-1103);牛瑞氏隐孢子虫、牛艾美尔球虫均保存于本实验室。
101份犊牛腹泻粪便样本于2020—2021年采自四川省,22份奶牛腹泻粪便样本采自西昌市的4个奶牛养殖场,35份肉牛粪便样本采自阆中市的3个肉牛养殖场,44份牦牛腹泻粪便样本采自红原县和若尔盖县的7个牦牛养殖场,由本实验室保存。
1.2 主要试剂
TrizolTMReagent、Prime scriptTM反转录试剂盒、Premix ExTaq(Probe qPCR)、DNA Marker等购于宝日医生物有限公司;pClone007 载体、EHA105感受态细胞等购于擎科生物科技有限公司;DEPC试剂购于SIGEMA生物公司;PetNAD 核酸萃取试剂盒购于金瑞鸿捷(厦门)生物科技有限公司。
1.3 主要仪器
POCKITTM智能型核酸分析仪(金瑞鸿捷公司,中国厦门);荧光定量PCR仪(博日公司,杭州);cubeeTM小型高速离心机(金瑞鸿捷公司,厦门);各量程移液器(Eppendorf 公司,德国);高速冷冻离心机(长沙湘仪离心机仪器有限公司,湖南);凝胶成像系统(上海天能科技有限公司,上海)。
1.4 引物、探针的设计与合成
下载并筛选出登录于GenBank的长度≥550 bp的国内外全部49条NeVRdRp基因序列,以高度保守的基因序列区域为基础设计了引物和探针,扩增的目的片段位于基因组的4 761―4 850 bp处(Bo/LZB-1/17/CH株)长度为90 bp,引物序列(F:5′-CAGCCYGTCTGGGTGAAT-3′;R:5′-CTGGATRGTTCTGACTTCGG-3′);探针序列:VIC-ACCACGAAGCCCARCCAAT-MGB,位于基因组的4 801―4 819 bp处。引物和探针均由北京擎科生物科技有限公司成都分公司合成。
1.5 核酸的提取
1.5.1 RNA的提取及反转录 采用Trizol法提取RNA,反转录使用Prime scriptTM反转录试剂盒(宝日医生物有限公司),反转录后-20 ℃保存备用。现场检测样本使用PetNAD核酸萃取试剂盒进行提取,反转录所需的Prime scriptTM反转录试剂盒中的2号反转录酶经优化预混后,于iiRT-PCR反应中同步进行。
1.5.2 DNA的提取 使用酚-氯仿法提取“1.1”中的细菌和寄生虫DNA,-20 ℃保存。
1.6 NeV阳性标准品的制备
将NeV的cDNA作为阳性模板,用“1.4”中设计的引物进行RT-PCR扩增,得到的产物使用电泳鉴定,送北京擎科生物科技有限公司成都分公司进行经测序对比无误并返样。将返样的产物用pClone007载体、EHA105感受态细胞进行克隆转化,送北京擎科生物科技有限公司成都分公司进行测序并返质粒,将质粒作为阳性标准品。
1.7 iiRT-PCR反应体系的优化
50 μL iiRT-PCR反应体系中Premix ExTaq预混酶为25 μL,反应体系主要是优化探针浓度10 μmol·μL-1(0.05~0.35 μL)、引物浓度10 μmol·μL-1(1~4 μL)、模板量(0.5~3.5 μL),以iiRT-PCR反应前后荧光比值在2~3用量为最佳,以控制变量法确定各自最优浓度及用量[25]。
1.8 现场检测NeV的iiRT-PCR预混试剂的制备
为了满足现场检测,对“1.7”中描述的反应体系进行了预混优化。在对反应体系进行筛选后,将检测10份样本需要的检测试剂按比例分装预混为一管,然后进行避光保存。反转录就在该PCR反应管中完成,使用时只需加入模板即可开始检测。-80 ℃避光保存备用,可保存4周以上;使用干冰避光保存运输至现场,也可保证现场使用效果。
1.9 iiRT-PCR的评价
1.9.1 特异性评价 用建立的iiRT-PCR方法对“1.1”中的病毒、菌株和寄生虫进行检测,以评价本试验建立方法的特异性。
1.9.2 灵敏性测定 将“1.6”中制备的阳性质粒进行10倍递增稀释,递增稀释样品后,使用建立的iiRT-PCR方法检测,确定该方法检测下限。
1.9.3 稳定性评价 用本研究建立的方法对阳性标准品的3个连续稀释度分别进行3次重复检测,以评价该方法的稳定性。
1.10 比较4种检测方法对临床样本中NeV的检出率
采用本试验建立的方法和已报道的两种荧光定量RT-PCR方法[16-17]以及目前国外使用最为广泛的巢式RT-PCR方法[19],分别对“1.1”中临床样本进行检测并比较检出率,4种检测方法信息见表1。如果4种方法所检出阳性样本编号有所不同,则对其PCR产物进行测序,以验证检测结果的准确性。

表1 4种检测方法信息
1.11 NeV和其他病原混合感染情况
检测“1.1”中的临床样本中阳性样本与BVDV、NoV、BRVA、BCoV、BToV的混合感染情况。
2 结 果
2.1 引物的特异性
使用本试验所建立的引物对2个阳性样本及1个阴性样本进行RT-PCR检测(图1),结果显示,3个阳性样本均检出,阴性不检出,将检出的样本进行测序证明检测无误,说明本试验的引物特异性好。
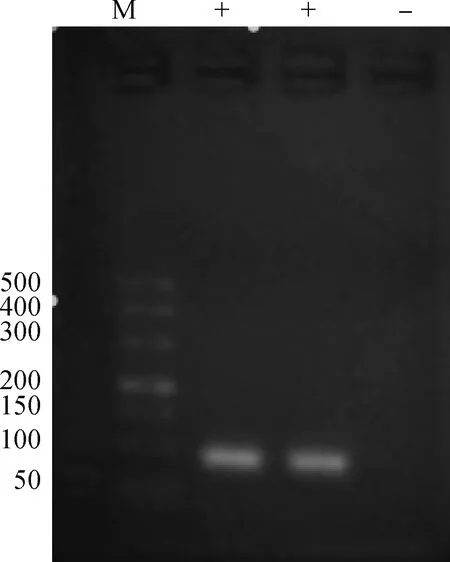
M.DNA相对分子质量标准(50~500 bp);+.阳性样品;-.阴性对照
2.2 优化的反应体系
经过筛选优化的iiRT-PCR反应体系:5 U·μL-1的Taq酶(预混酶)25 μL,10 μmol·μL-1上下游引物各3 μL,10 μmol·μL-1探针0.3 μL,20 U·μL-1反转录酶0.5 μL,模板1 μL,使用DEPC H2O补足50 μL。
2.3 iiRT-PCR的特异性评价
本研究建立的NeV iiRT-PCR方法仅对NeV的阳性核酸样本结果为阳性,对“1.1”中的无关病原不检出,表明NeV iiRT-PCR方法的特异性良好。
2.4 iiRT-PCR稳定性评价
用本研究建立的方法对阳性标准品的3个连续稀释度分别进行3次重复检测,批间变异系数(CV)为3.07%~3.12%,批内变异系数(CV)为2.45%~3.01%,表明本研究建立的NeV iiRT-PCR方法稳定良好。
2.5 iiRT-PCR灵敏性检测
本研究制备的阳性质粒拷贝数为5.38×1010copies·μL-1,10倍递增稀释样品后检测用于灵敏性检测,结果显示,本研究建立的iiRT-PCR方法对NeV的检测范围是5.38×1010~5.38 copies·μL-1,核酸最低检限测为5.38 copies·μL-1。
2.6 iiRT-PCR对临床样本中 NeV 的检测
本试验所建iiRT-PCR检测方法对“1.1”的粪便样本中NeV的平均检出率为64.36%,其中奶牛腹泻粪便样本中NeV的检出率为81.8%、肉牛腹泻粪便样本中NeV的检出率为68.6%、牦牛腹泻粪便样本中NeV的检出率为52.2%,优于两种荧光定量RT-PCR[16-17]和巢式RT-PCR方法[19]检测结果,见表2。并且,本试验所建检测方法检出的阳性样品包含了其他3种方法所检出的所有阳性样本。

表2 4种检测方法对临床样本的检测结果
2.7 NeV和其他病原的混合感染情况
65个检出NeV阳性的临床样本中有22个仅感染NeV,剩下43个NeV阳性样本存在与其他4种肠道病原的混合感染,详细情况见表3。
表3 NeV与其他腹泻病毒的混合感染
2.8 现场检测结果
按照“1.8”中的方法将检测试剂预混之后,对18份犊牛(≤3月龄)腹泻粪便样本进行了现场检测,结果显示,18份检测样本中,11份为NeV阳性,7份为NeV阴性,检出率为61.1%。将这18份临床样本带回实验室后,使用本试验建立的iiRT-PCR方法进行检测,检测结果与现场检测结果一致,表明本试验建立的iiRT-PCR方法的检测试剂预混后可满足现场检测的使用。
3 讨 论
NeV可引起小牛的肠道损伤和严重水样腹泻,是导致犊牛腹泻的重要病原[1,2,27]。本实验室前期研究证实,NeV在我国多地区的奶牛和牦牛中广泛流行,是引起我国牛腹泻的新发病原[10-12]。作者分析了GenBank中全部49条NeVRdRp基因序列,以高度保守的基因序列区域为基础设计引物和探针,建立了可以检测NeV 的iiRT-PCR方法,具有良好的稳定性和特异性,灵敏度为5.38 copies·μL-1,为NeV的NB-like基因型、NA-like基因型、SC-yak-like 1基因型检测提供了新的方法,满足了主要流行毒株的检测需求。为满足现场检测的需要,作者对检测试剂进行了预混优化,使用时只需将预混试剂转移至iiPCR反应管中,再加入需检测的RNA即可开始检测,RNA所需要的反转录步骤同时进行,可减少加样次数,避免污染;配套使用PetNAD试剂盒与POCKITTM检测仪,从核酸提取到汇报结果只需1 h,可节省时间。
比较试验表明,本方法对奶牛、肉牛和牦牛腹泻粪便样本中的NeV检出率都优于1.10中其余3种已报道的方法中[16-17,19]。作者选择4种方法检出结果均为阳性的临床样本,将其做10倍递增稀释,再用4种方法同时进行检测,结果表明,本试验建立的iiRT-PCR灵敏度与TB Green real-time RT-PCR方法[17]的灵敏度为同一数量级,比文献[16]报道的荧光定量RT-PCR方法高10倍,比文献[19]报道的巢式RT-PCR方法高100倍。此外,与GenBank中登录的国内NeV RdRp序列相比,文献[19]报道的巢式RT-PCR方法和文献[16]报道的SYBR Green real-time RT-PCR方法的上下游引物扩增位点均存在不同程度的序列不匹配现象,如:文献[16]报道的荧光定量RT-PCR方法上游引物(18 nt)与国内部分毒株的RdRp 序列相比有10个位点存在点突变(G1T、G4A、T7C、A9G、G10A、T13C、C16T、A17G、A19TC、C20T),而其下游引物(20 nt)存在4个位点存在点突变(T1A、T5A、A6G、T18C),这种引物与扩增序列不匹配的现象会影响所建方法的检出效果。
本试验检测了101份采自四川省的犊牛腹泻样本,NeV的平均检出率为64.36%,在奶牛、牦牛和肉牛中的检出率分别为81.8%、52.2%及68.6%,进一步证实NeV在四川牛群中广泛流行,并且NeV与BCoV、BNoV、BRVA和BVDV 4种病毒中的一种或多种的混合感染达到66%(表3),这种混合感染将导致诊断更复杂,并使犊牛腹泻的临床治疗更加困难。由于NeV是新发病原,我国在犊牛腹泻诊断时更多考虑BCoV、BVDV和BRV等几个常见致牛腹泻的病毒,对NeV考虑较少。根据本试验得到的数据,建议应将NeV纳入犊牛腹泻病原的常规检测。尽管已经证实NeV是一个重要的新发犊牛腹泻病原,但目前尚无病毒分离体系,也无特异性免疫预防和治疗制剂,因此,研究基于VP1的亚单位疫苗可能是一个防控NeV的有效途径。
4 结 论
成功建立了检测NeV的iiRT-PCR方法,具有稳定性好、特异性强和灵敏度高的优点,既可用于实验室检测NeV,也可配合PetNAD核酸萃取试剂盒和POCKITTM系列手持式核酸检测仪实现现场检测,为NeV的快速检测提供了有力的工具。
