CTA源图像上CT值变化率预测急性脑梗死后脑实质出血:基于ASPECTS软件脑梗死灶评估
2022-04-24程晓青施佳倩吴航周长圣朱武生卢光明
程晓青,施佳倩,吴航,周长圣,朱武生,卢光明
出血性转化(hemorrhagic transformation,HT)是急性缺血性卒中(acute ischemic stroke,AIS)自然演变发生或者再灌注治疗后的常见并发症,可分为出血性梗死(hemorrhagic infarction,HI)和脑实质出血(parenchymal hemorrhage,PH)[1]。HI被视为缺血性卒中自然病程的一部分或再通成功的标志,其改变临床预后的可能性较小[2-3],而PH在再灌注治疗后的发生率较高,与早期神经功能恶化和高死亡率相关[4]。通过影像学评估,对HT患者严重程度进行分层及预测PH的发生,对制订治疗策略至关重要。
既往的研究证实影像学检查中的一些定性或半定量参数,如早期静脉充盈征、FLAIR像上高信号、血栓负荷评分和侧支代偿评分等,可以预测HT的发生,但是较少用于区分HT和PH[5-8]。渗透性成像利用动态对比增强MRI(DCE-MRI)或CT灌注成像(CT perfusion imaging,CTPI),通过测量对比剂离开体素的速度,定量评估血脑屏障的破坏情况,是预测HT的最重要的影像学定量指标[9-10]。但是,关于渗透性成像参数能否预测PH尚存在一定争议[9-10]。本研究利用自动化Alberta卒中项目早期CT评分(Alberta Stroke Program Early CT Score,ASPECTS)软件确定脑梗死区域,通过计算平扫CT和CTA源图像上梗死区域的CT值变化率,结合临床资料和影像学指标来预测PH,并对出血严重程度进行分层评估。
材料与方法
1.临床资料
回顾性搜集2016年4月-2020年7月在本院诊断为前循环大血管闭塞导致急性缺血性卒中患者的病例资料。纳入标准:①卒中发作至CT检查时间≤6h,并进行了CT平扫和CTA检查;②入院CTA证实存在前循环大血管急性闭塞,即病变位于颈内动脉(Internal carotid arteries,ICA)及大脑中动脉(middle cerebral artery,MCA)的M1段和M2段的近端;③美国国立卫生研究院卒中量表(National Institute of Health Stroke Score,NIHSS)评分>3;④随访时间为临床治疗后24~48 h,进行CT或MRI检查以明确有无继发出血。排除标准:①有后循环血管闭塞;②并发严重的心、肝、肾或其它器官功能障碍;③CTA图像有严重的运动伪影、中线偏移或因患者检查时的体位不正确而导致软件无法计算或者计算错误;④CTA检查时发生对比剂外渗。
记录患者的临床和影像学指标,包括年龄、性别、血管闭塞位置、梗死部位、NIHSS评分、卒中发作至CT检查的时间间隔、ASPECTS评分、侧支代偿情况和治疗方式。
2.扫描方法
使用Siemens Somatom Definition Flash双源CT扫描仪。平扫CT扫描参数:以听眉线为基线,扫描范围自颅底至颅顶,120 kV,250 mA,重建层厚5.0 mm,0.5~1.0 s/r,扫描层厚5.0 mm,层间距5.0 mm,矩阵512×512,标准重建算法。CTA扫描参数:扫描范围自颅顶至下颌水平,120 kV,280 mA,0.50 s/r,螺距1.500,视野250 mm×250 mm,扫描时间5 s,层厚0.50 mm,重建间隔0.50 mm,重建矩阵512×512,标准重建算法。利用Urich双筒高压注射器经外周静脉注射60 mL非离子型对比剂Optiray 300(300 mg I/mL;Mallinckrodt制药公司)和40 mL生理盐水,注射流率4.0 mL/s,延迟时间应用人工智能触发扫描系统,将ROI设置于颈内动脉,当ROI的CT值达到100 HU后自动触发扫描。
3.图像分析
①ASPECTS评分的计算方法:将所有患者的CT数据导入Siemens SyngoVia VB10后处理工作站进行图像分析。分别基于平扫CT图像和CTASI,使用自动化ASPECTS软件(syngo.via Research Frontier;ASPECT Score-Tool v2.0.3;Siemens Healthineers)自动勾画双侧各10个ASPECTS区域(尾状核、豆状核、内囊、岛叶,以及M1~M6皮质浅层结构),测量每个区域的CT值,该软件基于CT灌注成像梗死核心区评估的经验值[11],设定每个ASPECTS区域的CT值变化率阈值,当某区域CT值变化率低于设定的阈值,软件确定为梗死区域(图1)。每个区域正常计1分,总分10分,从10分中扣除软件确定的各梗死区的分值,最后得到每例患者的ASPECTS分值。

图1 左侧MCA闭塞致急性缺血性卒中患者。a)将CTA源图像导入自动化ASPECTS评分软件,软件自动勾画10个ASPECTS分区的范围;b)软件自动测量双侧各10个ASPECTS分区的CT值,并根据预置的阈值确定梗死区域,红色方框内为软件判定有脑梗死的ASPECTS分区的平均CT值,分别为左侧的尾状核(C)、内囊(IC)、岛叶(INS)、豆状核(L)及M1、M2、M4、M5和M6皮质浅层结构。随后,计算上述梗死区域CT值的平均值(AvCT梗死=30.69HU)以及所有对侧镜像区域的平均CT值(AvCT非梗死=35.46HU),按照公式(1)计算出CTA源图像上脑梗死区的CT值变化率为13.50%;c)48h后CT复查,显示左侧额、颞、枕叶大面积梗死区内可见PH伴脑水肿,中线结构向右侧移位。
②CT值变化率的计算:计算ASPECTS软件确定的所有梗死区域CT值的平均值(AvCT梗死)以及所有对侧镜像区域的平均CT值(AvCT非梗死),根据公式(1)计算梗死区的CT值变化率(change ratio of CT value,CRCT):
CRCT= [1-(AvCT梗死÷AvCT非梗死)]×100 %
(1)
③梗死部位分组:根据梗死位置的ASPECTS分区,将患者分为3个亚组:皮层或皮层下组(岛叶及M1~M6)、白质和基底节组(尾状核、豆状核、内囊)以及混合组。
④闭塞的血管部位和侧枝代偿评估:在CTA重组图像上对血管闭塞部位和侧支代偿情况进行评估,主要为最大密度投影(maximum intensity projection,MIP)和容积再现(volume rendering,VR)图像。将闭塞血管部位分为ICA、MCA的M1段和M2段三组。
根据Tan等[12]的评分标准对侧支代偿情况进行评分:0分为闭塞的MCA相应供血区域无侧支循环代偿;1分为闭塞的MCA相应供血区域≤50%的区域有侧支循环代偿;2分为闭塞的MCA相应供血区域>50%的区域有侧支循环代偿;3分为闭塞的MCA相应供血区域100%有侧支代偿。
4.出血评估
根据治疗后24~48 h复查MRI或CT图像,由两位神经放射学专家使用欧洲急性卒中合作研究出血评分标准(ECASS Ⅱ)对出血程度进行评估[1]。HI1为梗死区域内的小斑点状出血灶;HI2为梗死区内融合成片状的出血灶,无明显占位效应;PH1为血肿面积≤梗死面积的30%,且具有轻度占位效应;PH2为血肿面积>梗死面积的30%,具有明显的占位效应。CT上无占位效应的高密度征象在随访CT图像上消失被归类为对比剂外渗。
5.统计学分析
使用SPSS 22.0软件对数据进行统计描述和分析。所有计量资料先进行正态分布检验,采用均数±标准差描述,多组间比较采用单因素方差分析,对有差异指标进一步采用LSD-t检验进行组间两两比较;分类资料采用例数(百分比)描述,组间比较采用Pearson χ2检验。采用单因素和多因素logistic回归法分析缺血性卒中患者发生PH及PH2的危险因素。采用ROC曲线评价相关指标预测缺血性卒中患者发生PH和PH2的价值,以AUC≥0.70为预测效能较好。以P<0.05为差异有统计学意义。
结 果
1.基本临床资料
共209例患者发生前循环血管闭塞导致的急性缺血性脑卒中,均行平扫CT和CTA检查,卒中发作至CT成像时间≤6 h。37例患者被剔除,原因包括图像质量不佳或运动伪影(13例)、有陈旧性脑梗死(5例)、合并后循环梗死(6例)、缺少随访影像资料(9例)及对比剂外渗(4例)。最终,共172例患者符合研究要求,平均年龄(57.56±11.07)岁。
所有患者中,81例(47%)进行了血栓切除术,43例(25%)进行了桥接治疗(静脉溶栓+血栓切除),15例(8.7%)接受了静脉溶栓治疗,33例(19.2%)接受了药物治疗。随访影像检查证实67例患者发生了HT:HI1 4例(6%),HI2 21例(31%),PH1 29例(43%)和PH2 13例(19%)。
2.不同出血转化组间各项指标的比较
不同出血转化组间各项临床资料和影像特征的比较见表1。三组间仅CTASI上梗死区CT值变化率的差异有统计学意义(P<0.05),其它各项临床指标和影像特征在3组间的差异均无统计学意义(P<0.05)。进一步对CTASI上梗死区CT值变化率进行组间两两比较,结果显示PH组和PH2组CTASI上梗死区CT值变化率均高于HI组,差异均有统计学意义(P<0.05);而PH1组与PH2组之间的差异无统计学意义(P<0.05)。

表1 缺血性卒中患者不同出血转化组间各项变量的比较
3.PH相关影响因素
对表1中所有变量进行单因素logistic回归分析,结果显示CTASI上梗死区CT值变化率、平扫CT图像上梗死区CT值变化率、NIHSS评分、年龄、ASPECTS评分、侧支循环评分以及闭塞部位为ICA+MCA是 PH和PH2的风险因素(P<0.05),详见表2。

表2 PH风险因素的单因素logistic回归分析结果
分别以PH、PH2为因变量,以logistic回归分析显示组间差异有统计学意义的指标作为自变量,进行多因素logistic回归分析,结果显示:NIHSS评分和CTASI上梗死区CT值变化率为PH和PH2的独立预测因素(P<0.05),详见表3。
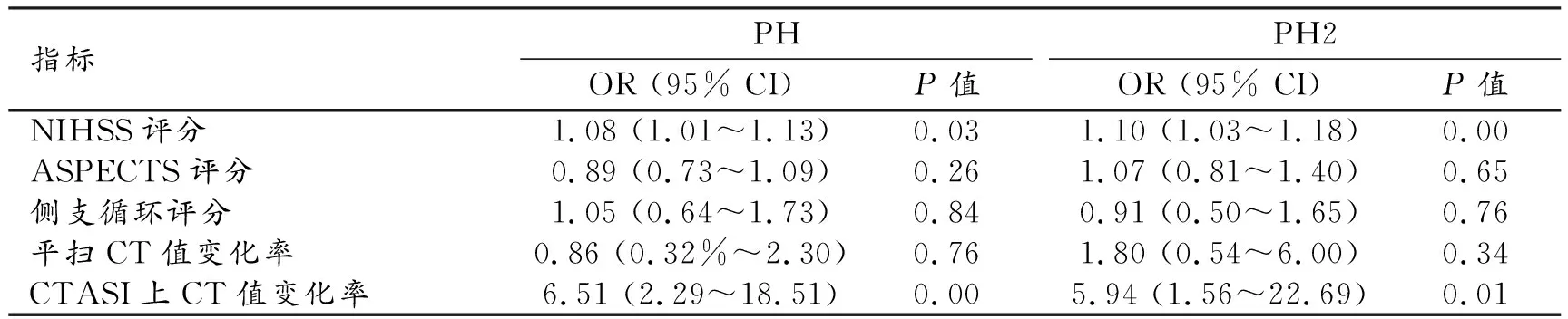
表3 PH风险因素的多因素logistic回归分析结果
4.PH风险因素的诊断效能
ROC曲线分析结果显示:预测PH和PH2时,联合诊断模型(CTASI上梗死区的CT值变化率+NIHSS评分)的AUC值均高于单一指标,AUC值分别自0.73~0.79、0.74~0.78提高到0.81、0.84(表4、图2)。
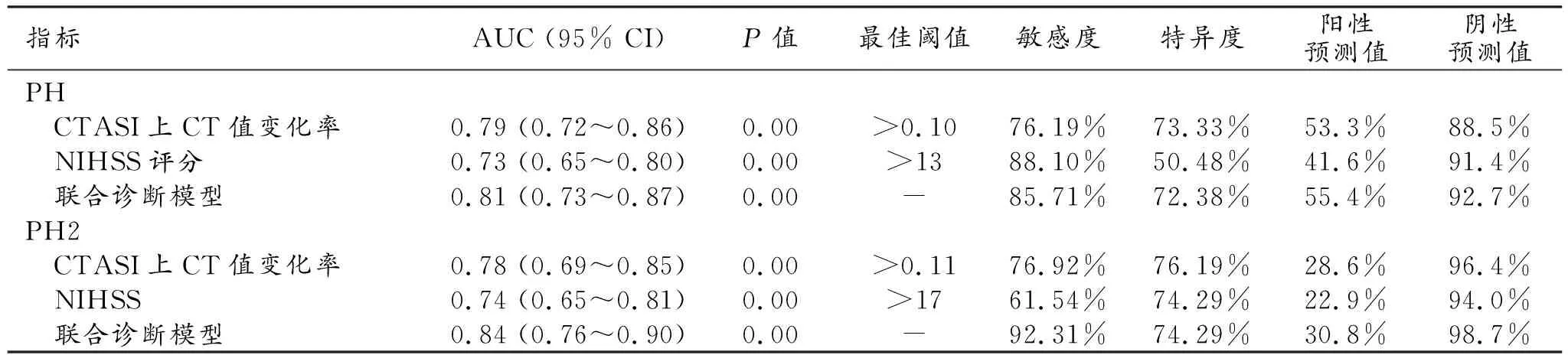
表4 各风险因素及联合诊断模型预测PH和PH2的诊断效能
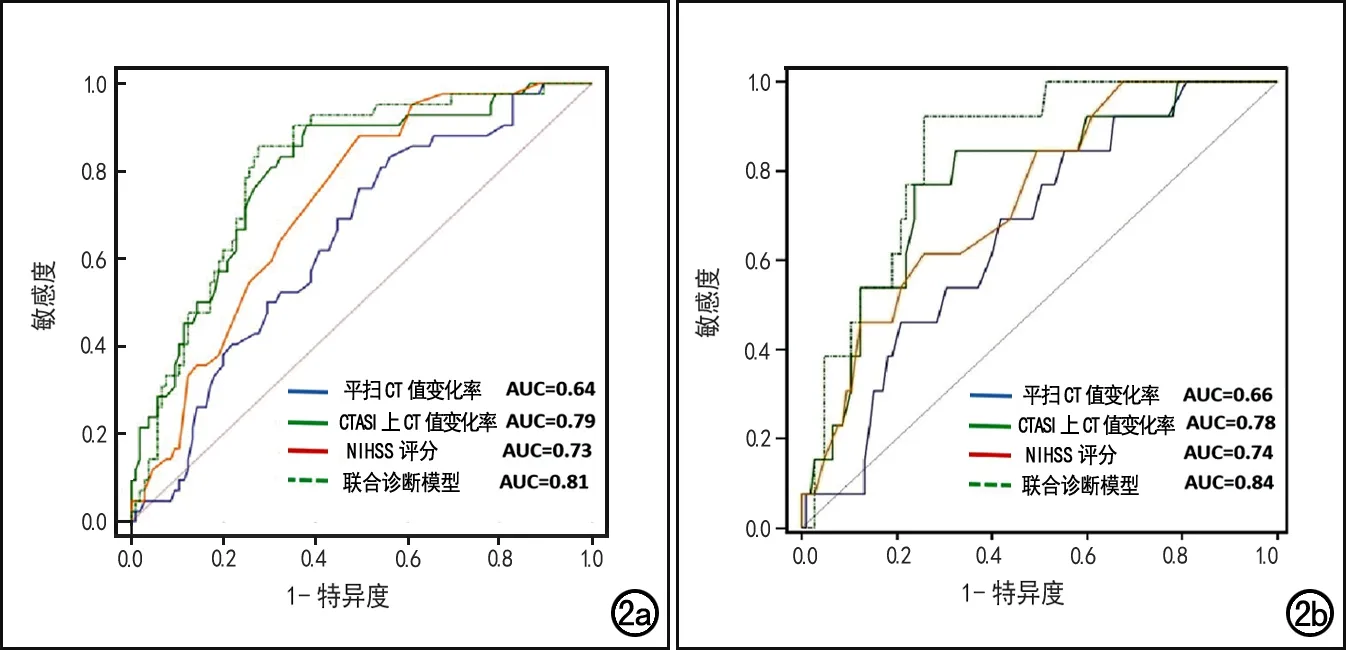
图2 ROC曲线图。a)各变量预测PH的ROC曲线,以联合诊断模型的AUC最大;b)各变量预测PH2的ROC曲线,以联合诊断模型的 AUC最大。
讨 论
本研究评估与PH相关的临床和影像学指标,对出血转化严重程度进行分层以及预测。结果显示,CTASI的CT值变化率是唯一能够鉴别HI和PH的影像学变量,并且CTASI的CT值变化率和NIHSS评分均是PH和PH2的独立预测因素,两个变量结合能够提高预测效能和预测敏感性。
本研究利用自动化ASPECTS软件计算平扫CT和CTASI梗死区域CT值的变化率预测PH的发生,结果显示CTASI上梗死区的CT值变化率及NIHSS评分是预测PH的独立风险因子,将两者结合预测PH和PH2的AUC均能达到0.8以上。已有研究证实,HI和PH不同的病理生理状态会造成患者不同的结局,再灌注治疗前对HI与PH尤其是PH2进行区分,对治疗决策的制订至关重要[1-4]。大部分研究中利用临床及影像学指标来预测HT的发生,综合评分系统如DRAGON评分、HAT评分、PROpHET评分和SEDAN评分,预测HT的AUC为0.66~0.85,但是这些评分方法没有对HT进行分层评估[13-16]。还有一些研究者利用定量影像学指标来预测PH,但研究结果有一定差异。如Yen等[17]利用CTPI的渗透性参数来预测急性缺血性卒中患者发生HT的风险,结果显示敏感度为71.4%,特异性为78.6%,但该研究中发现此变量无法准确区分HI和PH。另一项研究结果显示DWI测量的梗死区体积与PH的发生无显著相关性,而入院时的NIHSS评分是PH的独立预测因素[18]。另外一些不同结论的研究,如Yassi等[19]评估了CTPI中梗死病灶的最大峰值时间(time to maximum,Tmax)预测PH的价值,当Tmax>14s时预测PH的AUC最大,达0.75,相应的敏感度和特异度分别为79%和68%。Lee等[20]研究认为DCE-MRI中渗透性成像参数Kep是与发生PH2显著相关的唯一变量,预测敏感度为66.7%,特异度为93.8%。但是,CTPI和MRI的渗透性成像技术的应用也存在一定的局限性。对于血管闭塞导致血流量低的区域,对比剂的输送受到限制,获得的参数值会低估梗死区域实际渗透性。此外,Tmax以及渗透性成像的采集时间很长(≥45 s),在临床实践中有10%~25%的患者因运动伪影或静脉输出功能曲线异常而导致无法重建[21-22]。而本研究中利用ASPECTS软件自动定位梗死区,可减少评估者之间的差异,适合在急诊情况下使用,评估效能与渗透性成像相当,是一种更标准化的方法,也是渗透性成像的一种可替代的评估方式。
值得注意的是本研究中CTASI图像上梗死区的CT值变化率是区分HI和PH的唯一有统计学意义的指标,其诊断效能优于平扫图像上梗死区的CT值变化率。一方面原因是已有研究证明CTA源图像评估的梗死范围与DWI或最终随访显示的梗死范围相当[23-24]。也有研究进一步证明利用自动化ASPECTS评分结合CTA源图像预测急性缺血性卒中患者最终梗死范围和临床预后较平扫CT更加可靠[25]。因此,使用CTA源图像确定梗死范围可能优于平扫CT。另一方面,CTA源图像与平扫CT显示的低密度区域代表了不同的病理生理改变。平扫CT上所测量的CT值反映了单位脑组织的含水量,而CTA源图像上缺血区域与非缺血区域之间CT值的差异只有一部分是脑组织水肿造成的,其次还受到组织内对比剂碘浓度的影响。因此在本研究在CTA源图像上,梗死组织的强化减低,对侧脑组织正常强化,导致两侧大脑CT值差异增加。因此,本研究中CTASI上梗死区CT值变化率预测PH的最佳阈值较平扫CT值变化率高3%以上,预测效能也更优。
由于急性缺血性卒中患者发生PH是多因素的过程,我们进一步评估了临床基线资料以及其它影像学变量可能对PH的影响。根据最近一项针对取栓后发生PH情况的研究显示,年龄大、吸烟、入院ASPECTS评分低、全身麻醉和侧支循环代偿不良是PH的独立预测因素[26]。另一项研究也发现,高龄是症状性HT的独立预测因素,这可能与高龄患者脑小血管病的比例较高有关[27]。DRAGON评分也将年龄作为评分的主要组成部分[13]。此外,一项关于血管串联闭塞血栓切除术后HT的研究结果表明颈动脉末端闭塞是术后PH发生的高危因素,可能与侧支循环代偿不良有关[28]。本研究结果进一步证实了上述研究结果,侧支循环差、ASPECTS评分低、高龄、合并颈动脉末端闭塞均是PH和PH2的预测因素,但是在多因素回归分析中,仅NIHSS评分和CTASI上CT值变化率为预测PH和PH2的风险因素。
本研究存在一些局限性。首先,本研究侧重于影像学变量预测PH的发生,相关的临床和实验室指标未纳入分析,也缺少对随访后临床预后的相关分析。其次,本研究纳入的患者包括了再灌注治疗的患者以及药物治疗的患者,因此患者的基线ASPECTS评分和NIHSS评分比以前研究中样本的更低,这可能是本研究中PH发生率较高的原因。第三,自动ASPECTS软件对于一些中线偏移或有运动伪影干扰的患者,可能导致软件无法计算或者计算错误,限制了其临床应用。
对于急性前循环大血管闭塞性缺血性卒中患者,CTASI上梗死区的CT值变化率和NIHSS评分是PH的独立预测因素,将两个指标联合能够有效预测PH的发生,指导临床治疗。此外,自动化ASPECTS软件为本研究提供了快速、标准化的评估工具,人工智能软件的应用还需要更大样本量,前瞻性的研究为今后临床普遍应用提供充足的依据。
