MAC30表达水平对非小细胞肺癌患者化疗效果及预后的影响
2022-04-23郑大炜
郑大炜 郭 娜 孙 辉
根据2018年WHO统计数据显示,全球新发肺癌病例超过200万人,因肺癌导致的死亡人数超过170万[1],而在我国肺癌的发病率位列所有恶性肿瘤第一位,且近年来患病人数呈现上升和年轻化的趋势[2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的80%以上,具有恶性程度高、易复发和转移等特点[3],早期NSCLC发病隐匿且缺乏相关诊断指标,常导致患者预后不良的发生[4]。随着医疗事业的进步,各种靶向药物、免疫制剂在治疗NSCLC中取得良好效果[5],但患者5年生存率仍低于20%。目前对NSCLC发病分子机制的研究尚不完全明确,寻找新的标志物,完善疾病的分子机制对NSCLC的诊疗及预后评估具有重大意义。脑膜瘤相关蛋白(meningioma associated protein 30,MAC30)属于胰岛素样生长因子结合蛋白家族[6],在睾丸、胃肠道等正常组织中均有表达,相关研究表明MAC30在结肠癌、乳腺癌等肿瘤中表达增多且常与肿瘤预后不良相关,且MAC30能够导致化疗耐药的发生[7],但相关机制尚不明确。本研究采用免疫组织化学法检测MAC30在NSCLC及癌旁组织中的表达,采用RT-PCR技术检测MAC30 mRNA表达水平,探讨MAC30与NSCLC化疗效果及预后的关系。
1 材料与方法
1.1 一般资料
选取2014年8月至2017年8月于本院就诊的64例NSCLC患者作为研究对象,诊断依据《CSCO原发性肺癌诊疗指南(2016)》[8],依据国际抗癌联合会(UICC)第七版肺癌TNM分期标准对肿瘤进行分期[9]。纳入标准:①患者经细胞学检查、病理诊断确诊为NSCLC;②患者身体状况良好,无化疗禁忌证;③患者均为初诊,未经过放化疗、靶向治疗及生物免疫治疗。排除标准:①合并其他恶性肿瘤患者;②不能耐受化疗患者;③临床资料不全患者。研究对象中男性41例,女性23例,年龄42~74岁,平均年龄(61±9.17)岁。研究对象及家属均签署研究知情同意书,本研究经医院医学伦理委员会审核通过。
1.2 化疗方案及效果评估
患者行肺癌根治术后使用TC方案即紫杉醇(PTX)+卡铂(CBP)方案进行化疗[8],紫杉醇注射液静滴,175 mg/m2;卡铂注射液静滴,AUC=5(mg/ml.min),化疗周期为21 d,患者最多治疗6个周期,平均4个周期。周期开始时若患者不良反应尚未恢复可适当推迟,最长不超过14 d。若患者发生严重不良反应时应下调用药剂量或暂停用药,PTX下调为135 mg/m2、CBP下调为AUC=4(mg/ml.min)。治疗结束后依据实体肿瘤治疗反应评价指南[10]将患者分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。
1.3 免疫组织化学法检测组织中MAC30表达情况
使用SP免疫组化试剂盒(北京中杉金桥生物技术公司)检测患者肿瘤组织及癌旁组织中MAC30表达情况,MAC30定位于细胞质中,染色后呈棕黄色颗粒。染色结果判断标准:按阳性细胞占比计分,≤5%记0分、>5%~25%记1分、>25%~50%记2分、>50%~75%记3分、>75%记4分。按着色程度计分,无染色记0分、浅黄色记1分、棕黄色记2分、深棕色记3分。以二者得分相乘为最终结果,>6分为高表达,≤6分为低表达。
1.4 RT-PCR技术检测MAC30 mRNA表达水平
使用Trizol法提取患者组织中总RNA,酶标仪检测RNA质量。使用Takara逆转录试剂盒(大连宝生物公司)合成cDNA模板,使用美国solarbio公司通用RT-PCR试剂盒(M-MLV)检测MAC30 mRNA表达水平。反应条件为94℃预变性5 min,94℃ 30 s、55℃ 30 s、72℃ 60 s,共35个循环,引物委托上海生工生物公司合成。
1.5 统计分析
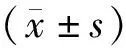
2 结果
2.1 MAC30在NSCLC组织及癌旁组织中的表达情况
免疫组化结果显示MAC30在NSCLC组织中高表达率为81.25%(52/64),而癌旁组织中高表达率为23.44%(15/64),MAC30在NSCLC组织中高表达率明显高于癌旁组织,差异具有统计学意义(χ2=42.881,P<0.001)。
2.2 MAC30 mRNA在NSCLC组织及癌旁组织中的表达水平
RT-PCR结果显示NSCLC组织中MAC30 mRNA相对表达量为(0.74±0.22),而癌旁组织中MAC30 mRNA相对表达量为(0.51±0.13),NSCLC组织中MAC30 mRNA水平明显高于癌旁组织,差异具有统计学意义(t=7.201,P<0.001)。
2.3 MAC30水平与患者临床资料的关系
单因素分析结果显示,MAC30表达水平与患者年龄、性别及肿瘤病理类型无关(P>0.05),而与患者TNM分期、有无淋巴结转移和肿瘤分化程度相关(P<0.001),见表1。

表1 MAC30水平与患者临床资料的关系/例
2.4 MAC30 mRNA水平与化疗效果的关系
64例NSCLC患者根据化疗效果分为CR组11例、PR组19例、SD组20例、PD组14例。取得不同化疗效果的患者组织MAC30 mRNA水平分别为CR组0.53±0.12、PR组0.59±0.17、SD组0.68±0.19、PD组0.87±0.21,差异具有统计学意义(F=9.350,P<0.001),CR组及PR组患者MAC30 mRNA水平明显低于PD组患者,差异具有统计学意义(P<0.05)。
2.5 MAC30水平与患者预后的关系
采用门诊、微信、邮件等方式对患者进行随访,间隔3个月,以患者死亡或截止到2020年8月计算生存率。64例NSCLC患者死亡25例、存活37例、失访2例,存活率57.81%,死亡患者均死于肿瘤复发或相关并发症。采用Kaplan-Meier生存曲线分析MAC30水平与患者预后的关系,结果表明组织中MAC30高表达的NSCLC患者生存率明显低于低表达患者,差异具有统计学意义(P<0.05),见图1。
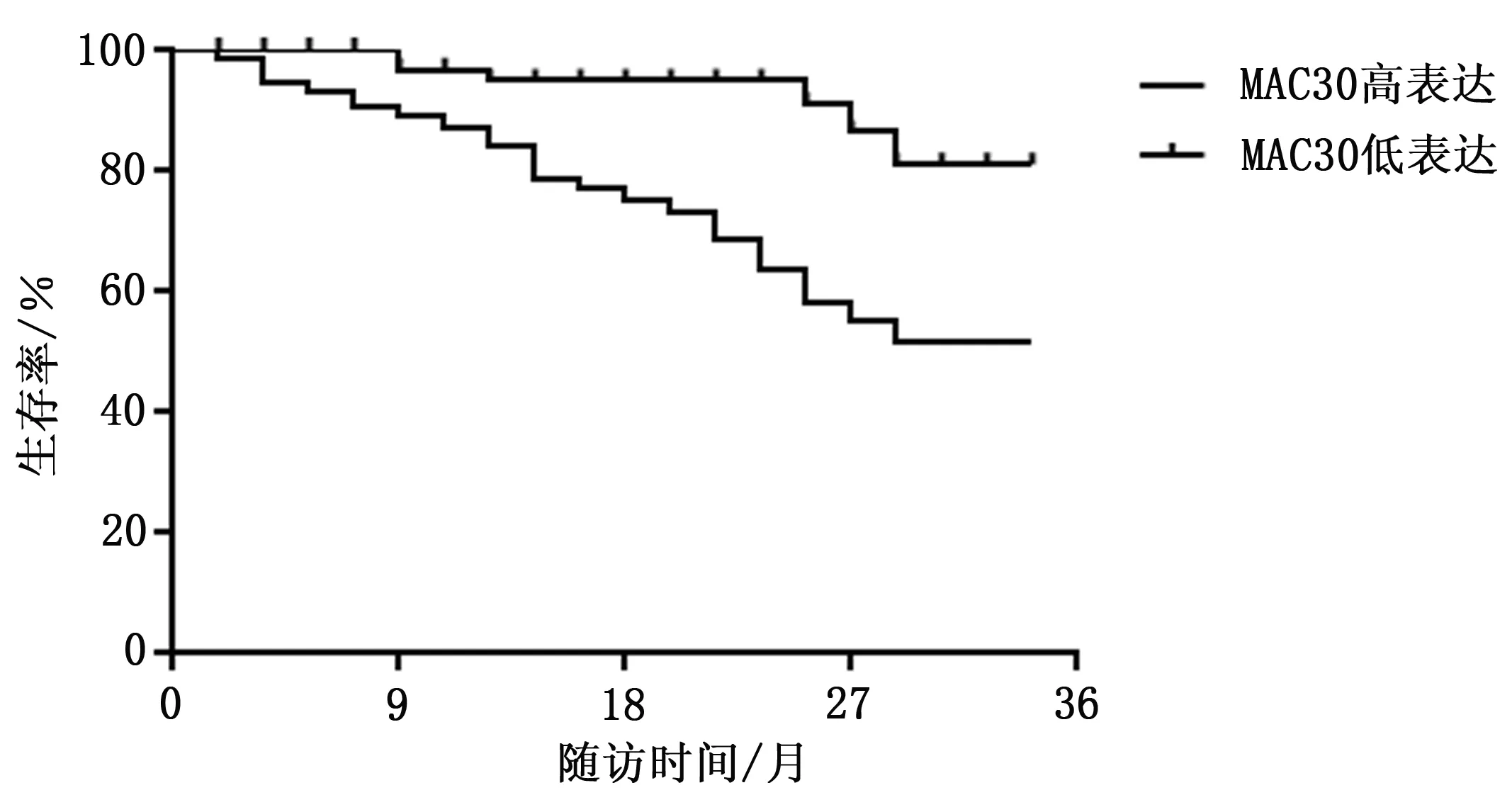
图1 MAC30水平与患者生存率的关系
3 讨论
MAC30最初被发现在脑膜瘤中过度表达,后续研究发现食管癌、乳腺癌、大肠癌等恶性肿瘤中也存在MAC30表达上调的情况[11],提示其促进了肿瘤的生长和转移。MAC30是胰岛素样生长因子结合蛋白家族成员,通过调控胰岛素样生长因子(IGF)发挥生理学作用[12]。MAC30基因位于常染色体17q11.2,其编码的cDNA包含5个拓扑结构域和4个跨膜结构域[13],主要分布于细胞核及内质网之中。本研究发现在NSCLC患者组织中MAC30表达较癌旁组织相比明显上调,且MAC30的高表达与患者TNM分期、有无淋巴结转移和肿瘤分化程度相关,提示MAC30在NSCLC中发挥促瘤作用,其高表达可能与肿瘤疾病的进展和转移相关。
研究表明MAC30能够通过靶向PI3K/AKT通路调控肿瘤疾病的发生发展[14]。现有研究已证实PI3K/AKT通路在肿瘤中异常激活,通过上调VEGF、IL-8等细胞因子水平诱导肿瘤进一步恶化,发挥其促瘤作用[15],而PI3K/AKT通路还能够调控PD-1/PD-L1等免疫检查点蛋白的表达水平,通过上调PD-1/PD-L1的表达诱导肿瘤免疫逃逸和肿瘤耐药的发生[16]。本研究发现不同化疗效果组中患者组织MAC30 mRNA水平存在明显差异且CR组及PR组患者MAC30 mRNA水平明显低于PD组患者,说明MAC30高表达能够对患者化疗效果产生消极影响。研究发现敲低MAC30后p-AKT表达水平明显下降,且PI3K/AKT通路下游蛋白Bcl-2、Bax、Cyclin D1等表达水平下降[17],可能通过自噬途径调控细胞周期、细胞增殖和凋亡。而MAC30高表达通过上调AKT磷酸化水平导致PI3K/AKT通路过度激活,促进肿瘤的进展和转移[18],MAC30高表达患者化疗效果较差可能与PD-1/PD-L1高表达导致的化疗耐药或细胞自噬水平改变相关,结果与文献报道结果一致[15-16],但相关机制尚不完全明确,需要进一步研究。
本研究还发现MAC30高表达的NSCLC患者3年生存率低于低表达患者。相关研究表明MAC30高表达与多种肿瘤的预后相关,国内学者Shan等[19]的研究表明胸腔积液中MAC30水平能够作为肺癌预后的相关指标发挥临床作用,其高表达常预示患者预后不良的发生;而动物实验表明下调MAC30水平能够延长荷瘤小鼠的生存时间、延缓肿瘤生长速度和浸润深度[20]。结合本研究结果,提示MAC30能够作为NSCLC患者预后的相关评价指标。
综上所述,MAC30表达水平不仅与NSCLC的发病、转移和肿瘤分期相关,还与患者化疗效果及预后相关。MAC30高表达患者肿瘤恶性程度较高,化疗效果及预后较差,可能作为患者预后的相关指标发挥作用。但本研究样本量较少,且只对蛋白表达水平进行研究,因此结果可能存在一定的局限性,需要在后续的研究中加以改进和完善。
