基于深度学习的骨质疏松影像学辅助诊断研究进展*
2022-04-23何猛唐雄风郭德明沈先月陈博秦彦国
何猛 唐雄风 郭德明 沈先月 陈博 秦彦国
随着老龄化进程加快,骨质疏松症(osteoporosis,OP)成为影响我国中老年骨骼健康的无形杀手[1]。骨折是骨质疏松症的最严重后果,造成相当大的健康、社会和经济负担。双能X线吸收测定法(dual energy X-ray absorptiometry,DXA)等影像学检查方法广泛用于骨质疏松症的诊断,但存在无法确切定量评估骨质量、易受骨赘及钙化影响、诊断标准单一等问题。目前,深度学习技术飞速发展,被广泛应用于医学领域。本文总结了骨质疏松症常用影像学诊断技术的优缺点及深度学习技术辅助骨质疏松症诊断的具体研究进展。
1 骨质疏松症
1.1 流行病学
骨质疏松症是一种以骨量减少和骨结构破坏为特征的疾病,导致骨骼强度下降和骨折风险增加[2]。骨质疏松症在老年人中普遍存在,因通常在发生脆性骨折前无症状或体征,也被认为是一种“沉默的疾病”。目前,中国估计共有1 090万男性和4 930万女性患有骨质疏松症。骨骼矿物质密度(bone mineral density,BMD)值因人口特征而异,我国50岁及以上男性和女性的骨质疏松症年龄标准化患病率达到6.46%和29.13%[3]。脊柱、髋部或前臂骨折是骨质疏松症的常见并发症[4]。骨质疏松症的发病机制主要是成骨和破骨的动态失衡,导致破骨多于成骨,造成骨代谢紊乱。
1.2 常见影像学诊断
1.2.1 双能X线吸收测定法
双能X线吸收测定法(DXA)基础研究最早于1963年由Cameron和Sorenson[5]描述,至今仍被广泛用于骨密度的评估。双能X射线吸收测定法测定的髋部及第1至4腰椎(L1-4)的骨密度是临床诊断骨质疏松症的“金标准”[6]。骨密度通常用T值(T-Score)表示,T值=(实测值-同种族同性别正常青年人峰值骨密度)/同种族同性别正常青年人峰值骨密度的标准差。对于绝经后女性、50岁及以上男性,建议参照世界卫生组织(WHO)推荐的诊断标准:T值≥-1.0为正常;-2.5<T值<-1.0为骨量降低;T值≤-2.5为骨质疏松;符合骨质疏松诊断标准,同时伴有一处或多处脆性骨折诊断为严重骨质疏松[7]。但腰椎和髋部骨质变化易受多种因素的影响,这时需加做前臂骨密度检测。
1.2.2 定量计算机断层扫描
定量计算机断层扫描(quantitativecomputed tomography,QCT)于1977年由Genant和Boyd[8]首次引入,是基于临床CT扫描数据,经过体模校正和专业软件调整,对人体骨骼进行定量评估的技术。与DXA不同,QCT测量的是真正的体积骨矿物质密度(Volumetric BMD,vBMD),单位是mg/cm3,可以区分骨小梁和骨皮质,不受身高、体重的影响[9]。国际临床骨密度测量学会推荐测量L1和L2的平均BMD。美国放射学会提出腰椎QCT诊断骨质疏松症的标准为正常(体积骨密度>120 mg/cm3)、骨量减少(80 mg/cm3≤体积骨密度≤120 mg/cm3)和骨质疏松(体积骨密度<80 mg/cm3)[10]。这些阈值是腰椎QCT诊断骨量减少或骨质疏松的金标准。但是QCT检查放射剂量较大,费用较高,因此并未广泛应用。
1.2.3 磁共振成像
磁共振成像(magnetic resonance imaging,MRI)没有辐射,常用于对肌肉、软骨和骨髓等软组织进行成像。关于定量MRI,早在20世纪90年代的研究就引入了T2图像和高分辨率骨小梁成像,可以评估与骨质疏松症相关的骨微结构[11]。MRI通过骨小梁结构周围的脂肪基质层发出的信号变化能够对骨小梁网络进行成像,采集实现最大化骨髓信号并增强松质骨的对比度[12]。但MRI不能显示骨矿物质密度的信息[13],而且检查费用较高,存在技术要求。
1.2.4 定量超声技术
定量超声技术(quantitative ultrasound,QUS)通过被测量区域(多为前臂等区域)的骨骼对超声波的衰减及反射来呈现骨质密度的变化,还可以反映骨骼力学方面的情况,多作为骨折风险的评估[14]。
1.2.5 放射性核素骨显像
核素骨显像对原发性骨质疏松症的诊断并无明显临床意义,椎体压缩性骨折时表现为较强的线状特征性显像剂分布浓聚带[3],骨闪烁显像对骨质疏松症患者椎体压缩性骨折的检测具有非常高的敏感性[15]。
2 人工智能技术
2.1 人工智能技术在骨科领域的应用
随着大数据时代的来临和计算机能力的提高,人工智能已经给医疗行业带来了革命性的变化。人工智能(artificial intelligence,AI)正迅速成为诊断疾病、辅助临床决策的辅助工具。广泛的研究表明,基于人工智能的系统在许多骨科疾病的诊断中表现良好,如显著提高隐匿性骨折的诊断准确率[16]、骨关节炎诊断准确度达专家水平[17]等。
2.2 人工智能技术在骨质疏松/骨折预测领域的应用
20世纪90年代,人工智能技术首次应用于骨质疏松性骨折识别研究[18],有助于改善骨折预防策略,该项研究也证明了人工神经网络(artificial neural network,ANN)在低BMD的预测中并不比常规统计方法更有优势。
2006年,Chiu团队[19]提出了一种神经网络来识别老年人的骨质疏松症(男性157名,女性1 246名)。研究人群随机分为三组,训练组703名,验证组350名,测试组350名。输入变量包括人口统计特征、人体测量和临床数据。输出变量为非骨质疏松组(T值大于-2.5分)或骨质疏松组(T值为-2.5分或更低),按双能X射线吸收测定法测量分类。
在2007、2008和2009年,神经网络和支持向量机(support vector machine,SVM)技术结合骨密度指标及多种参数用于提升X线或超声图像对骨质疏松的评估效果[20],使用SVM技术将各种纹理参数与骨密度参数相结合,并指出最有希望的参数组合,以区分骨质疏松性骨折组和非骨折组。2008年,人工神经网络应用于骨骼X线图像进行图像像素点识别和定量分析,并能结合提取图像特征[21]。
2.3 深度学习技术辅助骨质疏松影像学诊断
深度学习(deep learning)是机器学习中一种基于对数据进行表征学习的方法。在这种方法中,复杂的多层神经网络结构通过将输入信息转换为多个抽象层次来自动学习数据的表示。其动机在于建立、模拟人脑进行分析学习的神经网络,模仿人脑的机制来解释数据,如图像、声音和文本。对于图像中的模式识别任务,深度卷积神经网络(deep convolutional neural network,DCNN)是最常用的深度学习网络。在一个足够大的训练集上,DCNN可以学习通过反向传播迭代调整其权重,从给定任务的训练样本中自动提取相关特征。由于学习过程是自动化的,深度学习可以轻松地分析数千或数百万个案例。因此,只要训练集足够大且多样化,能够进行分析,深度学习就可以更稳健地应对不同类别之间的特征差异[22]。
在骨质疏松诊断和骨折预测领域,医学影像占据主导地位。近年来,一些研究已经使用深度学习算法根据医学图像来诊断骨质疏松。因此笔者总结现有深度学习结合骨质疏松影像学辅助诊断的研究进展并进行展望,具体研究如表1所示。
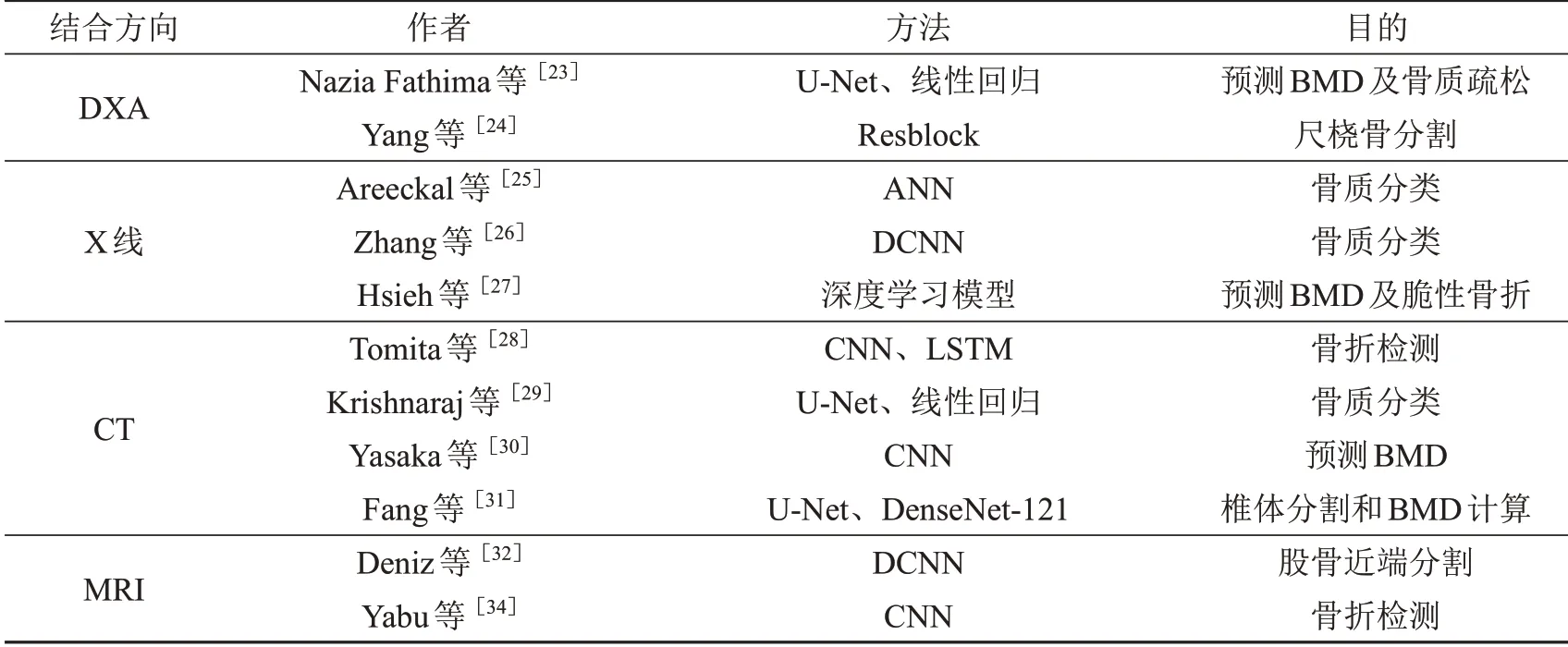
表1 深度学习技术和骨质疏松影像学检查结合研究
2.3.1 深度学习技术结合双能X线吸收测定法
自从1987年双光子吸收测定法转变为双能X射线吸收测定法(DXA)以来,DXA就一直作为骨质疏松诊断的“金标准”而存在。但是DXA是二维重叠图像,易受患者体位等因素影响,不能区分骨小梁和骨皮质,不能处理脊柱重叠组织引起的伪影,从而影响BMD测量结果的准确性。同时,高质量的DXA测量需要对操作技术人员进行细致的培训,成本较高。Nazia Fathima等[23]于2020年使用一种改进的带注意力单元的U-Net模型,从X线图像和DXA图像中准确地分割出骨骼区域。建立线性回归模型,计算BMD和T值。模型在X线图像和DXA图像两个数据集上都实现了88%的准确率。2021年,Yang等[24]提出一种基于Resblock的深度学习方法,用于在双能X射线成像中精确自动分割尺骨和桡骨,有利于应用于骨密度的测量和骨质疏松的诊断。通过结合深度学习技术,可以针对DXA图像进行骨质情况识别判断,提升了双能X线吸收测定法检测骨质疏松的能力。
2.3.2 深度学习技术结合X线平片
骨骼X线平片图像是骨质疏松诊断最常见的检查手段。骨质疏松在X线平片上显示为骨小梁稀疏、骨密度降低[3]。但X线没有提供任何图像的临床解释及与骨折风险状况相关的任何参数,无法灵敏显示早期的骨量变化。2018年,Areeckal等[25]训练人工神经网络(ANN)分类器模型,利用手和腕部X线光片的皮质放射测量和松质层纹理分析数据来早期诊断骨量减少和骨量正常,训练数据中准确率为94.3%,测试数据中准确率为88.5%。2020年,Zhang等[26]则基于腰椎X射线图像,通过DCNN模型实现了对骨量减少和骨质疏松症的分类。隔年台湾桃园长庚纪念医院的Hsieh等[27]提出了一种使用X线平片识别骨折、预测骨密度和评估骨折风险的自动化工具,对骨质疏松症的阳性或阴性预测值为95%,可能有助于识别骨质疏松症的高危患者。通过训练深度学习模型,实现在X线平片上即可辅助诊断骨质疏松症的目的,有效减轻医院的诊疗压力及患者的经济负担。
2.3.3 深度学习技术结合计算机断层扫描检查(CT)
随着深度学习技术的发展,2018年Tomita等[28]利用深度卷积神经网络从CT扫描的每个切片中提取放射特征,检测胸部、腹部和骨盆CT检查中的偶发骨质疏松性脊椎骨折,准确率达89.2%,与放射科医生在真实临床环境中的表现相符。2019年,Krishnaraj等[29]将CT图像和DXA检查相结合,描述一种使用机器学习算法从常规获取的CT检查中模拟腰椎DXA评分的方法,能够有效识别骨质疏松和骨量减少,准确率高达82%,填补了骨密度筛查领域的空白。2020年,Yasaka团队[30]利用深度学习模型从平扫的腹部CT图像中预测腰椎的骨密度(BMD),CNN模型估计的骨密度值与DXA获得的骨密度值显著相关,实现了骨密度值在CT图像上的量化。2021年,中山大学Fang等[31]则使用定量计算机断层扫描(QCT)测量的值为分析的标准,提出一种基于深度卷积神经网络的CT图像椎体分割和骨密度(BMD)计算的全自动方法,可能有助于临床医生在脊柱或腹部CT扫描中进行骨质疏松症筛查。从而实现了CT水平上医生级别的骨矿物质密度计算和骨质疏松筛查。2.3.4深度学习技术结合磁共振检查(MRI)
磁共振成像(MRI)提供了一种在不使患者暴露于电离辐射的情况下对肌肉、骨骼系统进行成像的方法。核磁共振成像常用于软组织成像,如肌肉、软骨和骨髓,并且对骨骼中的微观结构变化敏感,这反过来又可能有助于预测骨折风险。然而,由于骨组织的快速信号衰减和低质子密度,骨皮质和骨小梁的定量评估具有挑战性[32-33]。Deniz等[32]于2018年提出了一种基于深度卷积神经网络(deep convolutional neural networks,CNNs)的股骨近端自动分割方法。基于CNNs的股骨近端自动分割精度为0.95±0.02。CNNs提供的高分割精度有助于将骨质量的结构MRI测量应用于骨质疏松症的临床实践。2021年,Yabu等[34]构建了一种在磁共振图像上检测骨质疏松性椎体骨折的卷积神经网络(CNN),模型的准确率为88%,外科医生的准确率为87%和80%,模型诊断准确性可与两位脊柱外科医生相媲美。
3 小结与展望
笔者通过文献检索,梳理骨质疏松症常见影像学诊断方法,并对深度学习技术辅助骨质疏松症影像诊断进行总结。目前骨质疏松筛查可以通过DXA检查、QCT检查对就诊者骨质进行定量评估[7,10],也可以经由深度学习模型识别影像数据纹理、形态学结构等特征来提示骨质情况[25],并且通过结合定量手段,也可以实现基于深度学习技术的骨质疏松影像学辅助诊断定量精确评估[30]。通过深度学习技术的结合,可以基本实现临床医生的骨质疏松诊断水平[32,34],有助于解决骨质疏松影像检查的设备依赖性,从而实现广泛的早期筛查;综合医院日常诊疗工作繁重,基层医院医生诊疗水平有限,容易出现影像诊断的漏诊和误诊,造成医疗资源的浪费,对患者生命健康造成损伤,通过深度学习技术辅助诊断,可以大大减轻诊疗压力,提升诊疗精确度。虽然目前临床上对于深度学习技术在骨质疏松症的使用已经有了一定的研究。但是笔者发现,现有的研究存在一些局限性:①研究数据多为同设备采集,缺乏不同设备、地域、人群的数据对比,模型诊断精确度提升有瓶颈;②同时研究影像数据集量较小,缺乏大规模公共数据库,数据库的建立存在着一定的伦理和患者隐私上的困扰;③骨质疏松症的识别不能形成时间维度的判断,缺乏患者的预防、诊断、治疗、用药、康复运动、后期保养等全过程。因此,我们应当着力于提高数据质量,建立数据标准化体系,同时不断升级优化深度学习算法。此外,还可研究多模态数据与深度学习技术结合助力骨质疏松症的影像诊断和早期筛查。
骨质疏松症是一种无声的疾病,影响了全世界的人口,可导致患者出现严重伤害,剧烈疼痛,长期丧失活动能力甚至过早死亡[35]。人工智能的最新发展在辅助骨质疏松症影像诊断方面取得了成功应用。现阶段的研究多集中骨质疏松进展的某一阶段,未来利用深度学习技术搭建模型来开展骨质疏松患者疾病相关因素研究,结合影像数据进行疾病风险分析及早期筛查,实现对高危人群精准有效的早期干预措施和健康管理;在诊疗阶段,定量评估,提高骨质疏松的影像诊断效率,减轻医疗压力,通过对患者骨质的准确评估,明确药物疗效;在康养阶段,对患者骨质健康进行长期管理,最终打造针对骨质疏松患者的全流程防护机制,同时结合我国5G通信和大数据技术,有助于解决区域医疗发展及医疗资源配置不均衡的情况,减轻患者和社会经济负担,提高区域整体医疗水平。
