基于经验模态分解的超声零差K成像评估肝纤维化研究
2022-04-23张奇宇吴水才崔博翔周著黄
张奇宇 吴水才 崔博翔 周著黄
0 引言
肝脏是维持人类生命活动的一个必不可少的器官,也是人体内最大的解毒器官。然而肝脏疾病一直是困扰全人类的问题,慢性肝病和原发性肝癌是一个世界性的公共问题,已经成为全球第7大死亡原因[1]。肝纤维化是各种慢性肝病发展的共同途径,也是进一步向不可逆转肝硬化及肝癌发展的必经之路[2]。因此,早期检测肝纤维化也就显得尤为重要。
虽然肝活检是评价肝纤维化的金标准,但由于其侵袭性、不适、取样误差和可能的并发症,不适合常规检查[3-4]。在现有医学影像模态中,超声成像拥有价格便宜,对人体无危害,容易得到普及等特点,使其在临床诊断中受到青睐。然而,临床上常用的B模式超声成像,是一种定性的超声成像模式,容易受到操作者的经验及系统设定的影响,无法提供标准的定量指标。超声背散射统计分析是一种新兴的定量超声检测技术[5-6]。声学上,肝实质可以建模为由小于临床超声波长的散射子组成的微结构[6],超声背散射信号的概率分布模式与组织的微结构(散射子)有关,由此从换能器所接收的背散射信号的统计特性,量化表达了肝实质的微观结构(散射子)变化[8-12]。研究表明,零差K(homodyned K,HK)分布是超声背散射统计的最具物理意义的超声背散射信号概率统计模型[5,13-14],其参数可以定量分辨单元内有效散射子个数,以及相干与弥漫散射信号之间的比值。目前有关超声背散射零差K模型参数成像(简称零差K成像)的研究,主要包括心肌[15]、淋巴结[16]、乳腺肿瘤[17]、颈动脉斑块[18]、脂肪肝[13,19-20]等组织定征。
课题组先前的研究工作中表明,超声背散射零差K模型α和k参数成像均可初步评价肝纤维化[21]。但在肝脏组织超声背散射信号中,不光包含肝纤维化信号,同时也混有肝实质等其他噪声信号[20,22-23]。假设把肝纤维化所贡献的背散射信号视为目标信号,并将其他背散射信号视为噪声信号,若能将肝纤维化信号与非目标组织信号分离,突出肝纤维化的背散射信号,势必会提高肝纤维化评估效果。有研究指出,经验模态分解(empirical mode decomposition,EMD)技术几乎可以用于任何类型信号的分解,尤其是在非线性、非平稳信号的分解降噪上具有明显的优势[24-26]。为此本文拟采用EMD技术,减少肝实质等非目标组织的背散射信号,避免其对肝纤维背散射信号的影响,以期提高超声零差K成像评估肝纤维化的性能。
1 方法
1.1 超声背散射零差K模型参数估算
超声背散射信号的零差K分布概率密度函数为[27-28]:
(1)
式中:A为背散射信号包络振幅;x为积分变量;J0(·)是第一类零阶Bessel函数;ε2和2σ2α分别为相干和弥漫散射信号的能量;α是散射子聚集(clustering)参数,其值与超声分辨单元内的有效散射子个数有关。参数k表征相干与弥漫散射信号的比值。参数α和k可准确描述生物组织的超声背散射特性。
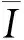
U=E[lgI]-lgE[I]
(2)
X=E[IlgI]/E[I]-E[lgI]
(3)
式中:E[.]表示数学期望。则模型参数的估算可转化为以下非线性方程组的求解:
(4)
1.2 基于EMD的零差K参数成像
EMD方法是Huang等[24]提出的,它是一种新的时频分析方法,而且是一种自适应的时频局部化分析方法。EMD完全抛开了基函数的束缚,仅仅依据数据自身的时间尺度特征来进行信号分解,具备自适应性。由于无需基函数,EMD几乎可以用于任何类型信号的分解,尤其是在非线性、非平稳信号的分解上具有明显的优势。该方法的关键是它能使复杂信号分解为有限个本征模态函数(intrinsic mode function,IMF),所分解出来的各IMF分量包含了原信号的不同时间尺度的局部特征信号。EMD分解方法基于以下假设条件:(1) 数据至少包含两个极值,一个最大值和一个最小值;(2) 数据的局部时域特性是由极值点间的时间尺度唯一确定;(3) 如果数据没有极值点但有拐点,则可以通过对数据微分一次或多次求得极值,然后再通过积分来获得分解结果。EMD的基本思想:将一个频率不规则的波化为多个单一频率的波+残波的形式,即原波形=∑IMFs + 残波。
将超声仪器采集到的原始射频信号进行EMD,由此来获取IMF1和IMF2,其主要目的是来应对非目标组织所产生的噪声背散射信号对生物组织微结构表征准确性的影响,提升参数估算的准确性。研究的设想是,IMF1或IMF2信号贡献了更多的肝纤维化有关信号。
在通过EMD后,进行超声背散射零差K参数成像,采用滑动窗口法[7]构建零差K模型α和k参数图像。图1为该算法流程图,具体步骤如下:(1) 用一个方形窗口在IMF1或IMF2信号上滑动,用于获取局部背散射数据,以估计α和k值,这些值被赋给窗口中心的新像素。(2) 控制窗口以一定的距离增量在整个包络数据范围内移动;距离增量由对应于窗口重叠率的像素数确定。重复步骤(1)和(2)以生成参数矩阵kIMF1、αIMF1、kIMF2和αIMF2,对其进行扫描变换和颜色映射,得到对应的参数图像,即为超声背散射零差K成像。
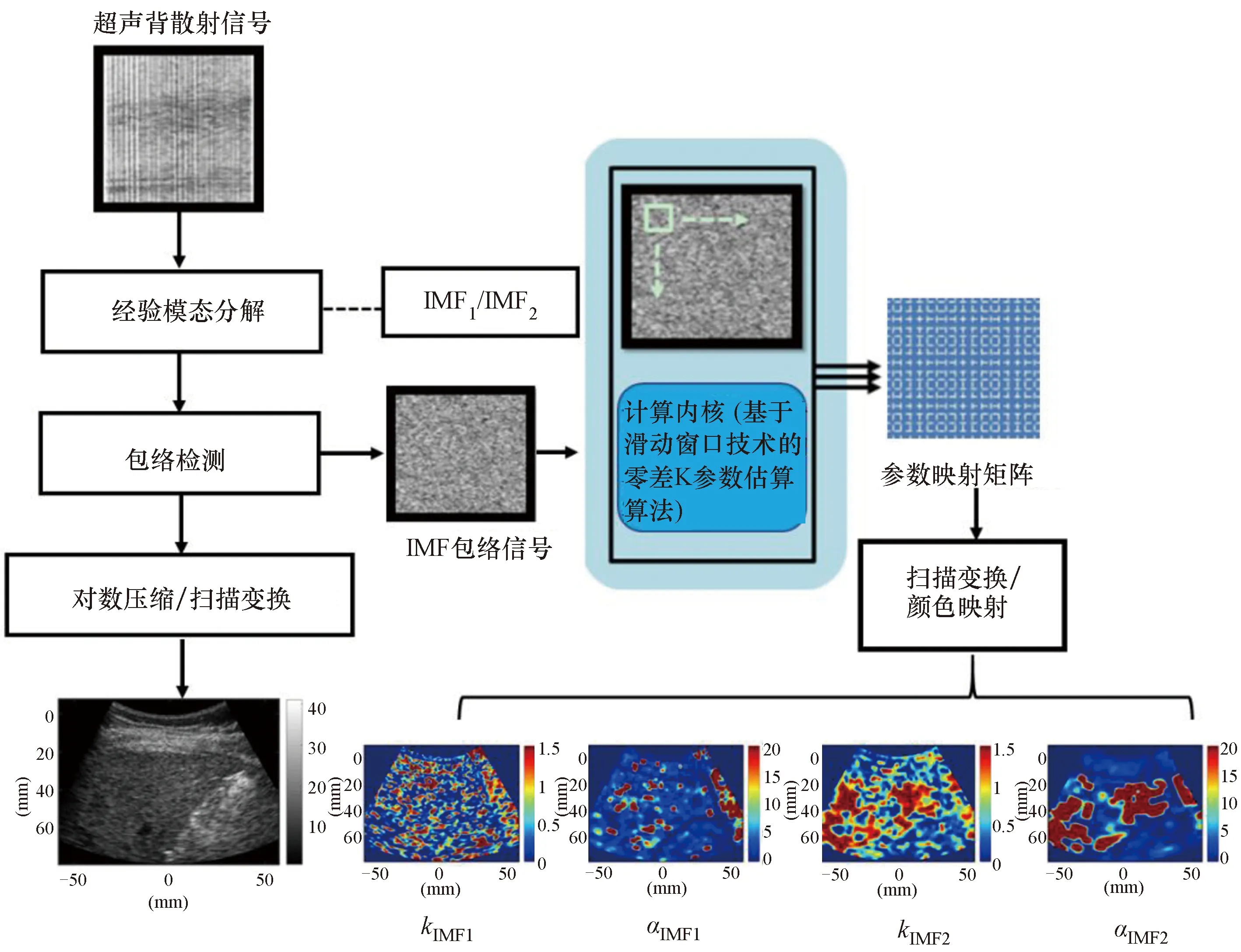
图1 基于EMD的超声背散射零差K参数成像流程Figure 1 Flowchart of ultrasonic backscattering homodyned K parametric imaging based on EMD
1.3 实验数据的采集及分析
共招募43名肝纤维化患者,参考标准为活检穿刺Metavir半定量计分(F0-F4),其中F0表示无纤维化,F1-F4对应纤维化程度从轻到重,F4表示肝硬化。利用临床超声仪(Model 3000,Terason,Burlington,MA,美国)采集患者的超声背散射信号。凸阵换能器中心频率3 MHz,采样频率12 MHz,换能器脉冲长度(pulse length,PL)约为2.3 mm。每一帧背散射信号由128条扫描线构成。利用EMD对信号进行分解,获得其IMF1和IMF2信号,采用希尔伯特(Hilbert)变换求取IMF1和IMF2的包络。滑动窗口的大小(window slide length,WSL)为PL的1~9倍。滑动窗口重叠率设为50%。由专业医师遵循以下原则选取肝实质感兴趣区域(region of interest,ROI):(1)在肝实质内使用一个相对较小的ROI,以排除大血管的影响;(2)将ROI设置在超声成像的焦点附近,以减少声衰减和声波衍射的影响。根据α和k图像,计算ROI内α和k的均值。利用受试者特征工作曲线(receiver operating characteristic,ROC)评价参数kIMF1、αIMF1、kIMF2和αIMF2鉴别不同程度肝纤维化的性能,并利用箱线图来评估参数kIMF1、αIMF1、kIMF2和αIMF2的值与肝纤维化程度的关系。
2 实验结果
穿刺活检结果表明,不同程度肝纤维化患者的数量为:F0=14,F1=10,F2=6,F3=2,F4=11。图2和图3分别显示了IMF2信号所产生的零差K模型参数k成像和参数α成像,由于F3例数较少,将F3和F4合并为一组,图中第1~4列分别代表了肝纤维化分级F0、F1、F2、F4,第1行表示B模式超声图像,第2行为ROI,第3~5行表示WSL=3~5倍PL的参数成像结果。由图可见,从F0到F2肝纤维化变化时,参数kIMF2和αIMF2成像亮度逐渐降低,对应参数kIMF2和αIMF2的值也降低,然而到了F4分级时,参数kIMF2和αIMF2成像亮度又逐渐升高一些,对应参数kIMF2和αIMF2的值也升高,和先前研究做比较,这一规律更加明显,表明参数kIMF2和αIMF2图像可以直观定征肝纤维化程度。
第1行表示B模式超声成像;第2行表示ROI;第3~5行分别对应WSL=3~5倍PL。图2 基于EMD的肝纤维化超声零差K模型k参数成像Figure 2 Ultrasonic homodyned K model k parametric imaging of liver fibrosis based on EMD

第1行表示B模式超声成像;第2行表示ROI;第3~5行分别对应WSL=3~5倍PL。图3 基于EMD的肝纤维化超声零差K模型α参数成像Figure 3 Ultrasonic homodyned K model α parametric imaging of liver fibrosis based on EMD
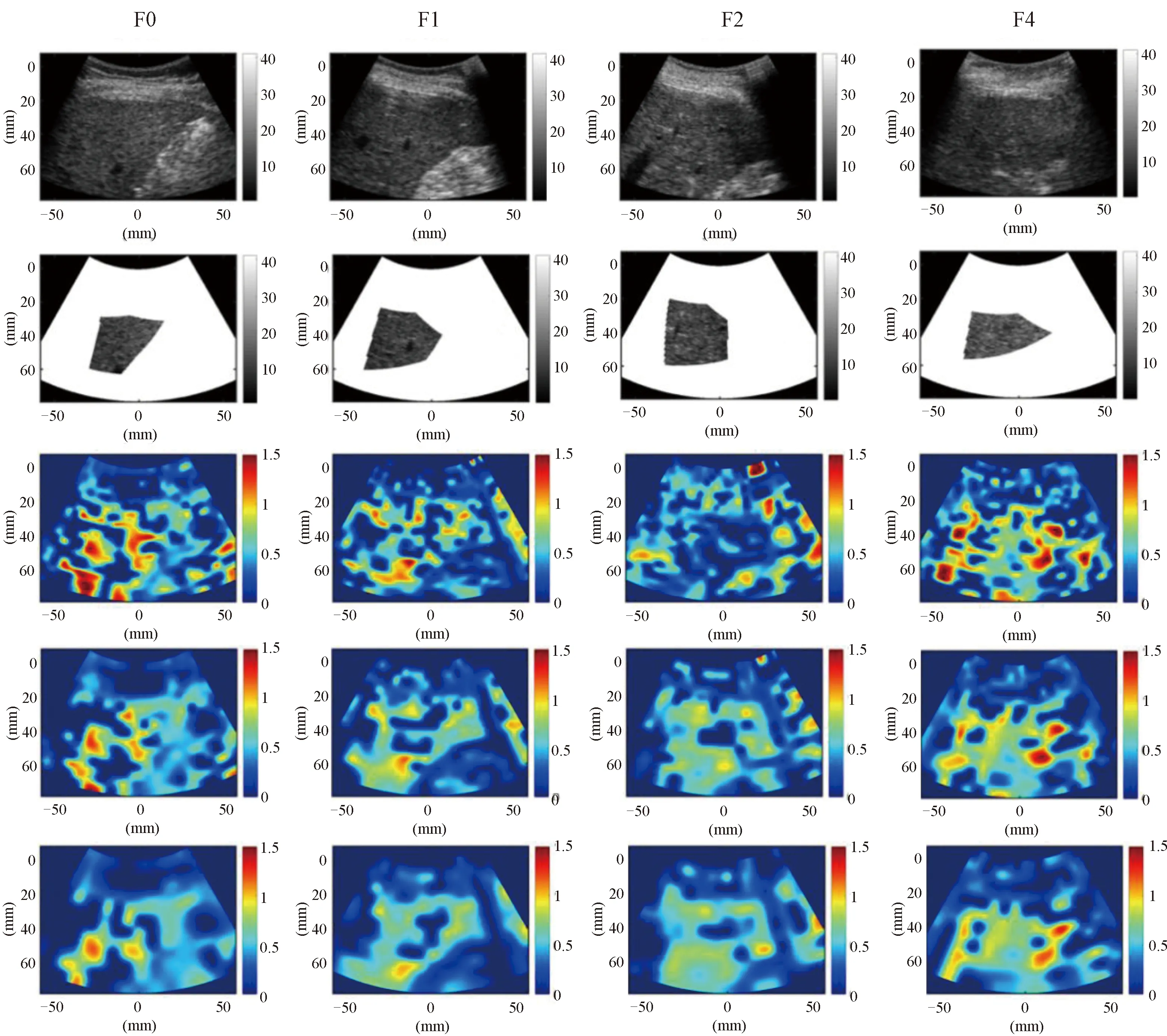
利用ROC曲线下面积(area under curve,AUC)定量评价α和k成像的诊断性能。研究表明[14,21],WSL=5倍PL时,超声零差K成像分级肝纤维化的效果会更好,因此利用AUC定量评价WSL=5倍PL时的参数α和k肝纤维化的分级诊断性能。图4为课题组先前研究中,使用传统零差K成像的α和k参数评估肝纤维化的ROC曲线以及AUC。图5表示使用EMD技术的零差K分布α和k参数成像评估肝纤维化的ROC曲线以及AUC,其中图5(a)~(d)分别表示kIMF1、αIMF1、kIMF2、αIMF2的ROC曲线。对比图4和图5,图4为先前研究结果,对于参数k而言,kIMF1和kIMF2的AUC,在诊断肝纤维化F0和F1-F4的二分类,即≥F1分类时提高较为明显,分别提高到了0.68、0.66,在诊断肝纤维化F0-F1和F2-F4的二分类,即≥F2时也有小幅度提高,但是并不显著。对于参数α而言,αIMF1的AUC在诊断≥F1分类时提升显著,达到了0.82,在诊断肝纤维化≥F2时也有小幅度提升,达到了0.68;但αIMF2几乎没有改进。由以上结果可以看出,EMD的确提高了参数k和α评估肝纤维化的准确性,在≥F1分级时效果更为显著。
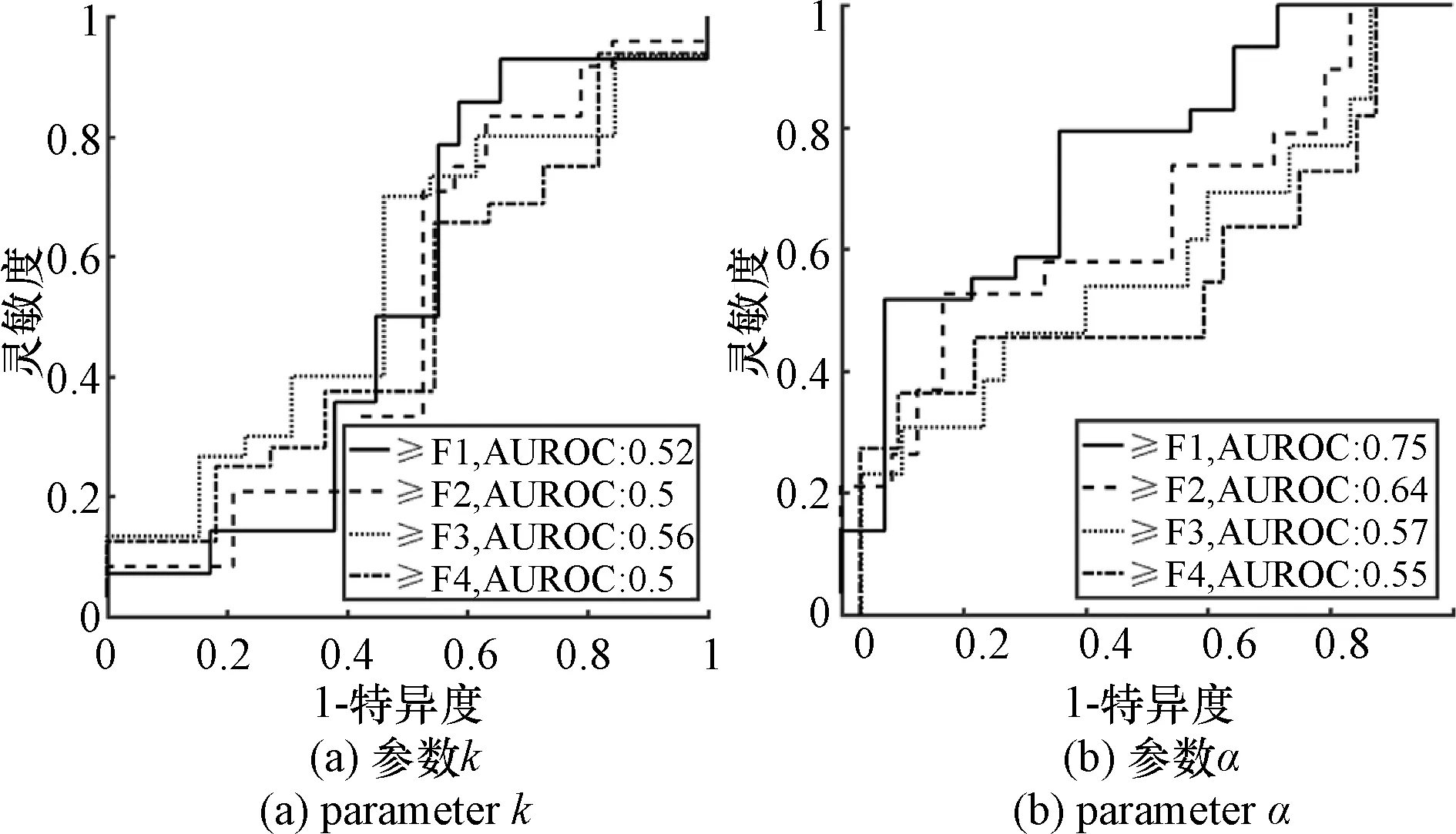
图4 传统超声零差K成像诊断肝纤维化的 ROC曲线Figure 4 ROC curves of liver fibrosis diagnosis withconventional ultrasound homodyned K imaging

图5 基于EMD的超声零差K成像诊断肝纤维化的ROC曲线Figure 5 ROC curves of liver fibrosis diagnosis withultrasound homodyned K imaging based on EMD
图6(a)~(d)分别表示kIMF1、αIMF1、kIMF2和αIMF2参数箱线图。可见,F0到F1区间,参数值是降低的,随着肝纤维化程度由F1到F2区间,参数值趋于稳定或有小幅度下降,但是到了F4时,参数值又逐渐提高,这一现象表明肝纤维化程度和所估算出的参数值是有直接关系的。

图6 基于EMD的超声零差K成像参数与肝纤维化程度的箱线图Figure 6 Box plots of ultrasound homodyned K imaging parameters versus liver fibrosis stages
3 讨论
本文利用基于EMD的超声背散射零差K成像评估肝纤维化,并对比了使用EMD前后的零差K参数成像评估肝纤维化的效果,进一步讨论所选取的两种IMF对评估肝纤维化的影响。研究结果证实了基于EMD技术的超声零差K参数成像提高了肝纤维化的诊断性能。
目前用于评估肝纤维化的主要超声技术分为超声弹性成像和定量超声两大类。超声弹性成像的原理是对组织施加一个内部或外部的激励,在弹性力学等物理规律下,组织将产生一定改变,从而间接或直接反映组织内部的应变、剪切波传播速度,或弹性模量等力学属性的差异。然而目前主流的弹性成像技术,不论瞬时弹性成像、声辐射力脉冲成像或剪切波弹性成像技术,若被检患者伴有肝炎症状,会测量出比实际更高的硬度值,从而影响肝纤维化分级的精度[29-32]。定量超声中的超声背散射统计分析可应对此问题。
肝纤维化的超声背向散射成像中,存在一个重要问题,那就是非目标信号对肝纤维化背散射信号统计分析的影响。肝实质或脂肪肝等背散射信号通常会作为噪声信号,干扰肝纤维化的超声检测。通过EMD技术,选取合适的IMF,结合零差K参数成像可改善这一问题。
本文通过43例肝纤维化患者的超声背散射信号,评估基于EMD的超声零差K成像评价肝纤维化的效果。从EMD角度出发,侧面验证了两个IMF的确有效提高了肝纤维化信号所占比重,减少了肝实质等非目标背散射信号对肝纤维信号的影响,但仍有很大的改进空间,在未来改进中,IMF1和IMF2哪一个会贡献肝纤维化信号更多,仍是进一步需要研究和讨论的问题。
本文方法对比现有超声背散射统计成像技术的优缺点如表1所示,其中有两种已商业化:声学结构定量(ASQ)和Nakagami成像[6]。然而有报告指出[33-34],当存在肝炎或脂肪变性时,ASQ与纤维化分期无明显统计学意义,此时ASQ可能无法定征肝纤维化。Nakagami模型的m参数在散射子密度较高时,存在饱和现象[35-37],且参数m并没有准确的物理意义,在肝硬化阶段检测效果较差。对于瑞利混合模型(multi-Rayleigh model)而言,其巧妙地假定肝纤维化组织主要由2个(正常组织、纤维组织)或3个(低回声组织如结节或血管、正常组织和纤维组织)组成,并分别进行建模分析,然而此方法存在无法精准确定滑动窗口中组织数量的这一弊端[38]。本文所提出的基于EMD的超声零差K成像技术,首先在EMD基础上初步消除了肝实质等非目标组织背散射信号对肝纤维信号的影响,结合零差K算法可以判别有无肝纤维化,并且零差K所估算的参数拥有具体的物理意义,在未来检测肝纤维化上有较大潜力,然而目前此方法在≥F2的分类时效果不佳,未来还需进一步加以改进。
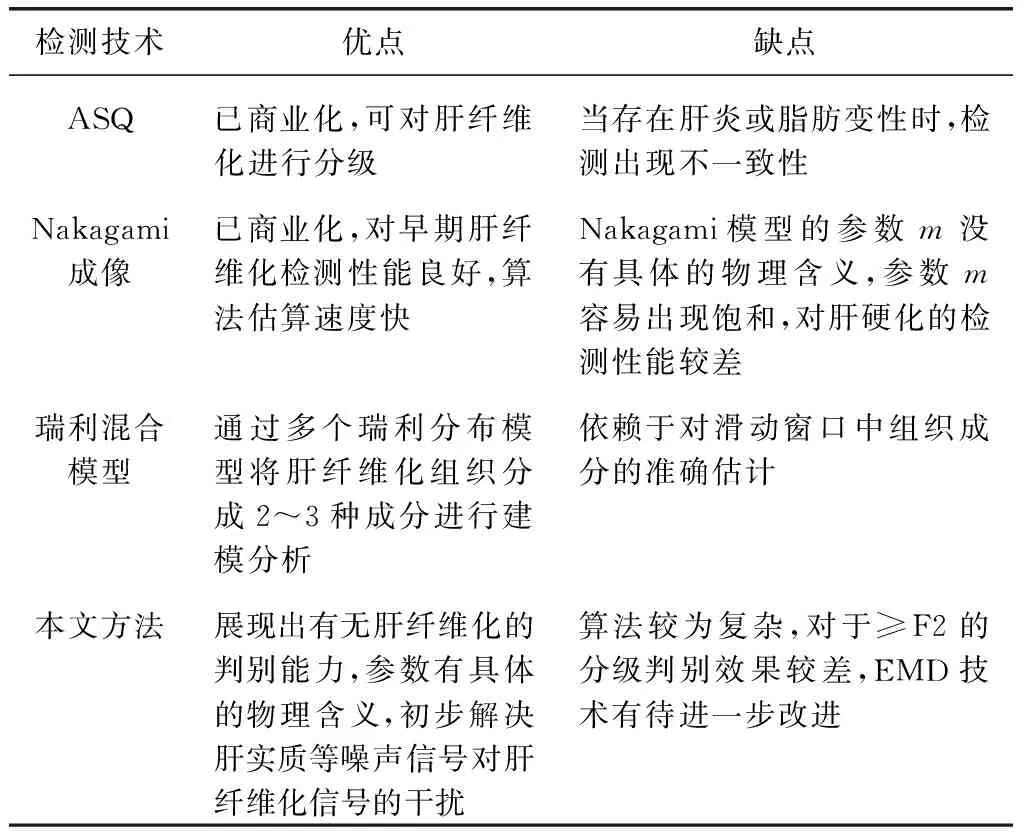
表1 超声背散射包络统计技术定征肝纤维化的优缺点Table 1 Advantages and disadvantages of ultrasound backscatter envelope statistics techniques incharacterizing liver fibrosis
本研究具有不足之处。首先,对于零差K分布模型,其参数估算的复杂程度更高,由于本算法的参数估算都在Matlab平台运行,所以比较耗时,未来可考虑将算法移植到C/C++平台来加速计算。其次,本研究对于IMF1和IMF2信号哪个贡献的肝纤维化信号更多,尚未给出明确结论,在今后的工作中将进一步探究IMF的选取对肝纤维化评估结果的影响,并且进一步改进现有EMD算法,提高分解信号中肝纤维化贡献比例。另外,本研究中肝纤维化F3分类实验数据较少,可能对实验结果的有效性有一定影响,未来还需加大实验数据并再次验证算法的有效性。
4 结论
基于EMD的超声背散射零差K模型α和k成像均可进一步直观反映肝纤维化分级。在肝纤维化评估方面,参数αIMF1、kIMF2和αIMF2的诊断性能比传统方法均有明显提升, EMD有效减少了肝实质等非目标背散射信号对肝纤维信号的影响,并且参数α的评估效果优于参数k。基于EMD的超声零差K成像为肝纤维化的无创评估提供了一种新思路和新方法。
