新型肝动脉栓塞微球制剂的制备
2022-04-22宋鹏锦韩啸孙彩凤孙海川曹晓亮胡连栋
宋鹏锦,韩啸,孙彩凤,孙海川,曹晓亮,胡连栋
(1.河北大学 河北省药物质量分析控制重点实验室,药学院,河北 保定 071002;2.保定市第一中心医院 医务处,河北 保定 071000;3.保定市第一医院 介入医学科,河北 保定 071000)
据2020年全球癌症统计数据显示[1],原发性肝癌是第三大癌症死亡原因,约有8.3×105例死亡.肝移植和手术切除是肝癌患者治疗的主要选择[2-3].大于3 cm肿瘤切除难度大,同时考虑到肿瘤的大小、数量和分布,手术切除并非适用所有患者[4].然而,接受了手术切除的患者中,术后5年复发率仍高达60%[5-6].
肝动脉灌注化疗栓塞(TACE)是一种临床上可接受的技术[7],其主要原理是依次将化疗药物和栓塞材料注入肿瘤供血动脉内,进行化疗栓塞.TACE优势如下:1)通过一次性大剂量灌注化疗药物,局部靶向肿瘤药物浓度得到提高,靶向化疗药物接触肿瘤组织的时间延长,患者的生存质量显著改善;2)选择性闭塞病变血管,造成肿瘤组织供血不足和缺氧,达到治疗目的[8].TACE已成为治疗中晚期肝癌的首选方法[9].
现阶段常见的栓塞材料有明胶海绵、碘化油乳剂、载药微球、聚乙烯醇(PVA)颗粒等[10].随着技术手段及栓塞材料的革新,相较于传统的灌注化疗和碘化油栓塞,载药栓塞微球技术治疗肝癌已成为近年来临床研究的热点.载药栓塞微球技术具有药物灌注化疗和栓塞的双重效果,能保证肿瘤区域足够药物浓度,降低全身血药浓度水平,将原本每月1次的治疗周期延长至3个月,比传统TACE安全性更高[11].新型载药微球产品能够大幅度降低治疗成本,拓宽治疗范围,受到专家的广为期待.
姜黄素是一种天然的酚类色素[12].已有临床数据和大量研究表明,姜黄素可通过多种机制影响癌细胞生长和凋亡,在多种恶性肿瘤治疗方面发挥作用[13-15],包括肺癌、胰腺癌、前列腺癌、乳腺癌、结直肠癌和卵巢癌等.
本文以PVA为载体,采用反相乳化交联法制备了姜黄素载药微球.确定最佳制备条件后,对微球的结构和理化性质进行了研究.建立了兔VX2肝癌模型[16],同时对比分析了姜黄素栓塞微球对肝脏肿瘤的治疗效果和安全性.
1 仪器与试剂
聚乙烯醇(PVA 1788)购自上海阿拉丁生化科技股份有限公司;失水山梨醇单油酸酯(span 80)购自国药集团化学试剂有限公司;聚氧乙烯失水山梨醇单油酸酯(Tween 80)购自天津市天大化工实验厂;姜黄素购自国药集团化学试剂有限公司;液体石蜡购自天津市大茂化学试剂厂;盐酸购自天津市科密欧化学试剂有限公司;T6紫外可见分光光度计购自北京普析通用仪器有限责任公司;BT-9300ST激光粒度分布仪购自丹东百特仪器有限公司;JSM-7500冷场发射扫描电子显微镜购自日本电子株式会社;FJ-200 高速剪切匀质机购自上海标本模型厂;UNIQFD20C DSA血管造影介入治疗系统购自荷兰飞利浦公司;FV3000激光共聚焦扫描显微镜购自奥林巴斯(中国)有限公司.
2 方法
2.1 PVA栓塞微球的制备
称取PVA溶解在去离子水中,制得PVA溶液,冷却至室温.将表面活性剂Span 80加入100 mL液体石蜡中搅拌,形成油相.取PVA溶液和盐酸溶液混合,加热并快速搅拌,形成水相.将水相加入油相中,搅拌(300 r/min)20 min,得到均匀的W/O型乳液.随后加入交联剂戊二醛,使其与PVA发生交联反应.持续搅拌1 h,过滤,清洗,干燥,得白色粉末状微球.
2.2 微球的形貌和粒度
使用碳导电双面胶带将微球固定在金属桩上,真空下喷金,10 kV激发电压下使用扫描电子显微镜观察微球表面形态的变化.
将适量栓塞微球放入投料池中,启动超声循环,直至遮光率达到 10%~15%时停止,接着超声循环约3 min,用激光粒度分布仪测量载药微球粒度分布范围,对实验数据进行整理记录和计算,用跨距(Span)评估栓塞微球粒径的均匀性.
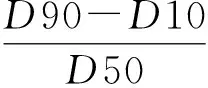
式中,D90、D50 和D10分别代表 90%、50%和 10%栓塞微球最大粒径小于该值所示粒径.
2.3 生物安全性测试
取最优化微球进行急性溶血、细胞凋亡和体外细胞毒性实验以证明微球的安全性.
2.3.1 急性溶血实验
取 10 mL玻璃试管 7 支,每支试管中加入 2.5 mL体积分数2%红细胞混悬液,进行编号:1号管加2.5 mL水作阳性对照组,2号管加2.5 mL生理盐水作阴性对照组,将0.5 mL质量浓度为12.5、25、50、100、150 mg/mL的微球分别加入到含2 mL生理盐水的3至7号管中.
2.3.2 细胞凋亡
采用激光共聚焦扫描显微镜观测MGC-803细胞在姜黄素药物诱导下的凋亡过程.通过荧光双染法,对处于各个凋亡时期的肿瘤细胞进行考察.荧光双染中用到的DAPI(4′,6-二脒基-2-苯基吲哚二盐酸盐)属于一种荧光染料,将癌细胞细胞核染成蓝色;Alexa Fluro®488是一种荧光探针,将细胞膜和细胞质染成绿色[17].
2.3.3 体外细胞毒性实验
选取小鼠 L929 纤维细胞,设置微球组、阴性对照组和阳性对照组.将小鼠 L929细胞稀释至 5×104/mL,在无菌孔板中以 90 μL/孔加入细胞悬液,培养 12 h.微球组分别加入 1、3、 6.25、12.5、25、50、100、150 mg/mL栓塞微球;阴性对照组加入 100 μL 细胞培养基;阳性对照组加入 100 mL体积分数5% DMSO 溶液,培养 48 h,置显微镜下观察不同组的细胞形态.每孔加入 10 μL 噻唑蓝(MTT) 溶液,继续培养 4 h,490 nm处测定吸光值,计算细胞相对增殖率(RGR),将 RGR值转化成 6 级,评定材料毒性,见表1.
以空白对照孔调零,按照公式计算各培养孔RGR.
式中,RGR为相对增殖率,%;X1为实验样品组的吸光度;X2为阴性对照组吸光度;X0为空白对照组吸光度.
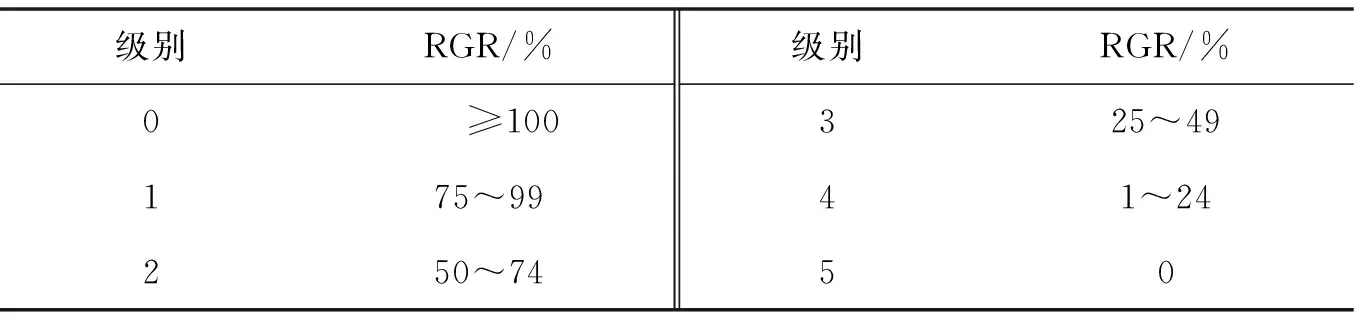
表1 细胞毒性反应分级
2.4 药效学研究
2.4.1 VX2肝癌动物模型的建立
家兔术前禁食12 h,禁水4 h,操作见图1.1)将VX2肿瘤细胞移植于兔后腿肌肉外侧,植入1个月后可见实质性肿块,即荷瘤兔;2)处死荷瘤兔,在无菌条件下分离出VX2肿瘤,制成2 mm×2 mm×3 mm的肿瘤组织,然后将碎片储存在生理盐水中;3)进行兔腹部正中切口手术,将VX2肿瘤接种于肝左叶候选肝区,用明胶覆盖穿刺部位,左肝叶置换入腹腔,缝合切口,表面涂抹红霉素软膏;4)所有兔在VX2肿瘤植入后肌注硫酸庆大霉素(8×104U/d,2 mL)3 d.肿瘤在兔子的肝脏中生长14 d.
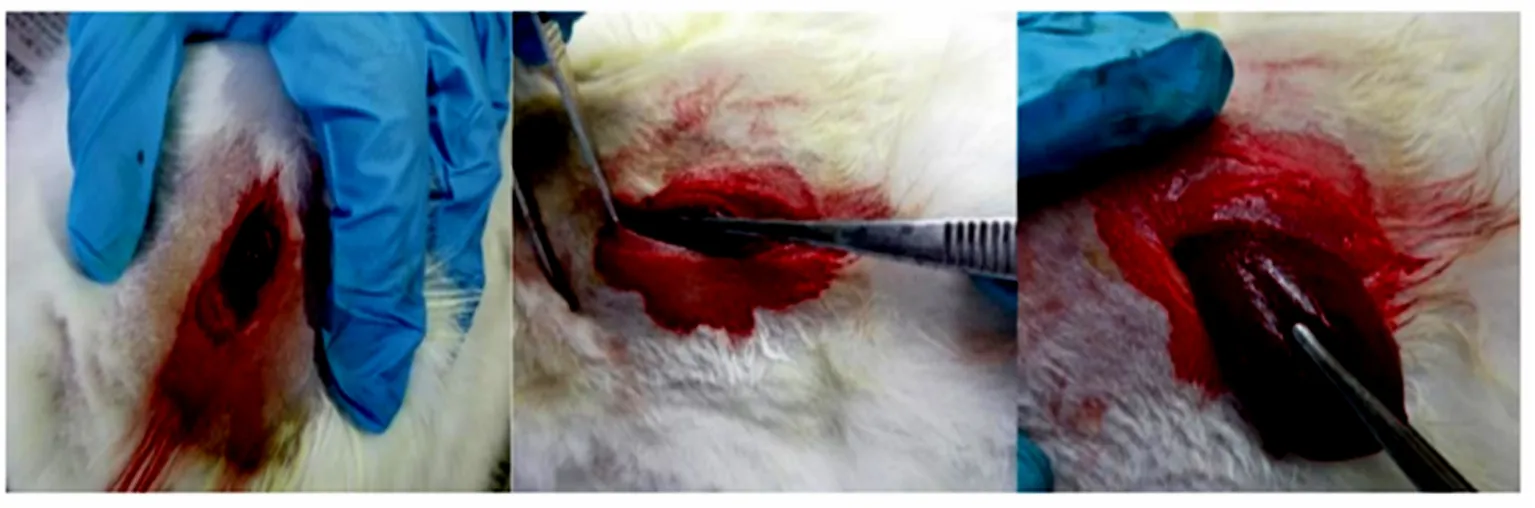
图1 包埋法建立肝癌模型Fig.1 Establishment of hepatocellular carcinoma model
2.4.2 TACE治疗
对植入VX2肝肿瘤的兔进行TACE治疗.将15只实验兔随机分为3组(姜黄素载药微球栓塞组、空白微球栓塞组和单纯造影组),每组5只.载药组和空白组做全麻处理,对每只家兔的下肢动脉进行解剖,在DSA血管造影介入治疗系统引导下,将导管导丝从股动脉移至肝肿瘤供血动脉,然后将栓塞微球分别注入家兔的供血动脉.缝合兔腿动脉,肌注硫酸庆大霉素(8×104U/d)3 d,常规标准饲料喂养.单纯造影组在完成造影后直接撤出导管,缝合后采用与栓塞组相同的术后管理方式.
2.4.3 CT灌注扫描
所有接受TACE治疗的实验兔分别于术后14、21 d进行CT扫描,与术前1周的CT影像数据对比,确认成瘤情况,操作见图2.依据CT影像测量肿瘤长宽高,计算体积:V=1/2×ab2,其中,a为肿瘤最长直径,b为肿瘤最短直径.
图2 实验兔 CT 检查Fig.2 CT examination of experimental rabbits
2.4.4 生存期观察
为了评估姜黄素载药微球对肿瘤组织影响,动脉栓塞给药后,观察各组动物生长情况,记录动物死亡数和平均生存时间,计算生命延长率(ILS).
对比各组实验动物平均生存时间并做出生存曲线,用生存曲线分析动物存活率.
2.4.5 组织学评估
将TACE术后的3组肝癌兔解剖,取出肝癌组织后进行H&E染色,置荧光显微镜下进行观察,评价栓塞术后肝组织是否发生病理学改变.实验过程中均按照动物伦理学标准对动物进行处置.
2.5 统计学方法
数据结果采用 SPSS 10.0 软件进行统计分析和处理,组间比较采用t检验,P<0.05为差异有显著性意义.
3 结果
3.1 微观形态
制备的微球外观圆整、光滑,实验结果见图3a.激光粒度分布仪测得PVA载药微球的平均粒径为94.19 μm,粒径分布在45~200 μm的微球为84.67%.D10为 39.22 μm、D50为 89.85 μm、D90为158.3 μm,计算得跨距为1.325,实验结果见图3b.
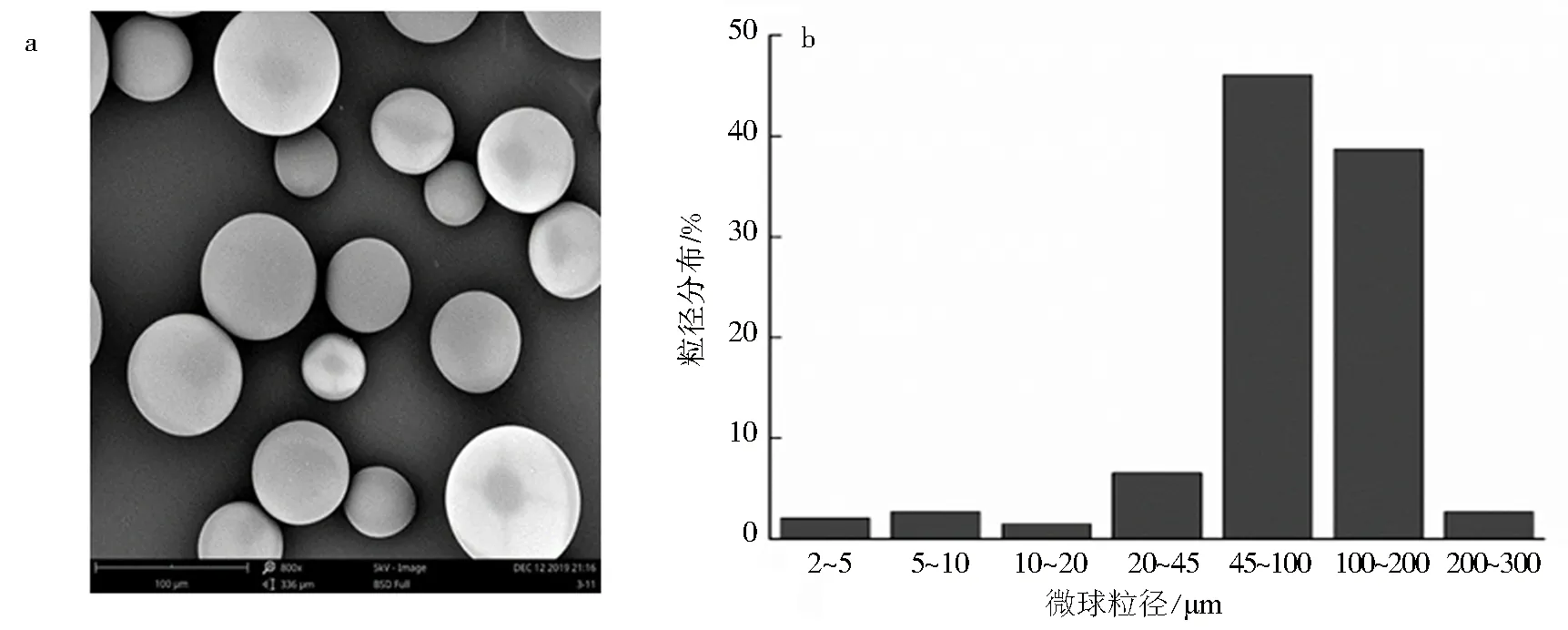
图3 PVA微球的扫描电镜照片(a)和粒径分布(b)Fig.3 Scanning electron microscope of PVA microspheres(a) and size distribution of PVA microspheres(b)
3.2 载药栓塞微球的安全性评价结果
3.2.1 急性溶血实验结果
实验结果见图4(从左至右分别为1~7号管).1号管(阳性对照组)中红细胞破裂(4 h),溶液呈现红色.2号管(阴性对照组)与含有微球样品的3~7号管中上清液均为无色透明,底部有红细胞沉降.
取微球样品(150 mg/mL)及阴性和阳性对照组样品分别置于显微镜下观察.实验结果见图5.微球组与阴性对照组中的红细胞形态完整,分散性良好,无聚集现象,而阳性对照组中的细胞破碎.实验表明微球安全性较好,不会引起溶血现象.

图4 溶血实验结果(室温放置4 h,从左至右1~7号管)Fig.4 Result of hemolysis test( for 4 h,tube 1—7 from left to right)
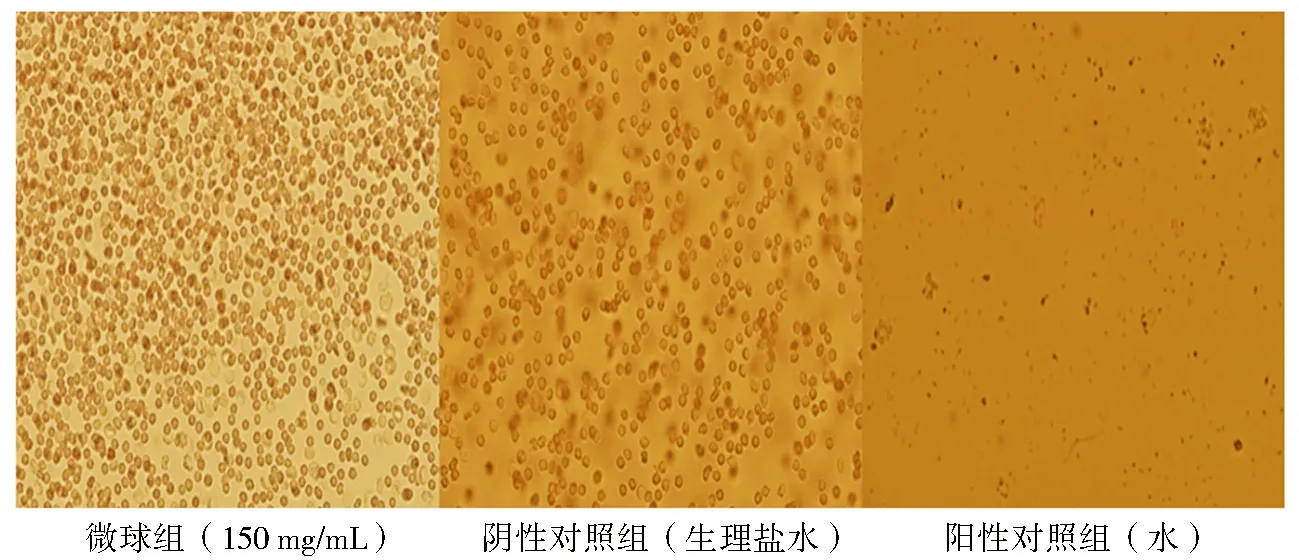
图5 溶血实验结果的光学显微镜照片Fig.5 Optical microscope images of hemolysis test
3.2.2 细胞凋亡结果
荧光双染后,激光共聚焦扫描显微镜下的观察结果见图6.DAPI细胞核染色显示,实验组活细胞数量减少,微球粒径大于细胞粒径,难以被细胞摄取,载药微球可释放姜黄素将细胞杀死;香豆素6细胞膜和细胞质染色显示,载药微球浓度增大,癌细胞数量减少,可通过调整给药浓度杀死癌细胞.

图6 激光共聚焦扫描显微镜观察Fig.6 Fluorescence images under laser scanning confocal microscope
3.2.3 细胞毒性结果
体外细胞毒性实验显示,1、3、6.25、12.5、25、50 mg/mL质量浓度组计算所得RGR均大于等于100%,空白微球和载药微球的细胞毒性反应分级均为 0 级,未对正常鼠 L929 纤维细胞造成明显的毒性反应.
3.3 栓塞微球在VX2荷瘤兔体内的栓塞效果
3.3.1 CT扫描结果
VX2荷瘤兔接受栓塞微球治疗后,肿瘤体积出现不同程度的增长.栓塞治疗21 d后,姜黄素微球栓塞组、空白微球栓塞组和造影剂组肿瘤体积分别为(4.32±1.46)、(5.96±1.07)和(9.30±1.38)cm3.姜黄素载药微球组、空白微球栓塞组肿瘤体积明显小于单纯造影组(P<0.05).
3.3.2 存活结果
VX2荷瘤兔动脉栓塞后的存活曲线,实验结果见图7.平均生存时间分别为单纯造影组 32.40 d、空白微球栓塞组37.60 d、姜黄素载药微球栓塞组 47.80 d.计算可得,姜黄素载药微球和空白微球治疗组的ILS分别为46.80%和36.60%.由此可以看出栓塞给药具有明显的治疗效果,且姜黄素载药微球栓塞组优于空白微球组.
3.3.3 H&E染色结果
肝脏组织病理学切片H&E染色结果见图8.单纯造影组肿瘤细胞形态多样,病变周围发现肿瘤巢,在肿瘤组织周围见到厚厚的纤维间隔,几乎没有血管.与空白微球组相比,姜黄素微球组可见血管内微球,周围肿瘤组织不同程度减少,并可见肿瘤边缘的凝血坏死区域.
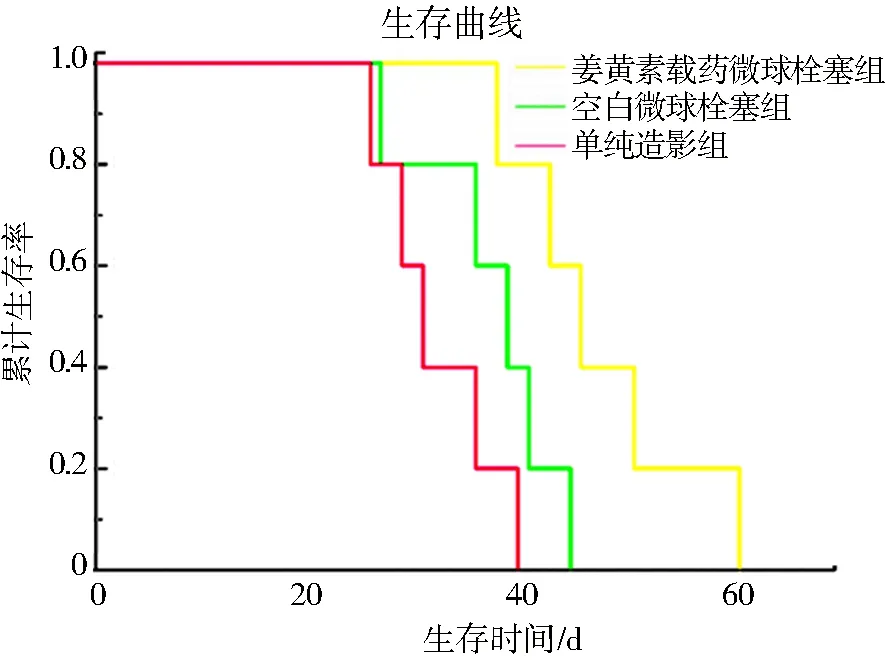
图7 各实验组荷瘤兔 K-M 生存曲线Fig.7 K-M survival curves of tumor-bearing rabbits in each experimental group
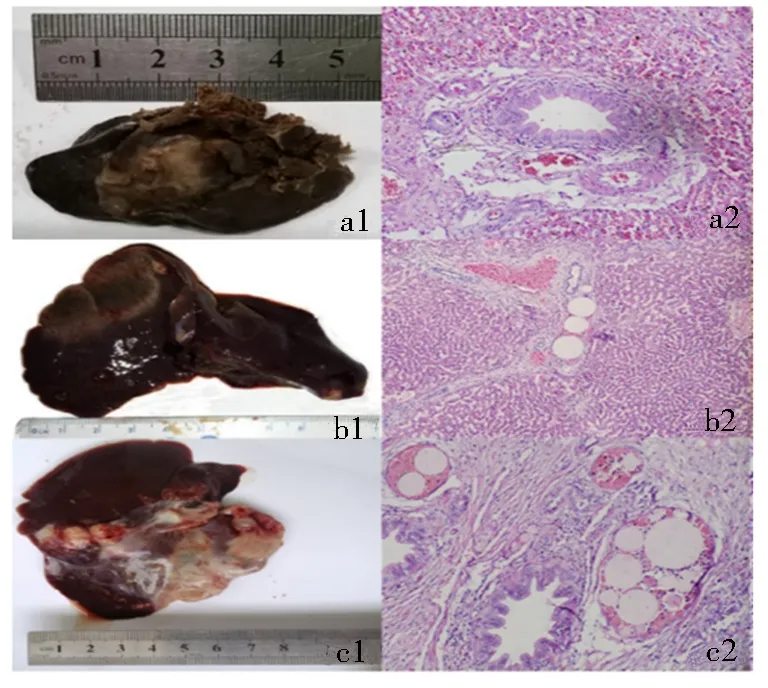
a1、a2.单纯造影组;b1、b2.姜黄素微球组;c1、c2.空白微球组.图8 每组肝脏的组织病理学图像(H&E染色)Fig.8 Histopathological images of liver in each group (H&E stain)
4 结论
目前广泛的研究和临床实验证实,载药微球可选择性地将大部分药物递送至肿瘤部位,降低全身药物浓度,但载药微球的临床使用受限于其单一的载药模式和高昂的价格.本文以PVA为原料制备姜黄素栓塞微球.确定的最佳工艺参数为:质量分数5% PVA水溶液,含有质量分数0.5% span 80的液体石蜡溶液,1 mol/L盐酸作催化剂,乳化温度为60 ℃.扫描电子显微镜显示载药微球球形好,平均粒径为94.19 μm.生物安全性测试证明载药微球安全指数较高,对癌细胞有抑制作用.药效学实验发现姜黄素微球对兔肝癌有治疗作用.综上,本实验研制的姜黄素栓塞微球安全性高,对肝癌的治疗效果良好,有望用于临床肝癌的治疗.
5 讨论
肝动脉化疗栓塞能够在降低化疗药物毒性的同时提高疗效,应用范围广,发展前景优越.微球递药系统一直是药剂学领域的研究热点之一,姜黄素栓塞微球能够缓慢释放药物,载药量高,副作用少.国内外研究均表明,载药栓塞微球对于多种类型肿瘤的临床效果比常规栓塞和化疗好.国内外已上市销售的有DC Bead®栓塞微球(英国)、Hepasphere®栓塞微球(美国)以及CalliSphere®栓塞微球(中国).当前上市栓塞微球主要通过机械吸附或正负电荷结合方式载药,载药模式单一,同时载药种类有限(临床限于阿霉素、吡柔比星、伊立替康等),价格昂贵.本研究将姜黄素包埋于载体内制备微球,扩大了栓塞载药微球药物的选择范围.今后实验将进一步优化制剂工艺,加速栓塞微球向临床应用阶段转化,早日实现微球的生产上市.
