不同因素对花椒根腐病拮抗菌生长和生物膜形成的影响
2022-04-22田凤鸣何九军卓平清王让军
田凤鸣 陈 强 何九军 卓平清 王让军
(1陇南师范高等专科学校农林技术学院 甘肃 陇南 742500;2陇南特色农业生物资源研究开发中心 甘肃 陇南 742500)
1978年,细菌生物膜(BBF)由Costerton等人第1次提出,是一种微生物聚集群落,附着在生物或非生物的表面[1]。生物膜具有着非常重要的作用,例如能够很好的抵御外界有害物质的入侵、调整细菌间的协调代谢、降低遗传物质的横向传递及外部环境压力等[2],是细菌群体合作和竞争并存的一种方式。BBF的形成会受到不同环境因素如温度、pH值、盐浓度、金属离子等方面的影响。在适宜条件下,细菌均能形成BBF,但形成BBF的能力因环境的影响会出现差异,有的因素能促进细菌生物膜的形成,有的因素能抑制细菌生物膜的形成[3]。
目前关于芽孢杆菌生物膜形成条件的报道很多,例如冯静静[2]等获得了纳豆芽孢杆菌生物膜形成的最佳条件,李南薇[4]等获得了蜡样芽孢杆菌生物被膜生长的最佳条件,吴园园[5]等获得了枯草芽孢杆菌NCD-2菌株生物膜形成的最佳条件。徐志辉[6]研究中发现不同浓度的铁离子对解淀粉芽孢杆菌SQR9生物膜的形成具有不同作用,具有低铁促进高铁抑制的现象。但关于贝莱斯芽孢杆菌生物膜生长条件的探索报道甚少,特别是贝莱斯芽孢杆菌作为一种对花椒根腐病具有拮抗作用的生防菌。
因此,本试验以花椒根腐病为指示菌,从健康花椒根系土壤中分离获得的拮抗菌T-1为研究对象,探索不同因素(pH值、温度、金属离子、盐浓度)对贝莱斯芽孢杆菌T-1细菌的生长和生物膜的形成条件,可为更多地了解该菌株的特性,进一步研究贝莱斯芽孢杆菌T-1的拮抗机制及生物膜的形成机制提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株。本试验中的供试花椒根腐病病原菌茄腐镰孢菌(Fusariumsolani)由本实验室分离获得、保存,拮抗菌贝莱斯芽孢杆菌T-1由本实验室分离获得、保存。2种病原菌前期的分离鉴定工作已经完成,菌种保存备用。
1.1.2 培养基。LB液体培养基:胰蛋白胨10g,酵母提取物5g,氯化钠10g,琼脂15~18g(液体培养基不加),定容至1L,高压灭菌20min。
1.1.3 主要试剂。无菌生理盐水、甲醇、结晶紫染液、冰醋酸、硫酸铜、硫酸镁、硫酸锌、硫酸亚铁、氯化钾、硫酸铵,均由西安飞越化玻试剂公司提供。
1.2 拮抗菌T-1生长曲线的测定。将适量对数生长期的贝莱斯芽孢杆菌T-1菌液加入50mlLB液体培养基中,放置摇床中30℃,200rpm/min振荡培养,每隔1h检测1次菌液浓度,以OD590为纵坐标,以培养时间为横坐标,绘制生长曲线。
1.3 不同因素对贝莱斯芽孢杆菌T-1生长及生物成膜的影响
1.3.1 pH值对贝莱斯芽孢杆菌T-1的生长及生物成膜的影响。①pH值对拮抗菌T-1生长的影响:用HCl和NaOH调节LB培养基的pH值为1~10,以未调pH值的培养基为对照组,将对数生长期的菌液T-1按照一定的比例接种于LB培养基中,每种条件设置3次重复,放置摇床中30℃,200rpm/min振荡培养12h。②pH值对贝莱斯芽孢杆菌T-1生物成膜生长量的影响:取24孔无菌细胞板,每孔加入2ml上述培养好的菌液,空白对照以未加菌液的LB培养基为准,在28℃培养箱中静置24h后,小心吸去拮抗菌T-1菌液,将生物膜保留在细胞板内,2ml无菌生理盐水漂洗3~5次,后用2ml浓度为99%的甲醇冲洗,10~15min后弃去甲醇,将培养板倒扣在吸水纸上干燥,每孔中加入1ml结晶紫溶液染色5min后吸去染液,培养板继续倒扣在吸水纸上进行干燥,每孔中加入体积分数为33%的冰乙酸2ml溶解于生物膜的结晶紫染液;以稀释50倍的33%冰乙酸溶液作为空白对照,在OD570条件下测定生物膜的吸光度,每个处理重复3次。
1.3.2 盐浓度对贝莱斯芽孢杆菌T-1的生长及生物成膜的影响。①盐浓度对贝莱斯芽孢杆菌T-1生长的影响:将LB培养基配制成含NaCl浓度为1%~9%的梯度,将对数生长期的菌液T-1按照一定的比例接种于LB培养基中,每种条件设置3次重复,放置摇床中30℃,200rpm/min振荡培养12h。②盐浓度对贝莱斯芽孢杆菌T-1生物成膜生长量的影响:此试验方法按照1.3.1测定方法进行。
1.3.3 金属离子对贝莱斯芽孢杆菌T-1的生长及生物成膜的影响。①金属离子对贝莱斯芽孢杆菌T-1生长的影响:将LB培养基分别配制成含有浓度为5g/L金属 离 子 的FeSO4、(NH4)2SO4、MgSO4、ZnSO4、KCl、CuSO4培养基,将对数生长期的菌液T-1按照一定的比例接种于LB培养基中,每种条件设置3次重复,放置摇床中30℃,200rpm/min振荡培养12h。②金属离子对贝莱斯芽孢杆菌T-1生物成膜生长量的影响:此试验方法按照1.3.1测定方法进行。
1.3.4 温度对贝莱斯芽孢杆菌T-1的生长及生物成膜的影响。①温度对贝莱斯芽孢杆菌T-1的生长影响:将培养温度分别设置为20℃、25℃、30℃、35℃、40℃、45℃,放置摇床中,200rpm/min振荡培养12h。②温度对贝莱斯芽孢杆菌T-1生物成膜生长量的影响:此试验方法按照1.3.1测定方法进行。
1.4 数据处理。结果以平均数和标准偏差表示(x,s),用excel、SPSS19.0软件进行分析。
2 结果与分析
2.1 贝莱斯芽孢杆菌T-1生长曲线。图1为贝莱斯芽孢杆菌T-1生长曲线,结果显示:菌株T-1从第2h到第7h快速进入对数生长期,之后保持一段稳定期,从第9h以后进入衰退期,通过生长曲线的测定,可以很好的掌握该菌在特定培养条件下的生长规律。

图1 拮抗菌T-1生长曲线
2.2 不同因素对贝莱斯芽孢杆菌T-1生长及生物成膜的影响
2.2.1 pH值对贝莱斯芽孢杆菌T-1的生长及生物成膜的影响。由图2可知,pH值<4和 pH值>8时都不利于该菌的生长,生长缓慢,甚至没有生长,pH值为5时该菌的生长速度最快;同时通过生物成膜生长量的测定结果显示:pH值为7~9时,该菌生物成膜生长量最大,当pH值<6和pH值>9时生物膜的生长量较低,这说明pH值对拮抗菌T-1的生长及生物成膜的影响差异明显。
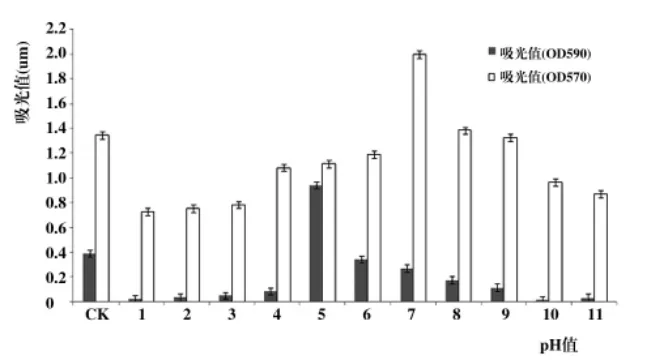
图2 pH值对拮抗菌T-1的生长及生物成膜的影响
2.2.2 NaCl浓度对贝莱斯芽孢杆菌T-1的生长及生物成膜的影响。由图3可知:拮抗菌T-1在NaCl浓度为1%~4%时生长良好,盐浓度NaCl>5%时生长速度降低,在8%时依然具有一定的生长量,说明该菌具有一定的耐盐性;生物成膜生长量测定结果显示:NaCl浓度为1%~4%时该菌生物成膜生长量逐渐升高,NaCl浓度为4%时生长量最高,Na-Cl浓度为5%~8%时成膜生长量逐渐降低,NaCl浓度为8%时生物成膜量依然能被检测到。

图3 NaCl浓度对拮抗菌T-1的生长及生物成膜的影响
2.2.3 金属离子对贝莱斯芽孢杆菌T-1的生长及生物成膜的影响。由图4可知,培养基中添加不同金属离子对拮抗菌T-1的生长及生物成膜的影响存在明显的差异,添加了Fe2+和Cu2+的培养基拮抗菌株生长显著,其中Fe2+最有利于菌株的生长,生物成膜生长量测定结果显示:Zn2+、NH4+、Mg2+、Cu2+、K+都能促进拮抗菌T-1生物成膜的生长,其中Zn2+促进作用最显著,生物成膜量最高。

图4 金属离子对拮抗菌T-1的生长及生物成膜的影响
2.2.4 温度对贝莱斯芽孢杆菌T-1生长及生物成膜的影响。由图5可知:拮抗菌T-1在不同的温度下其生长速度也不同,30℃~35℃时适于该菌的生长,35℃以上该菌的生长速度逐渐降低;生物成膜生长量的测定结果显示:该菌在20℃~45℃时均具有生长量,30℃既是该菌最适合的生长温度,也是该菌生物成膜量最高的温度。

图5 温度对拮抗菌T-1的生长及生物成膜的影响
3 结论与讨论
为了确定贝莱斯芽孢杆菌T-1生长和生物成膜条件,本试验测定了不同因素对拮抗菌T-1生长及生物成膜的影响,pH值、NaCl浓度、金属离子、温度对该菌的生长和生物成膜都有不同程度的影响。拮抗菌T-1生长的最适pH值为5,最适合的生长温度为30℃,在NaCl浓度为1%~4%时该菌长势依然良好,高盐浓度不利于该菌的生长,低盐浓度适于该菌的生长,在Fe2+的培养基中拮抗菌T-1生长最显著。拮抗菌T-1生物成膜的最佳条件:最适pH值为7,最适合的生长温度为30℃,在NaCl浓度为4%时生物成膜量最高,Zn2+对拮抗菌T-1生物成膜量的促进最显著。本文通过试验测定不同理化条件下菌株T-1生长和生物膜形成规律,为后期研究该菌的致病机理和防治措施奠定了理论基础。
