伯克霍尔德氏菌JP2-270抗水稻纹枯病菌机理的初步研究
2022-04-22吴丽娟王惠梅鄂志国
吴丽娟,韩 聪,王惠梅,王 磊,鄂志国
(中国水稻研究所,杭州 311401)
水稻OryzasativaL.是三大粮食作物之一,全球有接近一半的人口以稻米为食。随着人口数量的不断增长,对稻米的需求也在不断增加。然而,水稻在生长过程中其产量不可避免地受到各种生物和非生物因素的影响,其中水稻病虫害导致的减产占很大的比例。纹枯病是由立枯丝核菌Rhizoctoniasolani引起的一种破坏性土传病害,从苗期至穗期都可发病,是水稻三大病害之一[1]。尽管对水稻种质资源进行了大量筛选,但还没有发现对纹枯病具有完全抗性的水稻品种,高抗性品种也很少见[1,2]。由于水稻的固有抗性水平低,目前不可能通过寄主抗性控制纹枯病的传染。当前,国内外主要采用化学农药对其进行防治,但常年施用化学农药不仅造成环境污染、土壤板结等环境问题,还会促使病原菌产生抗性,使得防治难度加大,给农业生态带来严重的后果。此外,由于高温高湿的环境有利于纹枯病菌的生长和侵染,而全球气候变暖可能进一步增加该病害对水稻产量的损害风险。因此,研究开发新的符合生态要求的方法防治水稻纹枯病是一项迫在眉睫的任务。目前,利用生防细菌防治植物病害是植物病害防治的主要策略之一,大多数的生防微生物来源于自然,对环境无污染、对非靶标生物安全,现已成为防治水稻纹枯病的新途径。在国内外,许多研究者发现多种真菌和细菌对纹枯病菌具有很好的拮抗作用,例如:一株紫杉木霉ZJUF0986能够有效防治水稻纹枯病[3],芽胞杆菌Bacillusspp.、荧光假单胞菌Pseudomonasfluorescens和放线菌Actinomycetesspp.也有用于防治水稻纹枯病的报道[3-6]。近年来,对生防微生物的研究呈现逐步上升的趋势,而进一步研究生防菌的抑菌机理,对深化生防菌的应用和开发新型微生物源农药具有重要意义。
伯克霍尔德氏菌Burkholderia广泛分布于土壤、水体以及植物的根际中[7]。伯克霍尔德氏菌是一类重要的生防和促生细菌,所产生的胞外酶能够溶解土壤中难溶性的磷,促进植物的生长[8,9],还可产生对不同真菌病害具有抑制作用的多种次生代谢产物[10-12]。此外,伯克霍尔德氏菌在医药领域也具有重要的研究意义,所产生的代谢物具有抗细菌、抗病毒和抗肿瘤细胞等活性,是药物先导化合物的重要资源[12,13]。近年来,对伯克霍尔德氏菌及其代谢物在农业和医药领域的应用研究不断升温,多种由伯克霍尔德氏菌产生的抗菌物质occidiofungin、gladiostatin、thailandepsins、pyrrolnitrin、pyoluteorin和AFC-BC11等相继被发现和报道[10,12-16]。伯克霍尔德氏菌产生的天然代谢物,因来源于自然,对环境友好等特点,已经越来越引起研究者的重视。伯克霍尔德氏菌不仅是国内外生物防治研究的热点,还是医药领域继链霉菌之后微生物天然产物挖掘的又一重要资源。
本研究以一株分离自水稻根系土壤的伯克霍尔德氏菌JP2-270为对象,利用分子生物学等方法研究其抑制水稻纹枯病菌的机理,为进一步田间试验提供技术支撑,同时也为遗传改造该菌株提高其合成目标代谢产物的能力提供理论依据。
1 材料与方法
1.1 供试菌株及培养条件
伯克霍尔德氏菌 JP2-270及其衍生菌株培养条件为 Luria-Bertani培养基(LB 培养基),28 ℃。LB液体培养基配方:胰蛋白胨10 g,酵母粉5 g,氯化钠10 g,蒸馏水1000 mL,pH 7.2,常规灭菌后使用。若为固体培养基,在灭菌前向其中添加琼脂粉15 g/L。接一新鲜单菌落JP2-270 于3 mL LB培养液中过夜培养,菌悬浮液保藏于20%甘油中,于-80 ℃冰箱长期冻存。每次活化JP2-270均从-80 ℃冰箱中取出,用无菌接种环挑取适量于LB固体培养基表面划线。
试验中用到的病原真菌生长条件为PDA培养基(马铃薯200 g、葡萄糖20 g、琼脂粉10 g,pH 7.0,定容至1000 mL),28 ℃恒温培养。
大肠杆菌EscherichiacoliDH5α感受态购于上海碧云天生物技术有限公司,培养条件为LB培养基,37 ℃。
伯克霍尔德氏菌JP2-270发酵培养基:营养肉汤酵母抽提(NBY,Nutrient broth yeast extract:蛋白胨10 g、牛肉浸粉3 g、酵母5 g、氯化钠5 g,pH 7.0,定容至1000 mL),条件为28 ℃、200 r/min振荡培养72 h。
培养基中抗生素使用量为氨苄青霉素100 μg/mL,硫酸卡那霉素50 μg/mL,萘啶酮酸30 μg/mL。抗生素购于上海生工生物科技有限公司。
本研究所用到的菌株和质粒信息见表1。
1.2 菌株JP2-270抗真菌活性筛选及温室盆栽防效试验
采用平板对峙法进行菌株JP2-270抗真菌活性筛选[17]。将病原真菌(表2)提前在PDA固体培养基上进行活化。将菌株JP2-270于LB平板上活化后,挑取单菌落接种于2 mL LB液体培养基,28 ℃、200 r/min振荡培养10~12 h,然后取5 μL培养液滴加PDA培养基中心点两侧,距中心2.5 cm处,同时将活化好的病原真菌用6 mm打孔器沿着菌丝边缘打取一个菌饼,然后将菌饼的菌丝面朝下,接种到已经接种有供试菌JP2-270的PDA培养基中央,接种5个平板作为重复。以不接供试菌JP2-270而只接种病原菌的平板为对照。在28 ℃下进行对峙培养,培养2~7 d观察并记录抑菌圈半径,计算抑制率,抑制率(%)=(对照菌落半径-处理菌落半径)/(对照菌落半径-菌饼半径)×100。
以水稻品种lement为材料,对水稻纹枯病的温室盆栽防治效果进行研究。水稻种子于28 ℃环境中浸泡催芽,3 d后将发芽的种子种植到装有盆栽土壤的塑料托盘中(23 cm×16 cm×6 cm)。水稻植株在常规温室条件下生长(光照12 h,25 ℃±5 ℃)。待生长至分蘖期,用1×108CFU/mL的含细胞发酵液喷施水稻植株,24 h后用牙签固定一块纹枯病菌 GD118 菌饼(0.6 cm)于每一个植株的叶鞘处。空白对照处理喷施等量无菌 NBY培养基(液)。阳性对照处理喷施10%井冈霉素水剂(浙江省桐庐汇丰生物科技有限公司)。所有处理接种 20株植物作为重复。调节温室空气湿度,保持相对湿度在 90%。接种7 d后,测量病斑长度,计算抑制率,抑制率(%)=(空白对照的平均病斑长度—各处理平均病斑长度)/空白对照的平均病斑长度×100。
1.3 基因敲除及回补
1.3.1 基因敲除载体构建 利用同源重组法构建无标记基因框内缺失突变体,所用载体为pK18mobSac[18]。使用在线引物设计软件 primer 3,根据伯克霍尔德氏菌 JP2-270基因组中硝吡咯菌素合成基因prnC(GeneBank登录号CP029828中的DM992_38825基因)及其上下游序列,设计扩增上游同源臂引物prnCupF(5′-TCAGCGGCAAAGTTCATGAC-3′)/prnCupR(5′-AATCAACAGTTTCGCGTGCTGATCATCAACTC GAAGTACAGCCTGCT-3′)和下游同源臂引物 prnCdwF(5′-GATGATCAGCACGCGAAACT-3′)/ prnCdwR(5′-CGCCGGAAATCCTGTAGTG-3′);类似地,根据抗真菌糖肽occidiofungin合成基因ocfE(GeneBank登录号 CP029828中的 DM992_3338基因)及其上下游序列,设计扩增上游同源臂引物 ocfEupF(5′-GACGCATACCTGTTCAGCTG-3′)/ocfEupR(5′-CCAGCGGATAGTGCGCATAGTCCTCCTGCCACT GTTTCACCAAAGCC-3′)和下游同源臂引物 ocfEdwF(5′-CAGGAGGACTATGCGCACTA-3′)/ocfEdwR(5′-CGAAGAAGTGGAGATTGCCG-3′);根据剑兰制霉菌素gladiostatin合成基因gdsE(GeneBank登录号CP029828中的DM992_38920基因)及其上下游序列,设计扩增上游同源臂引物gdsEupF(5′-TCTAGAG CCGAACATGCTGTCGTATT-3′)/gdsEupR(5′-GGCCGGCGAGATGTGGAAGAACGCGGCATCTACCTC GTACCAGCAGC-3′)和下游同源臂引物 gdsEdwF(5′-GCCGCGTTCTTCCACATCT-3′)/ gdsEdwR(5′-AAG CTTTCCTCTCCATTTACTCGCCG-3′)。
PCR 反应体系:2×KOD One PCR Master Mix(TOYOBO)25 μL,正向引物(10 mmol/L)1 μL,反向引物(10 mmol/L)1 μL,模板 0.5 μL(约 50 ng DNA),ddH2O 补足 50 μL。
PCR反应程序如下:98 ℃预变性3 min;98 ℃变性10 s,60 ℃退火5 s,72 ℃延伸5 s,此过程进行35个循环;之后延伸10 min。所使用PCR仪器为伯乐 Bio-Rad T100。
PCR反应结束后,将PCR产物分别经1%琼脂糖凝胶电泳进行分离,在紫外光下分别切下所扩增的目的条带,用爱思进Axygen DNA凝胶回收试剂盒(AP-GX-50)进行胶回收处理,纯化后的基因片段命名为prnCup和prnCdw、ocfEup和ocfEdw、gdsEup和gdsEdw,可立即使用或于-20 ℃保存备用。
根据同源重组的原理,用ClonExpress II One Step Cloning Kit(C112-01,诺唯赞)试剂盒,将纯化后的基因片段prnCup和prnCdw,ocfEup和ocfEdw,gdsEup和gdsEdw,按顺序同时连接至线性化载体pK18mobSacB上,构建基因敲除载体。按照说明书配制连接反应体系,将配好的连接反应体系轻轻混匀,37 ℃反应30 min。反应结束后,将离心管置于冰上冷却数秒。之后可将重组产物保存于-20 ℃备用或直接用于转化。
上述重组反应产物转化至大肠杆菌E.coliDH5α(碧云天)感受态细胞。采用热激法转化,从转化筛选平板上随机挑取若干单菌落作为模板,以载体上的引物M13F(5′-GTTTTCCCAGTCACGAC-3′)和M13R(5′-CAGGAAACAGCTATGAC-3′)进行 PCR,验证两个插入片段是否按顺序同时插入到线性化的pK18mobSacB载体中。将PCR扩增结果为阳性的单菌落接种至含卡那霉素抗生素的LB液体培养基中,于 37 ℃、200 r/min振荡培养过夜,菌液直接送公司测序,将序列完全正确的质粒定名为 pK18-prnC、pK18-ocfE和pK18-gdsE,保存质粒进行下一步操作。
1.3.2 菌株JP2-270基因敲除突变株的构建 采用电转化法,将pK18-prnC、pK18-ocfE和pK18-gdsE分别转入S17-1(λpir+)感受态细胞中。然后利用双亲结合法,将pK18-prnC、pK18-ocfE和pK18-gdsE分别转入菌株JP2-270中。首先通过卡那霉素和萘啶酮酸抗性的筛选获得成功转入的伯克霍尔德氏菌单交换突变株,经过再次抗性验证后进行无抗性的松弛培养。松弛培养 6~8代后,取一定量的菌液进行梯度稀释,后涂铺于无抗生素的 LB平板上。待单克隆长出后,用牙签挑取单克隆,同时划线接种于含卡那霉素抗性的LB平板和无抗性平板上(两个板上的克隆要一一对应),28 ℃培养48 h,挑取在含卡那霉素抗性平板上不生长而无抗性平板上生长的菌落进行PCR验证,引物使用T-prnCF(5′-ACGTCCTGCCGGTAGT AATG-3′)和 T-prnCR(5′-TTACGCCTACCGCTTCATCT-3′)、T-ocfEF(5′-CGGCCTGTTCATCAATACG G-3′)和 T-ocfER(5′-GGAAGATGAGCAGGCTTTCG-3′)、T-gdsEF(5′-GCCGAACATGCTGTCGTATT-3′)和 T-gdsER(5′-GTGCACGTCGAGGAAGAAC-3′),以基因敲除载体(pK18-prnC、pK18-ocfE和 pK18-gdsE)和菌株JP2-270基因组分别为阳性和阴性对照,扩增片段大小与载体扩增片段大小一致的为正确的双交换突变株,而扩增片段大小与基因组大小一致的为回复突变株。获得的双交换突变株定名为 ΔprnC、ΔocfE和 ΔgdsE。
1.3.3prnC基因回补质粒的构建 选择载体 pBBR1MCS-2,使用 C-prnCF(5′-CTACTTCAGCGCCAA GCC-3′)和C-prnCR(5′-TCTGCAGAAAATGGTCGAATC-3′)引物扩增prnC完整基因及其上游601 bp的区域(含prnC启动子区),按照1.3.1所述方法,构建回补prnC基因的回补载体pBBR2-prnC。
1.3.4prnC回补菌株的构建 按照1.3.2所述方法,将pBBR2-prnC转入ΔprnC中,经过抗性验证成功的菌落克隆即为ΔprnC中成功回补了prnC基因的菌株,命名为ΔprnC+pBBR2-prnC。
1.4 RNA提取及荧光定量PCR(qRT-PCR)分析
菌株JP2-270(WT)和框内bysR缺失突变株(ΔbysR前期研究中已构建),在LB平板上活化,挑取单克隆接至3 mL LB液体培养基中,28 ℃、200 r/min过夜培养。次日,将培养液按照1% 接种量接种到新鲜LB液体培养基中,28 ℃、200 r/min振荡培养48 h,离心收集菌体,立刻冻于-80 ℃冰箱备用或直接进行RNA提取。RNA提取采用细菌RNA提取试剂盒(DP430,北京天根生物科技有限公司),按照说明书制备总 RNA。用1%琼脂糖凝胶电泳分析其质量和浓度。用gDNA去除剂(TOYOBO,东洋纺)在37 ℃下消化基因组DNA(gDNA)5 min,用逆转录酶Ace qPCR RT Master Mix(TOYOBO,东洋纺)将总RNA(约1 μg)转化为cDNA。将样品稀释,在PCR体系中加入约50 ng cDNA,总体积为20 μL,使用THUNDERBIRD SYBR qPCR Mix(TOYOBO,东洋纺)进行定量PCR(qPCR)。反应体系为:2×SYBR qPCR Mix 10 μL,10 mmol/L 正向引物 0.4 μL,10 mmol/L 反向引物 0.4 μL,50×ROX 0.02 μL,cDNA 1 μL,ddH2O补足至20 μL。反应程序为:95 ℃预变性7 min;95 ℃ 变性30 s,58 ℃退火30 s,72 ℃延伸40 s,40个循环;反应在Applied Biosystems 7500仪器上进行,按说明进行设置。以recA基因为内参,采用2-ΔΔCT法测定prnA和prnC基因的相对表达量。检测prnA基因相对表达量的引物为qRT-prnAF(5′-TCCGTTCA ACCAGAAGTTCC-3′)和 qRT-prnAR(5′-GCCATCAAGGAAAAGGTTC A-3′),检测prnC基因相对表达量的引物为 qRT-prnCF(5′-GATGTCCGTTTTCGGGTAGA-3′)和 qRT-prnCR(5′-CGACGACATCTTCAAG GTCA-3′),内参recA基因的扩增引物为 qRT-recAF(5′-CGG CTCAATCAAGAAGAACG-3′)和 qRT-recAR(5′-AGATGCCCTCGCCATACAG-3′)。
1.5 高效液相色谱(HPLC)分析
使用NBY液体培养基对供试菌株进行发酵,发酵周期为72 h。发酵液(含细胞)按照1:1.2比例加入乙酸乙酯进行萃取,室温萃取4 h后,取有机相进行旋转蒸发,沉淀物用色谱级的甲醇溶液溶解后,用0.22 μm有机滤膜过滤。过滤后所得即为发酵液粗提物,粗提物可直接进行高效液相色谱分析或保存与-20 ℃备用。色谱分析条件:使用安捷伦色谱柱Agilent Zorbax SB-C18,长度 250 mm×9.2 mm,粒径 5 μm;流动相使用甲醇水梯度混合液,即从90%水和10%甲醇混合液开始,30 min内甲醇浓度梯度升至100%,检测波长为220 nm。高效液相色谱分析在安捷伦1260仪器上进行,按照仪器说明设置程序和参数。所用流动相均为色谱级的水和色谱级的有机溶剂。
1.6 数据统计与分析
数据分析和作图在Microsoft Excel 2010中进行。T检验用于比较两组数据间的差异,当P<0.05时,有显著性差异,当P<0.01时,有极显著差异。
2 结果与分析
2.1 菌株JP2-270抗真菌活性
采用平板对峙生长法对菌株JP2-270的抑菌谱进行测定结果表明,菌株JP2-270除了对水稻纹枯病菌具有抑制活性外,对水稻稻瘟病菌不同生理小种(Guy11和B157)、大豆菌核病、香蕉枯萎病、番茄斑枯病、小麦赤霉病和烟草枯萎病等病原真菌物均具有不同程度的抑制作用,表明菌株JP2-270具有广谱抑菌活性(表2)。
2.2 菌株JP2-270发酵液对水稻纹枯病防治效果
温室盆栽试验结果表明,菌株JP2-270对水稻纹枯病菌具有较好的预防效果。只喷施无菌NBY培养液的对照叶片接种纹枯病菌后所产生的平均病斑长度为(7.00±1.25)cm;经过菌株 JP2-270发酵液处理的水稻叶片,纹枯病菌侵染产生的病斑长度平均为(0.75±0.50)cm,与对照相比有极显著差异,抑制率达89.36%;经井冈霉素处理的叶片平均病斑长度为(0.51±0.20)cm,与对照相比有极显著差异,抑制率为92.79%(图1,表3)。菌株JP2-270发酵液处理对水稻纹枯病菌的防治效果与井冈霉素处理无显著差异(P=0.057)。

图1 菌株JP2-270发酵液和井冈霉素抑制水稻纹枯病菌活性Fig.1 The inhibitory activity of JP2-270 fermentation broth and Jinggangmycin against R.solani GD118

表3 菌株JP2-270 发酵液抑制纹枯病菌活性Table 3 The control efficacy of JP2-270 fermentation broth against rice sheath blight
2.3 菌株 JP2-270抑制纹枯病菌活性物质硝吡咯菌素pyrrolnitrin的测定结果
根据菌株JP2-270基因组,利用antiSMASH软件预测了菌株JP2-270的次生代谢物合成基因簇信息,菌株 JP2-270基因组上含有与硝吡咯菌素pyrrolnitrin、抗真菌糖肽 occidiofungin和剑兰制霉菌素gladiostatin合成基因簇高度同源的基因簇(未发表数据),即NCBI 基因登录号CP029826中的基因DM992_38820-DM992_38835对应硝吡咯菌素合成基因簇;基因DM992_33325-DM992_33410对应抗真菌糖肽合成基因簇;基因DM992_38890-DM992_38940对应剑兰制霉菌素合成基因簇。
为了明确菌株JP2-270产生抑制纹枯病菌的代谢物,对上述3个已知代谢物合成基因簇中的关键基因进行靶向敲除,通过比较各突变株的抑菌活性差异寻找活性代谢物合成基因簇结果显示,当硝吡咯菌素合成基因簇中的prnC基因敲除后,受菌株ΔprnC抑制的真菌生长半径为(2.30±0.10)cm,受野生型菌JP2-270抑制的菌丝生长半径为(1.16±0.05)cm,两组数据间T检验P<0.01,表明突变菌株ΔprnC抑制纹枯病菌活性,与野生型菌株JP2-270相比明显降低,具有极显著差异。而抗真菌糖肽 occidiofungin的合成基因簇中关键基因ocfE发生突变后,受突变菌株ΔocfE抑制的纹枯病菌菌丝生长半径为(2.11±0.11)cm,受对照野生菌株JP2-270抑制的菌丝生长半径为(1.98±0.08)cm,两组数据间T检验P>0.05(P=0.074),表明菌株ΔocfE抑制纹枯病菌活性与野生型菌株JP2-270相比略有下降,但无显著差异。并且剑兰制霉菌素gladiostatin合成基因簇中的聚酮合酶基因gdsE靶向缺失后,受突变菌株ΔgdsE抑制的纹枯病菌菌丝生长半径与受野生型菌株JP2-270抑制的菌丝生长半径分别为(1.29±0.12)和(1.16±0.05)cm,两组数据间T检验P>0.05(P=0.065),表明菌株ΔgdsE抑制纹枯病菌活性比菌株 JP2-270略有降低,但无显著差异(图2)。同时,在ΔprnC中回补完整的prnC基因后,菌株ΔprnC+pBBR2-prnC能够恢复野生型菌株JP2-270的抑制活性,且ΔprnC抑制纹枯病菌的活性并不能被空载体pBBR1MCS-2所恢复(图3)。由此可见,硝吡咯菌素合成基因簇所负责合成的硝吡咯菌素是菌株JP2-270产生抑制水稻纹枯病菌的主要活性代谢物。
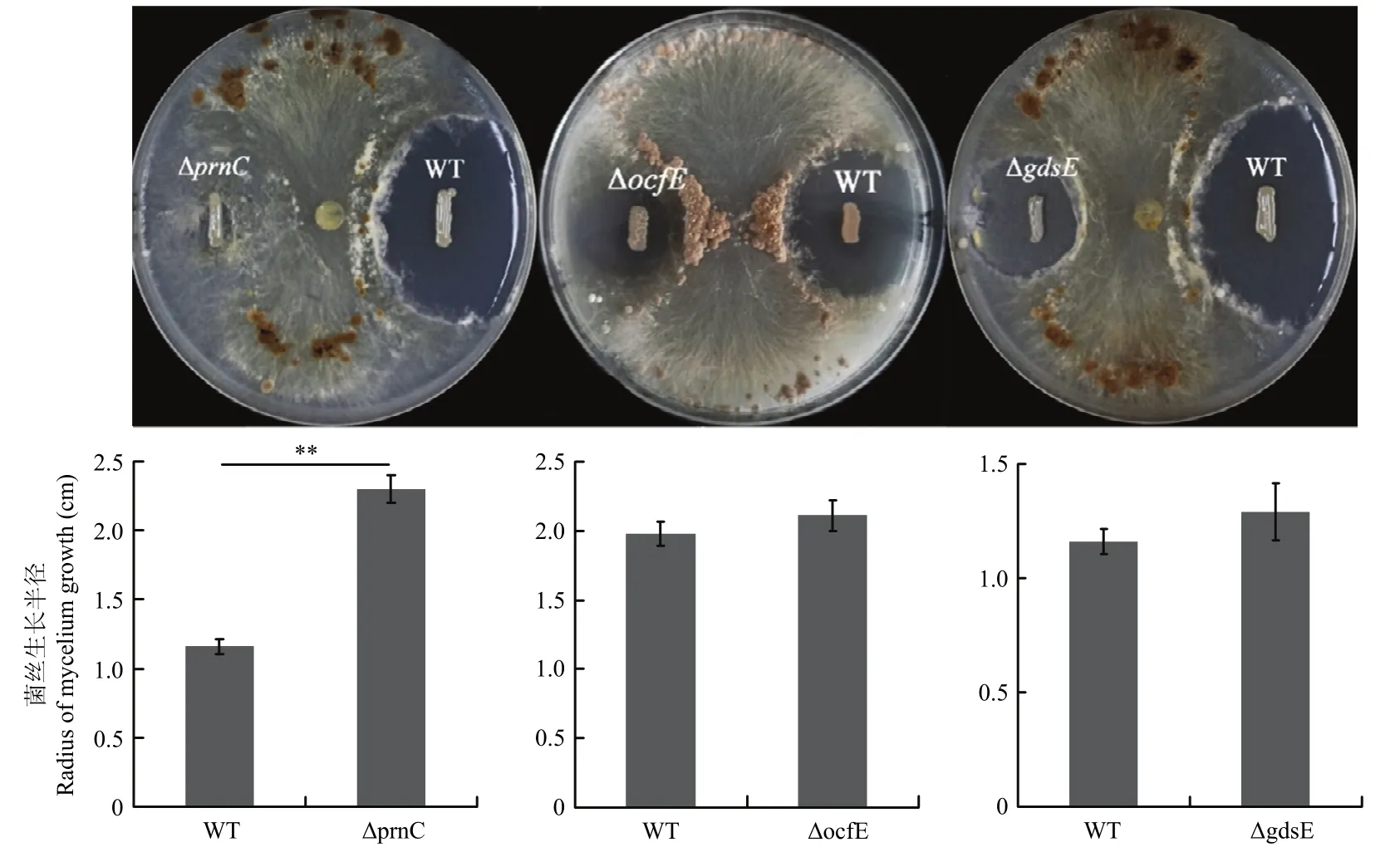
图2 菌株JP2-270各突变菌株抑制纹枯病菌活性Fig.2 Inhibitory activity of JP2-270 derivatives against R.solani GD118

图3 菌株ΔprnC+pBBR2-prnC和ΔprnC+pBBR2抑菌活性Fig.3 Inhibitory activity of ΔprnC+pBBR2-prnC and ΔprnC+pBBR2 against R.solani GD118
2.4 BysR在转录水平上正调控硝吡咯菌素pyrrolnitrin的合成
BysR属于LysR类型转录调控蛋白,根据前期研究结果,推测BysR蛋白能够调控硝吡咯菌素合成基因簇prn的表达,来调控硝吡咯菌素的合成,进而发挥抑制水稻纹枯病菌活性。为了证实该假设,本研究以recA基因为内参,采用qRT-PCR技术从转录水平上分析硝吡咯菌素合成基因簇是否受到BysR调控蛋白的调控。硝吡咯菌素合成基因簇由prnA、prnB、prnC和prnD四个基因组成,本研究选取其中prnA和prnC来检测其表达量如图4所示,与野生型菌株JP2-270相比,在bysR基因突变菌株ΔbysR中,prnA和prnC基因的表达量出现明显下调,说明BysR调控蛋白在转录水平上调控硝吡咯菌素合成基因簇的表达,从而调控硝吡咯菌素的合成。
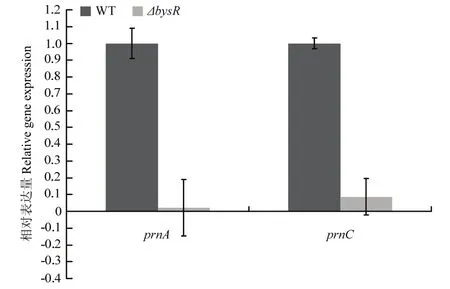
图4 硝吡咯菌素合成基因prnA和prnC相对表达量Fig.4 Relative gene expression of pyrrolnitrin synthetic gene prnA and prnC
2.5 HPLC差异代谢物分析
为了从代谢物合成水平上验证BysR调控蛋白能够调控硝吡咯菌素的合成,本研究比较了菌株JP2-270和ΔbysR所产生的次生代谢物差异。首先菌株JP2-270、ΔbysR和bysR回补菌株分别用NBY培养基进行发酵培养,72 h后将发酵产物进行乙酸乙酯抽提、旋转蒸发,得到粗提物。然后和硝吡咯菌素标准品(sigma)一起进行高效液相色谱分析。如图5A所示,硝吡咯菌素标准品的出峰时间在22.203 min,菌株JP2-270的粗提物在22.206 min有一个明显的物质峰,与标准品的出峰时间几乎一致,说明菌株JP2-270的代谢产物中存在硝吡咯菌素。而 ΔbysR菌株在相应时间没有对应的物质峰,表明bysR缺失突变后导致菌株不能合成硝吡咯菌素。为了进一步证实bysR直接参与硝吡咯菌素的合成,分析了菌株 JP2-270、ΔbysR和bysR回补菌株(ΔbysR+pBBR-bysR,前期研究已构建)代谢物合成差异,如图 5B所示,硝吡咯菌素标准品的出峰时间为23.090 min,野生型菌株JP2-270和bysR回补菌株(ΔbysR+pBBR-bysR)的发酵粗提物分别在23.086和23.099 min处能检测到明显的物质峰,与标准品的出峰时间几乎一致,说明bysR基因的回补能够恢复bysR基因突变株ΔbysR合成硝吡咯菌素的能力。综合以上结果,BysR调控蛋白与硝吡咯菌素的合成相关,对硝吡咯菌素的合成起正调控作用。

图5 菌株JP2-270及衍生菌株发酵产物HPLC分析结果图Fig.5 HPLC analysis of fermentation broth of JP2-270 and derivatives
3 讨论
土壤中有益微生物资源的挖掘是更好发挥生物防治优势的前提,假单胞菌一直被认为是植物根际细菌中抑制病菌的最重要类群之一,也是研究最为深入的一类土壤细菌。然而,土壤中的另一大类群伯克霍尔德氏菌同样具有很好的生防潜能和多种代谢物合成的能力,近年来也越来越引起人们的关注。本研究前期从中国水稻研究所基地水稻根系土壤中分离到一株细菌JP2-270,抑菌活性显示无论在平板上还是在水稻叶片上都表现出很好的抑制水稻纹枯病菌活性(图1)。伯克霍尔德氏菌属的多个种已经有作为生防菌群的研究报道,如吡咯伯克霍尔德氏菌BurkholderiapyrrociniaLyc2已报道具有抗细菌的活性[19],而该种的另一株菌 BRM 32113能够诱导水稻产生系统性抗性,降低水稻叶瘟的严重程度[20],洋葱伯克霍尔德菌BurkholderiacepaciaR-12632产生的硫化联踔酚酮(ditropolonyl sulfide)具有抗细菌活性[21],洋葱伯克霍尔德菌CQ18同时具有抗病和溶磷的能力,能够调节土壤生态微环境[22]。
本研究中的伯克霍尔德氏菌具有抗水稻纹枯病菌的生防潜能,为了对其更好地加以利用,通过分子生物学的研究方法初步探讨了其抑制纹枯病菌的机理。伯克霍尔德氏菌具有大而复杂的基因组,通常具有2个环形染色体和0~6个质粒,平均大小约7.5 Mb[23],这样相对复杂的基因组为伯克霍尔德氏菌强大的代谢潜能提供了基础。前期的研究已经揭示 JP2-270基因组由 3个染色体和 2个质粒组成,总的大小为8925310 Mb,共编码8193个蛋白[24]。本研究通过antiSMASH在线分析软件对JP2-270基因组中次生代谢物合成基因簇进行分析,预测到了3个与已知代谢物合成基因簇高度同源的基因簇,即硝吡咯菌素合成基因簇(pyrrolnitrin)prnA-D,抗真菌糖肽(occidiofungin)合成基因簇ocfA-N和剑兰制霉菌素(gladiostatin)合成基因簇gdsA-I。硝吡咯菌 pyrrolnitrin是一种常见的具有广谱抗菌活性的代谢物,通常由假单胞菌Pseudomonas、沙雷氏菌Serratia和伯克霍尔德氏菌Burkholderia的一些种所产生[25]。抗真菌糖肽occidiofungin是由洋葱伯克氏菌MS14产生的一种糖脂肽类物质,由8个氨基酸和一个木糖组成,具有广谱的抗植物和动物病原真菌的活性[16];剑兰制霉菌素gladiostatin是新分离鉴定到的戊二酰亚胺聚酮类化合物,具有抗肿瘤细胞的活性[13]。通过基因敲除及抗性筛选,发现硝吡咯菌素合成基因簇的缺失突变导致菌株JP2-270抑制纹枯病的活性明显降低,而抗真菌糖肽合成基因簇和剑兰制霉菌素合成基因簇的缺失对菌株JP2-270抑制纹枯病菌活性的影响较小,由此认为菌株JP2-270产生的硝吡咯菌素是抑制水稻纹枯病菌的主要活性代谢物。硝吡咯菌素pyrrolnitrin具有抗水稻纹枯病菌活性的发现是可预见的结果,然而硝吡咯菌素合成调控的研究还比较少,在伯克霍尔德氏菌和沙雷氏菌,已有的研究报道显示硝吡咯菌素的合成是受群体感应系统所调控的[26,27],在绿针假单胞菌PseudomonaschlororaphisG05中有报道一种LysR类型转录调控蛋白FinR能调控pyrrolnitrin的合成[28]。
LysR类型的转录调控蛋白(LysR-type transcription regulators,LTTRs)是原核生物中最常见的转录调控因子之一,可以作为基因表达的激活剂或抑制因子[29-31]。LTTRs能够调控多种基因表达,包括根瘤菌的共生固氮相关基因、细菌致病性相关基因、代谢相关基因、群体感应和运动性相关基因的表达,是一种全局性的转录调控蛋白[32]。目前在多种菌属中都发现 LTTRs能够诱导或抑制次生代谢物的合成,如天蓝色链霉菌Streptomycescoelicolor中的 StgR通过与途径特异性调控因子的相互作用抑制 actinorhodin和prodigiosin的合成[33],泰国假单胞杆菌Burkholderiathailandensis的ScmR对多种次生代谢物的合成起正向和反向的调控作用[34],假单胞杆菌Pseudomonassp.M18中的PqsR抑制藤黄绿脓菌素(pyoluteorin)合成的同时,能够激活吩嗪-1-羧酸(phenazine-1-carboxylic acid)的合成[35]。LysR家族转录调控因子在假单胞菌中的研究比较详尽,而在伯克霍尔德氏菌Burkholderia中的研究相对较少,且主要集中于致病性伯克霍尔德氏菌的生物膜形成、致病性、菌落形态和群体感应等方面[36-39]。该家族的转录调控因子在伯克霍尔德氏菌中参与次生代谢物合成调控的研究目前报道的仅有ScmR和ShvR两个调控因子[34,40]。前期研究已经通过Tn5转座子随机诱变发现了一个新的LysR家族的转录调控因子BysR,并证实该调控因子与JP2-270抑制病原真菌的活性相关[24]。为了探讨该蛋白是否调控硝吡咯菌素的合成,进而控制菌株JP2-270抑制水稻纹枯病菌活性,本研究从转录水平和代谢物合成水平上分析了突变菌株ΔbysR和野生型菌株JP2-270的基因表达和代谢物合成差异。试验结果证实BysR调控蛋白在转录水平上调控硝吡咯菌素合成基因簇的表达,进而调控硝吡咯菌素的合成,BysR调控蛋白对硝吡咯菌素的合成起正调控作用。本研究发现的BysR蛋白属于LysR家族转录调控蛋白,对硝吡咯菌素的合成具有正向调控作用,与其他伯克霍尔德氏菌报道的硝吡咯菌素的合成受到群体感应系统的调控不一致。另外,虽然本研究中的BysR蛋白也属于LysR家族,但是该蛋白来源于伯克霍尔德氏菌,与来源于假单胞菌的FinR蛋白的同源性较低,可能BysR对硝吡咯菌素的合成调控模式不同于FinR蛋白。此外,根据本研究室还未公开发表的数据显示,菌株JP2-270中一群体感应信号也影响了硝吡咯菌素的合成,且该群体感应信号基因的表达同时也受到BysR调控蛋白的调控,推测BysR调控蛋白可能通过影响该群体感应系统,进而影响硝吡咯菌素合成基因簇的表达。然而,目前关于转录调控蛋白BysR作用机制的研究工作尚处于起步阶段,因此菌株JP2-270中BysR蛋白对硝吡咯菌素的合成是起直接调控作用还是间接调控作用,还有待继续深入研究。
伯克霍尔德氏菌中 BysR调控因子的发现具有重要的意义。首先,BysR调控硝吡咯菌素 pyrrolnitrin的合成在伯克霍尔德氏菌中是一个新的发现,这能够丰富pyrrolnitrin代谢物合成调控网络。其次,未公开的RNA-seq数据发现BysR还调控多种代谢物的合成,BysR调控蛋白在挖掘新结构天然产物研究方面也具有十分重要的意义。最后,BysR调控蛋白可以作为基因工程改良的靶点,为菌株的遗传改造提供理论依据,也为生物防治水稻纹枯病等各种真菌病害提供新的可靠方法。
致谢:感谢国家自然科学基金给予的资助;感谢中国水稻研究所国家重点实验室提供的实验平台;感谢中国水稻研究所黄世文老师提供的水稻纹枯病菌和中国农业微生物菌种保藏管理中心提供的病原真菌。
