禾谷缢管蚜翅型分化与共生菌的关联
2022-04-22王利沙朱香镇李东阳张开心姬继超雒珺瑜
徐 超,王利沙,朱香镇,王 丽,李东阳,张开心,姬继超,雒珺瑜
(中国农业科学院棉花研究所/棉花生物学国家重点实验室,安阳 455000)
蚜虫是世界范围内最具破坏性的害虫之一,当前已发现的蚜虫涵盖10个科,约4400种,其中约250种是对于农林业和园艺业为害严重的害虫[1]。蚜虫是典型的刺吸型害虫,通过吸食植物汁液直接为害,影响植物发育,造成品质与产量的降低。禾谷缢管蚜Rhopalosiphumpadi是我国乃至世界范围内小麦上的重要害虫,其不仅可以直接取食为害小麦,还可以作为麦类作物病毒病的重要介体导致小麦病毒病流行[2,3]。2020年9月15日,禾谷缢管蚜被农业农村部列入一类农作物病虫害名录。
蚜虫的主要生殖方式为孤雌生殖,高效的生殖是其成灾的重要原因[4]。当种群密度过高或光照、温度等环境因素以及寄主植物质量发生改变时,会诱导孤雌蚜从无翅型转变为有翅型[5]。实际上,蚜虫的翅型分化是其自身适应环境压力的重要手段,有翅蚜的出现使其能够进行远距离迁飞,降低生存竞争压力的影响,对个体的生存及种群的发展具有积极意义[6]。除自然选择压力外,激素信号通路和表观遗传修饰被发现在蚜虫翅型分化中发挥重要作用[7-9]。豌豆蚜Acyrthosiphonpisum在注射蜕皮激素或其类似物后,产生的有翅后代数量增加[10]。麦长管蚜Sitobionavenae多种miRNA可能结合并促进各种生物途径的转录后调控,调节其翅型分化[11,12]。
共生菌广泛参与了宿主昆虫的生长发育、免疫防御、抗药性的产生和生殖等众多关键生理过程[13,14]。例如,Buchnera介导并参与豌豆蚜体内非必需氨基酸与必需氨基酸的运输与转化,保证了豌豆蚜生存的营养需求[15];豌豆蚜的四种远缘共生菌(Regiella,Rickettsia,Rickettsiella,Spiroplasma)在病原真菌Pandoraneoaphidis的侵染过程中发挥重要作用,它们减少了杀死蚜虫的真菌孢子形成,从而降低了宿主昆虫的死亡率[16];橘小实蝇Bactroceradorsalis肠道共生菌——弗氏柠檬酸杆菌Citrobacterfreundii能够合成分泌磷酸水解酶,将敌百虫降解为水合氯醛和亚磷酸二甲酯,从而降低对其宿主昆虫的防治效果[17]。Wolbachia能够通过 4种方式对宿主产生生殖调控,包括细胞质不亲和(Cytoplasmic incompatibility,CI)、诱导孤雌生殖(Parthenogenesis inducing,PI)、雌性化(Feminization)和杀雄作用(Male-killing)[18,19]。
随着研究的深入,共生菌被发现参与了宿主昆虫的翅型分化过程。例如,经利福平消除布赫纳氏菌后,麦长管蚜有翅后代的比例显著降低[20];豌豆蚜暴露于报警信息素的情况下,次级共生菌Serratia、Hamiltonella和Regiella不同程度地增加了其产生有翅后代的数量,Regiella的影响相对最显著[21]。然而,共生菌与蚜虫翅型分化的互作关系方向的研究很少,有翅型和无翅型蚜虫之间的细菌群落分布差异并没有明确。为了更好地了解共生菌在有翅型和无翅型禾谷缢管蚜中的差异,我们通过高通量DNA测序技术对样品中的细菌16S rDNA基因序列进行检测,获得了禾谷缢管蚜共生菌组成与结构,而后比较了不同翅型禾谷缢管蚜共生菌群落差异。这为进一步阐释共生菌在蚜虫翅型分化的作用机制奠定了基础,并为控制蚜虫种群的暴发和迁飞提供了新思路。
1 材料与方法
1.1 供试昆虫
禾谷缢管蚜采集于中国农业科学院棉花研究所安阳市白璧镇试验田,对试虫进行形态学鉴定后,单头接种在小麦幼苗上,共10个重复,置于恒温气候培养箱(温度28 ℃,光周期14L:10D,相对湿度 65%,光照强度15000 lx)中培养。产仔后,每个重复取一头进行基于线粒体COI基因的DNA条形码鉴定,引物序列 F:5′-CGAGCCTATTTCACATCA-3′;R:5′-GCATACCTGCTAACCCTA-3′(基因登陆号:MT119781.1)。在确定待试蚜虫为禾谷缢管蚜后,通过控制种群密度使其进行翅型分化[22],每株小麦幼苗上接种30头蚜虫进行高密度饲养,诱导产生有翅型后代。成虫出现48 h内,用软刷从同一寄主小麦植株上采集无翅成虫和有翅成虫。在超净工作台中,75%乙醇消毒5 min后,依次用PBS缓冲液(pH 7.4)和灭菌的超纯水冲洗3次,然后用高压灭菌的吸水滤纸去除残余水分。每50头作为一个生物重复,每种翅型4个生物重复。
1.2 DNA提取与PCR扩增
使用天根血液/细胞/组织基因组DNA提取试剂盒(DP304)提取无翅和有翅型样品总DNA。利用NanoDrop 2000C型微量分光光度计对提取DNA的浓度和质量进行检测(OD260/280),并通过1.2%的琼脂糖凝胶电泳检测DNA的质量。
以上述 DNA 为模板,采用 16S rDNA 基因的 V3-V4区通用引物(338F:5′-ACTCCTACGGGA GGCAGCAG-3′,806R:5′-GGACTACHVGGGTWTCTAAT-3′)[23]进行 PCR 扩增,扩增程序为:95 ℃预变性3 min,35个循环(95 ℃变性30 s,55 ℃ 退火30 s,72 ℃ 延伸30 s),最后72 ℃延伸10 min。扩增体系为 20 μL,含 4 μL 5×FastPfu 缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL 引物(5 μmol/L),0.4 μL FastPfu 聚合酶,10 ng DNA模板。
1.3 Illumina Miseq测序与数据处理
根据Illumina MiSeq 平台标准操作规程将纯化后的扩增片段构建PE 2×300的文库,利用MiSeq PE300平台进行测序(上海美吉生物医药科技有限公司)。原始FASTQ文件使用Trimmomatic软件质控,并通过FLASH软件按以下标准进行拼接:(1) 设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口前端位置截去该碱基后端所有序列,之后再去除质控后长度低于50 bp的序列;(2) 根据重叠碱基overlap将两端序列进行拼接,拼接时overlap之间的最大错配率为0.2,长度需大于10 bp,去除无法拼接的序列;(3)根据序列首尾两端的barcode和引物将序列拆分至每个样本,barcode需精确匹配,引物允许2个碱基的错配,去除存在模糊碱基的序列。
1.4 数据统计与分析
使用的 UPARSE软件(version 7.1 http://drive5.com/uparse/),根据 97%的相似度对序列进行 OTU(Operational taxonomic units,操作分类单元)聚类,并在聚类的过程中去除单序列和嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条16S rDNA序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。通过Wilcox秩和检验(Wilcoxon rank-sum test)进行显著性差异分析,并用FDR(false discovery rate)的方法对P值进行检验校正。在OTU水平上,阈值FDR<0.01和P<0.05即确定两组样品的细菌相对丰度存在显著差异。将获取的16S序列通过ClustalW进行比对,明确样本中OTUS的进化关系,并将对比结果利用MEGA v5.05以环形系统进化树的方式表现出来。
2 结果与分析
2.1 测序数据统计与分析
在Illunina Miseq PE 300平台上对两种翅型蚜虫的DNA样品中的细菌16S rDNA基因V3-V4区进行测序,所有样本按照最小样本数进行抽平,并基于97%的序列相似度进行OTU聚类。得到高质量的序列为399209条,碱基数为170497329个,组间平均测序覆盖率为1,这表明本次试验所测得的数据能够真实反映样品中绝大多数细菌类群的组成情况。无翅蚜四个样品的有效序列为193913条,平均长度为425 bp;有翅蚜为205296条,平均长度为428 bp。无翅蚜的Shannon指数大于有翅蚜,Simpson指数小于有翅蚜,说明无翅蚜样品的物种多样性高于有翅蚜;无翅蚜的ACE指数与Chaol指数大于有翅蚜,说明无翅蚜样品的物种丰度高于有翅蚜(表1)。通过Shannon和Chao指数的稀释曲线对样本的物种多样性进行评估,曲线在45000个reads之前便趋于平稳(图1A,1B),这表明样本的测序数据量是合理的,可以在此基础上展开数据分析。
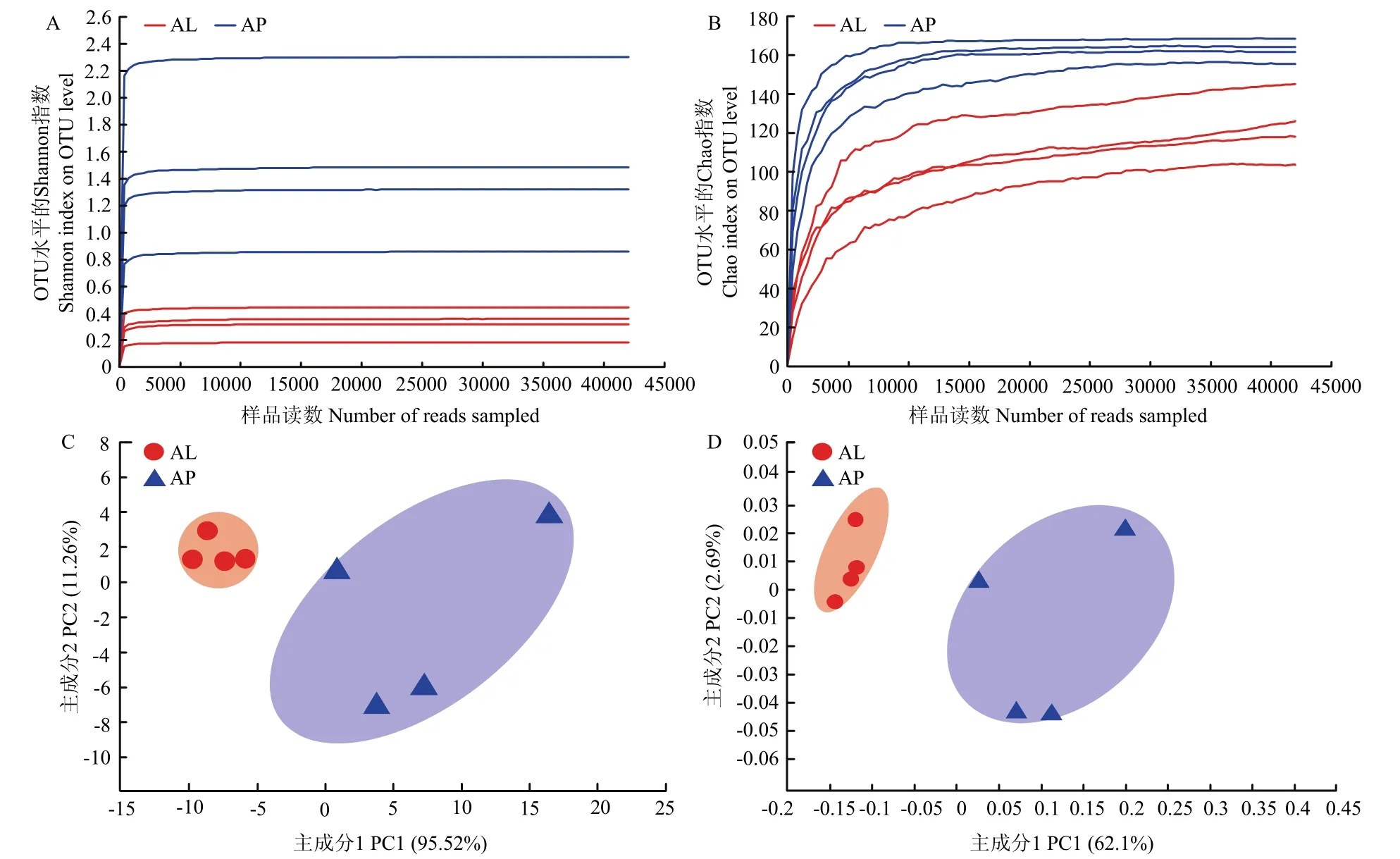
图1 有翅(AL)和无翅(AP)禾谷缢管蚜细菌群落的α多样性指数稀释曲线(A与B)和样本聚类分析(C与D)Fig.1 Rarefaction curves of α-diversity indices (A and B) and samples cluster analysis plot of bacterial communities (C and D) from alate and apterous morphs of R.padi

表1 两组样品中的有效序列数目和平均长度、多样性指数、丰富度及样品覆盖度Table 1 The valid sequences number and average length, diversity index, richness and sample coverage in two groups
2.2 禾谷缢管蚜共生菌物种注释与分析
禾谷缢管蚜两组样本共聚类到174个OTUs,这些OTUs按分类阶元可划分为10门,18纲,42目,66科,98属,137种(图2)。
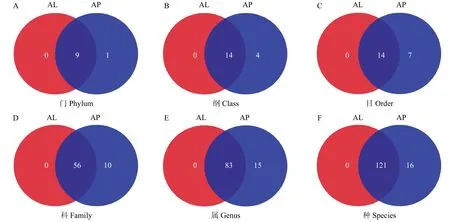
图2 有翅与无翅禾谷缢管蚜各分类学水平的细菌群落比较Fig.2 Venn diagram of bacterial community obtained from alate and apterous morphs of R.padi at different classification levels
两组样本中,在门水平,变形杆菌为丰度最高的优势菌门(85.98%);在目水平,肠杆菌目为优势菌目(83.13%);在科水平,肠杆菌科为优势菌科(83.13%);在属水平,布赫纳氏菌为优势菌属,其丰度为82.88%(表2)。

表2 禾谷缢管蚜不同分类水平的细菌群落组成Table 2 Bacterial community composition of R.padi at different taxonomic levels
2.3 两种翅型禾谷缢管蚜共生菌结构差异
将禾谷缢管蚜按照翅型分为有翅型和无翅型两个分组,每组分为4个生物重复,通过主成分分析(PCA)、主坐标分析(PCoA)两种算法,在OTU水平上分析了两种翅型的禾谷缢管蚜成虫的细菌结构组成的差异。如图1C、1D所示,AP与AL两组样品的四个重复具有明显的聚集性,而两组样品间的距离明显,说明两种翅型的禾谷缢管蚜的共生菌组成结构存在显著性差异。
两组样品中,有翅型禾谷缢管蚜的共生菌多样性相对较低,共聚类151个OTUs,包含了9门、14纲、35目、56科、83属、121种;无翅型禾谷缢管蚜的共生菌多样性相对较高,共聚类出174个OTUs,隶属于10门、18纲、42目、66科、98属和137种(图2)。其中酸杆菌门Acidobacteria(1种)、放线菌门Actinobacteria(7种)、拟杆菌门Bacteroidetes(3种)、绿弯菌门Chloroflexi(2种)、变形菌门Proteobacteria(3种)、厚壁菌门Firmicutes(1种)和单糖菌门Saccharibacteria(5种)等共22种共生菌是无翅型禾谷缢管蚜特有的。在环形物种进化树中,变形菌Proteobacteria是门水平上最大的类群,囊括了63个OTUs,占总OTUs的36.2%;其次是放线菌门Actinobacteria,包含61个OTUs,占比35.1%。其中,OTU2028-布赫纳氏菌Buchnera(279537 reads)、OTU108-木糖葡萄球菌Staphylococcusxylosus(13574 reads)、OTU1925-节杆菌Arthrobacterarilaitensis(6693 reads)和OTU137-松鼠葡萄球菌Staphylococcussciuri(4005 reads)的丰度显著高于其他的OTUs(图3)。
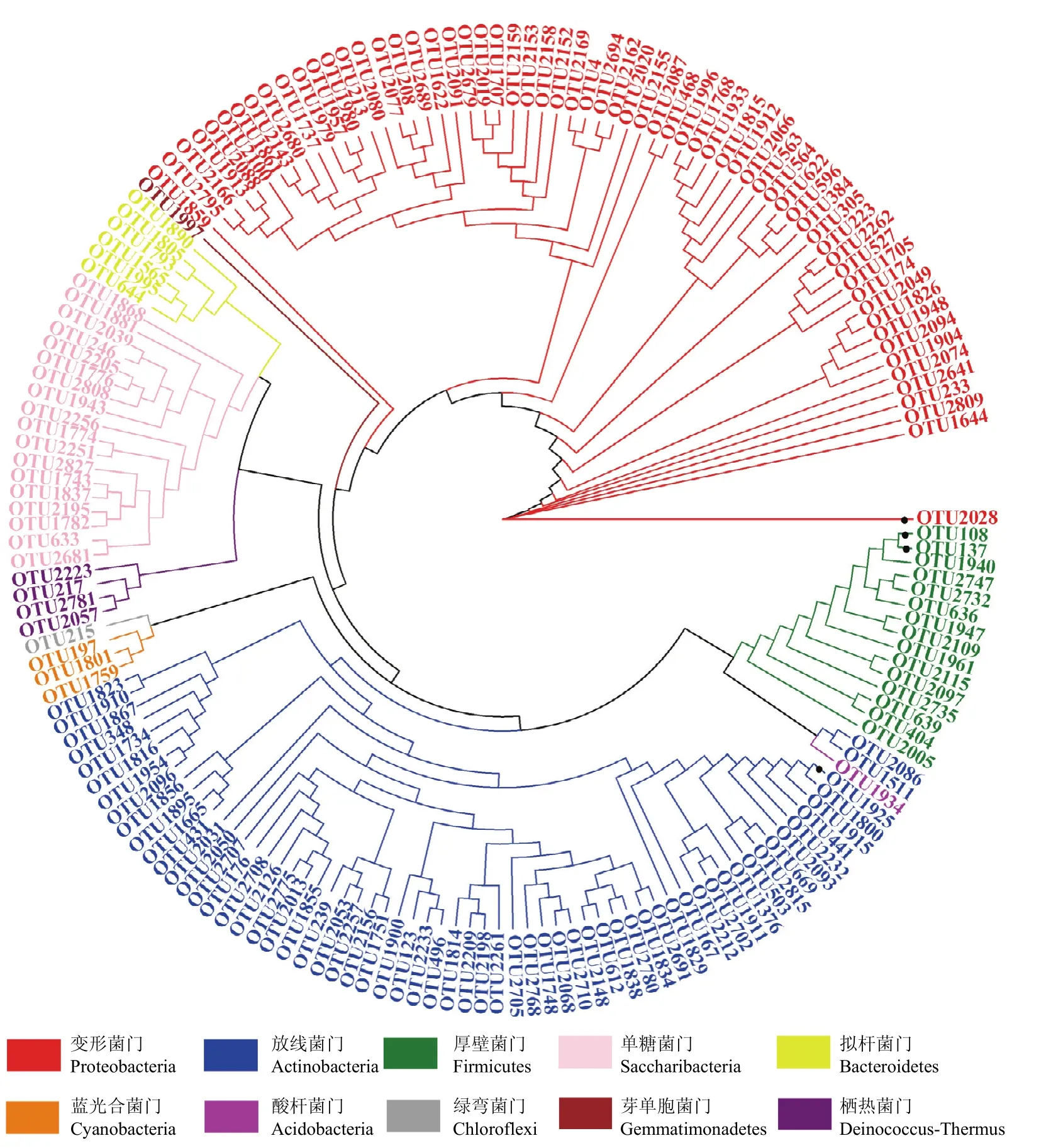
图3 基于OTU序列的禾谷缢管蚜细菌群落系统发育分析Fig.3 Phylogeny of bacterial community identified in R.padi based on the OTUs sequences
2.4 两种翅型禾谷缢管蚜共生菌丰度差异
将两种翅型的禾谷缢管蚜样品分别组内求均值后,在各分类学水平上对比两者间的共生菌丰度差异。在门水平,两组样品中丰度最高的为变形菌门,在有翅蚜中占比97.29%,无翅蚜中占比74.94%。其余占比大于1%的有放线菌门、厚壁菌门与单糖菌门三种,在有翅蚜中的丰度均低于无翅蚜(图4A)。
在纲水平,两组样品中丰度最高的为γ-变形菌纲,在有翅蚜中占比96.88%,无翅蚜中占比72.34%;其他占比大于1%的包括放线菌纲、芽胞杆菌纲、α-变形菌纲与norank_p_Saccharibacteria共5个纲,在有翅蚜中的丰度均低于无翅蚜(图4B)。
在目水平,两组样品中丰度最高的为肠杆菌目,在有翅蚜中占比95.81%,无翅蚜中占比71.08%;其他占比大于1%的包括芽胞杆菌目、微球菌目、丙酸杆菌目、假单胞菌目和假诺卡氏菌目等6个目,在有翅蚜中的丰度均低于无翅蚜(图4C)。
在科水平,两组样品中丰度最高的为肠杆菌科,在有翅蚜中占比95.81%,无翅蚜中占比71.08%,其他占比大于1%的包括葡萄球菌科、微球菌科、类诺卡氏菌科和假诺卡氏菌科等5个科,在有翅蚜中的丰度均低于无翅蚜(图4D)。
在属水平,两组样品中丰度最高的为布赫纳氏属,在有翅蚜中占比95.58%,无翅蚜中占比70.84%,其他占比大于1%的包括葡萄球菌属、节杆菌属、类诺卡氏菌属与假诺卡氏菌属等5个属,在有翅蚜中的丰度均低于无翅蚜(图4E)。

图4 有翅型和无翅型禾谷缢管蚜的共生菌在不同分类阶元的相对丰度Fig.4 Relative abundance of symbiotic bacteria in alate and apterous morphs of R.padi at different classification levels
在种水平,布赫纳氏菌所占比例最高,在禾谷缢管蚜有翅型中平均占比95.53%,在无翅型中平均占比70.82%。木糖葡萄球菌次之,在有翅型中平均占比0.06%,在无翅型中平均占比8.04%。此外,阿氏节杆菌、松鼠葡萄球菌以及两种未分类的类诺卡氏菌,在无翅成虫中的丰度也>1%,但在有翅成虫中丰度均低于0.5%(图5A)。
在两种翅型的禾谷缢管蚜成虫间具有显著性差异的、丰度均值最高的5种OTUs中,只有OTU2028(布赫纳氏菌)在有翅成虫中的丰度要高于无翅成虫。其他4种OTUs(OTU108、OTU1925等)在无翅成虫中的丰度均显著高于有翅成虫(图5B)。
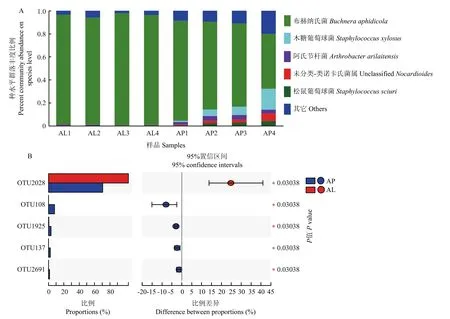
图5 有翅和无翅禾谷缢管蚜的细菌多样性差异Fig.5 The difference of bacterial diversity in alate and apterous morphs of R.padi
3 讨论
蚜虫共生菌多样性差异的原因是多样化的,物种差异、种内表型、寄主植物、地理位置以及季节变化等都可能会造成其共生菌群落结构的变化[24,25]。近年来,微生物被报道参与宿主昆虫的各种表型可塑性过程,如共生菌Regiellainsecticola显著增加了豌豆蚜产生有翅型后代的数量等[21,26]。为了更好地理解细菌群落与翅型分化之间的关系,本研究对禾谷缢管蚜有翅和无翅型的体内细菌群落进行了比较。为避免可能受到其他因素的干扰,如近缘种形态相似、田间种群细菌群落多样性差异过大等[27],本研究首先将野外采集的禾谷缢管蚜在实验室内扩繁后,进行DNA条形码鉴定,确定待用虫体为禾谷缢管蚜后,选取两种翅型成蚜进行16S rDNA基因V3-V4测序分析。两组样品共鉴定出137种细菌,有翅蚜包含了121种,无翅蚜囊括了全部137种(图2)。
布赫纳氏菌是禾谷缢管蚜的优势共生菌,在两组样品中,平均相对丰度最高(图 5A),这一结果与其他蚜虫类似[28]。布赫纳氏菌作为蚜虫的初级共生菌,参与宿主的发育和繁殖等生命活动[29,30],两者经历了长期的平行进化。布赫纳氏菌在有翅蚜体内的含量占其共生细菌总量的 95.53%,而在无翅蚜中占70.82%,两者之间存在显著差异(图 4E)。由此可见,布赫纳氏菌极有可能影响蚜虫的翅型分化。这一结果与Hardie和Leckstein[31]的研究结果相互印证:该研究发现,蚕豆蚜A.fabae有翅后代的减少可能与B.aphidicola丧失所引起的营养受损有关。同样,Zhang等[20]通过抗生素消除了麦长管蚜若虫中的布赫纳氏菌,降低了其后代发育成有翅蚜的比例,这可能是由于布赫纳氏菌的缺失导致蚜虫生理活性受到抑制或缺乏生长发育所必需的氨基酸所致。
阿氏节杆菌Arthrobacterarilaitensis在无翅蚜中占比3.451%,远高于有翅蚜中的0.498%(图5A)。该细菌可参与宿主的氮元素转化与利用[32],在植物与土壤中经常被报道[33],表明这种共生菌可能是蚜虫从环境或寄主植物中获得的。木糖葡萄球菌Staphylococcusxylosus与松鼠葡萄球菌Staphylococcussciuri在无翅蚜中含量分别为8.04%和2.38%,但是在有翅蚜中,分别仅占0.06%与0.02%。这两种葡萄球菌均被报道具有抵抗致病菌的功能[34,35]。阿氏节杆菌以及上述两种葡萄球菌为何在两种翅型禾谷缢管蚜体内的分布有差异,仍需进一步探究。此外,该研究发现有翅蚜的共生菌多样性低于无翅蚜,有 16种共生菌是无翅型禾谷缢管蚜特有的。造成有翅蚜共生菌多样性降低的原因,可能是布赫纳氏菌丰度增加抑制了某些食物源细菌进入体内并定殖。类似的共生菌互补与替代的情况在其他昆虫中也有报道[36,37]。
本研究检测了有翅型与无翅型禾谷缢管蚜共生细菌群落的差异,初步探究了其与宿主翅型分化之间的联系。在有翅蚜中,仅有布赫纳氏菌的丰度显著高于无翅蚜,其它细菌均低于无翅蚜。在细菌群落多样性方面,无翅蚜在各分类阶元细菌群落多样性均高于有翅蚜。我们推测布赫纳氏菌可能是参与禾谷缢管蚜进行有翅分化的关键共生细菌,而有翅蚜翅的分化会相对降低共生细菌的多样性与群落丰度。本研究结果对开展共生菌的功能研究具有重要参考价值,为通过调控共生菌群治理禾谷缢管蚜种群的暴发与迁飞提供了新思路。
