褪黑素对小鼠心肺复苏后脑损伤的影响及其机制研究*
2022-04-21李英赵晖王蹿蹿南岳王东杜新平
李英,赵晖,王蹿蹿,南岳,王东,杜新平
(天津市第五中心医院心血管内科,天津300450)
脑组织缺血再灌注导致的损伤是心脏骤停(cardiac arrest,CA)后死亡的首要病因[1]。然而到目前为止,尚无药物能有效改善其预后。有研究表明,脑组织缺血再灌注后可导致氧自由基生成、钙超载、炎症反应、内质网应激等,并且进一步导致脑神经元细胞死亡[2-3]。褪黑素是由松果体分泌的神经内分泌激素,具有降低氧自由基、抑制内质网应激等作用。多项动物研究结果显示,褪黑素通过其抗氧化活性可有效减轻脑、肾等器官的缺血/再灌注损伤[4-6]。然而,褪黑素是否能够通过抑制内质网应激并缓解CA、心肺复苏(cardiopulmonary resuscitation,CPR)后脑缺血/再灌注损伤尚未见报道。本研究拟复制小鼠CA 后CPR 诱导的脑损伤模型,通过褪黑素药物干预,探讨其作用及作用机制,以期为临床研究提供理论基础。
1 材料与方法
1.1 一般材料
44 只健康、雄性、成年、体重18~24 g 的BALB/c 小鼠,实验动物生产许可证号:SCXK(苏)2021-0013,实验动物使用许可证号:SYXK(京)2020-0050,购于常州卡文斯实验动物有限公司。小鼠随机分为假手术组(8 只)、模型组(18 只)、褪黑素组(18 只)。动物饲养及实验方案均严格按照医院动物伦理委员会动物实验规范执行。
1.2 主要设备与试剂
体视显微镜(SANQTID 8-50X) 购自深圳市三锵泰达光学仪器有限公司,生物信号采集处理系统(MADLAB-4C/501H 型) 购自北京众实迪创科技发展有限责任公司,呼吸机购自河南省新乡市原阳县振华教学仪器有限公司。褪黑素(C10260299)购自上海麦克林生化科技有限公司,肝素(EHJID-HEP001)购自浙江惠嘉生物科技有限公司,氯化钾(10016308)购自上海国药集团化学试剂有限公司,盐酸肾上腺素(200116)购自宁波第二激素厂,丙二醛(Malondialdehyde,MDA)检测试剂盒(K739-100)购自美国Biovision 公司,乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒(KGT02424)购自江苏凯基生物技术股份有限公司,兔抗小鼠一抗GRP78(#3177)、Chop(#3177)、PERK(#3192)、eIF2α(#5324)、p-eIF2α(#3398)、ATF4(#11815)、β-actin(#4970)、山羊抗兔二抗(#7074)购自美国Cell Signaling Technology 公司,p-PERK(bs-3330R)购自北京博奥森生物技术有限公司。
1.3 方法
1.3.1 动物准备与模型复制小鼠手术前夜禁食,可自由饮水。术前称重,使用异氟烷吸入麻醉后气管插管,接入呼吸机,异氟烷维持浓度为1.5%,吸入氧浓度30%、氮气70%,固定小鼠,并记录标准Ⅰ导联心电图,将测温探头置于颞肌,加温头部至37.5℃,并维持10 min。剔除右侧胸前区和右腹股沟区鼠毛,先后予以乙醇和络合碘消毒。消毒后以右侧胸锁关节为中心斜下、右腹股沟沿大腿切开0.7~1.0 cm,分离颈外静脉、股动脉。于股动脉置入PE10 管,并接入血压监测系统检测血压,于颈外静脉置入PE10 管(PE 管预充1%肝素盐水)。PE10 管连接于充有50 μL 1%肝素的注射器。置管后注射25 μL 1%肝素,随后抽吸300~350 μL 血液。待脑温达37.5℃后迅速注射30 μ L 0.5 mol/L 氯化钾,关闭呼吸机、麻醉药物、氮气,将氧气浓度调至100%。心脏骤停2 min 后将先前抽取的血液1 min 内注射进小鼠体内。小鼠心脏骤停7 min 30 s 后缓慢静脉泵入3.2%肾上腺素(1.2 mL/h)。小鼠心脏骤停8 min 时打开呼吸机,心脏按压(300 次/min),静脉快速泵入3.2%肾上腺素100 μL 后继续以1.2 mL/h 速度持续静脉泵入。自主循环恢复后停止按压,继续静脉泵入3.2%肾上腺素50 μL,自主循环恢复10 min后将吸入氧气浓度调整为50%、氮气浓度调整为50%,30 min 后关闭呼吸机、氧气、氮气,并放置于鼠笼恢复。心脏按压2 min 30 s 尚未恢复自主循环视为复苏失败,作为排除标准。实验整个过程维持脑温37.5℃。因股动脉穿刺术后小鼠右下肢瘫痪,无法进行行为学检测,各组选取5 只测定血压,其余不进行血压监测。假手术组术前准备同上。待脑温达到37.5℃、吸入氧浓度调至100%时,不予以注射肾上腺素。待18 min后将吸入氧气浓度调整为50%、氮气浓度调整为50%,38 min 后撤股动脉管、缝合皮肤,关闭呼吸机、氧气、氮气,置于鼠笼恢复。假手术组不予任何处理。褪黑素组于术前30 min 腹腔注射褪黑素(10 mg/kg),术后第2 天开始以同样剂量腹腔注射,2 次/d。模型组注射1%乙醇盐水,注射时间和方式同褪黑素组。
1.3.2 神经功能评分各组小鼠心脏骤停后第3 天进行行为学测定。神经功能评分采用9 分法[7],具体评分标准如下:将小鼠放置在10 cm×20 cm 的水平网格状屏幕上(网格大小为0.2 cm×0.2 cm),并旋转到垂直90°,记录小鼠能够黏附在垂直屏幕上的时间,持续≥15 s 计3 分。接下来,将小鼠放在一根水平木棒(直径1.5 cm)的中心,并记录小鼠在木棒上保持平衡的时间,持续≥30 s 计3 分。最后进行牵拉试验,测定小鼠能抓住水平绳子的时间,>5 s 计3 分。9 分为正常,0 分为严重神经功能损伤。
1.3.3 小鼠存活率评估心脏骤停后第10 天观察小鼠的死亡情况,计算存活率。
1.3.4 Western blottingWestern blotting 检测小鼠脑组织GRP78、PERK、p-PERK、eIF2α、p-eIF2α、ATF4、Chop 蛋白相对表达量。心脏骤停后6 h 取各组小鼠全脑,各组剪取适当大小脑组织加入到裂解液中裂解,裂解完后4℃、12 000 r/min离心5 min,采用BCA 法测定蛋白浓度,根据测定结果对蛋白浓度进行调整。取等量蛋白样品依次进行8% SDSPAGE 电泳和转膜,随后室温摇床封闭2 h。分别加入相应一抗(1∶1 000),4℃孵育过夜,再用二抗(1∶2000)37℃摇床孵育2 h。以β-actin 作为内参,ECL显色曝光、照相,采用Image J 软件处理图像,计算目标蛋白与β-actin 灰度比值。
1.3.5 LDH、MDA测定心脏骤停术后6 h 取动脉血500 μL,静置后离心取血清,检测LDH 活性;取10 mg 脑组织,加入1 mL 的MDA 裂解液(已加入3 μL 100×BHT)匀浆,以13 000 r/min 离心10 min,取上清液,测定MDA 水平。样品制备完成后,严格按照试剂盒说明书操作。
1.3.6 海马CA1 区神经元细胞死亡检测将实验所需组织放入4%多聚甲醛固定后,用分级浓度的乙醇脱水,二甲苯使其透明化,随后组织浸蜡、包埋,并切成5 μm 厚的连续切片。切片用苏木精染色5 min,1%盐酸乙醇浸泡3 s,伊红复染3 min。最后将切片脱水,并固定于显微镜下观察、拍照,统计神经元细胞死亡情况。
1.4 统计学方法
数据分析采用Prism 5 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析或t检验,进一步两两比较用LSD-t检验;计数资料以率(%)表示,比较用Monte Carlo 近似法检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠一般资料比较
小鼠均复苏成功。各组小鼠体重、心率、平均动脉压、胸外按压时间、肾上腺素用量、自主呼吸恢复时间比较,差异无统计学意义(P>0.05)。见表1。
表1 各组小鼠一般资料比较(±s)

表1 各组小鼠一般资料比较(±s)
组别假手术组模型组褪黑素组F/t 值P 值n8 18体重/g 20.1±2.2 21.2±2.2 21.1±2.0 0.818 0.448心率/(次/min)540.0±21.3 544.5±19.1 541.2±15.1 0.192 0.826平均动脉压/mmHg 76.1±3.2 76.4±4.5 75.1±2.5 0.541 0.586胸外按压时间/s-87.4±32.1 78.1±25.0 0.940 0.354肾上腺素用量/μL-263.1±39.4 264.3±41.2 0.075 0.941 18自主呼吸恢复时间/s-413.1±68.2 390.2±62.2 1.060 0.296
2.2 褪黑素对小鼠存活率的影响
模型组术后第5、7 及8 天分别死亡1 只,10 d生存率为70%,褪黑素组第9 天死亡1 只,10 d 生存率为90%,假手术组小鼠10 d 内无死亡情况。各组小鼠术后10 d 生存率比较,经Monte Carlo 近似法检验,差异无统计学意义(P=0.286)。
2.3 各组神经功能评分比较
假手术组、模型组、褪黑素组神经功能评分分别为(8.91±0.08)分、(4.40±0.97)分、(6.20±0.63)分,经方差分析,差异有统计学意义(F=115.012,P=0.005),模型组较假手术组低(P<0.05),褪黑素组较模型组高(P<0.05)。表明褪黑素能够缓解CA 引起的脑神经功能损伤。
2.4 各CA1区神经元细胞死亡数量比较
假手术组、模型组、褪黑素组CA1 区神经元细胞死亡数量分别为(9.05±1.84)个/Hp、(22.11±3.28)个/Hp、(15.35±3.50)个/Hp,经方差分析,差异有统计学意义(F=16.340,P=0.0037),模型组较假手术组多(P<0.05),褪黑素组较模型组少(P<0.05)。见图1。
2.5 各组LDH活性、MDA水平比较
各组LDH 活性、MDA 水平比较,差异有统计学意义(P<0.05),模型组较假手术组高(P<0.05),褪黑素组较模型组低(P<0.05)。提示褪黑素能够缓解CA/CPR 引起的脑神经损伤。见表2。
表2 各组LDH活性、MDA水平比较(±s)
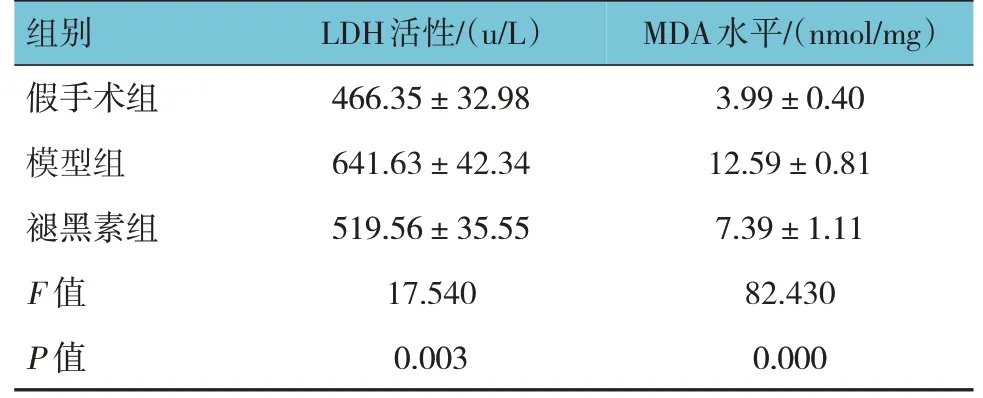
表2 各组LDH活性、MDA水平比较(±s)
组别假手术组模型组褪黑素组F 值P 值LDH活性/(u/L)466.35±32.98 641.63±42.34 519.56±35.55 17.540 0.003 MDA水平/(nmol/mg)3.99±0.40 12.59±0.81 7.39±1.11 82.430 0.000
2.6 各组脑组织GRP78、Chop、ATF4、p-eIF2α、p-PERK蛋白相对表达量比较
各组脑组织GRP78、Chop、p-PERK、p-eIF2α、ATF4 蛋白相对表达量比较,差异有统计学意义(P<0.05),模型组较假手术组高(P<0.05),褪黑素组较模型组低(P<0.05)。见表3 和图2。

图2 脑组织中内质网应激及其通路相关蛋白的表达
表3 各组脑组织GRP78、Chop、ATF4、p-eIF2α、p-PERK蛋白相对表达量比较(±s)

表3 各组脑组织GRP78、Chop、ATF4、p-eIF2α、p-PERK蛋白相对表达量比较(±s)
组别假手术组模型组褪黑素组F 值P 值GRP78 0.26±0.05 0.93±0.04 0.57±0.04 190.400 0.000 Chop 0.37±0.02 0.78±0.03 0.56±0.03 192.500 0.000 ATF4 0.27±0.03 0.77±0.04 0.48±0.02 186.200 0.000 p-eIF2α 0.51±0.03 0.99±0.01 0.83±0.04 184.600 0.000 p-PERK 0.22±0.02 0.72±0.03 0.43±0.03 297.500 0.000
3 讨论
目前公认的心脏骤停后脑复苏最有效的治疗策略是脑部低温治疗,但是其疗效十分有限。因此,探寻新的、有效的治疗方法具有重要意义。本研究结果显示,褪黑素组神经功能评分及脑海马CA1 区神经元细胞死亡检测结果均显著优于模型组,3 组CA/CPR 后10 d 小鼠存活率比较差异无统计学意义,但褪黑素组小鼠存活率高于模型组,说明褪黑素对CA/CPR 后脑缺血/再灌注损伤有一定的保护作用。
褪黑素是松果体分泌的一种激素,具有高脂溶性,能通过血脑屏障进入神经细胞和神经胶质细胞中发挥作用[8]。多项研究表明,褪黑素具有很强的清除羟自由基和过氧自由基的作用,还可通过增加抗氧化酶的活性发抗氧化作用,是已知体内最强的抗氧化成分之一[9]。目前认为心脏骤停后脑缺血/再灌注损伤主要机制之一是氧化应激反应[10]。有趣的是,内质网应激反应及PERKeIF2α-ATF4 信号通路与活性氧具有紧密的联系,PERK-eIF2α-ATF4 信号通路参与清除氧自由基而达到抗氧化作用[11-12]。此外,有研究报道褪黑素可有效改善小鼠急性心肌缺血/再灌注损伤,其机制可能是通过抑制PERK-eIF2α-ATF4 信号通路从而减少细胞凋亡[13],亦有研究结果显示褪黑素可通过抑制内质网应激,发挥脑梗死后的脑保护作用[14]。本研究结果显示,假手术组小鼠大脑GRP78、p-PERK、p-eIF2a、ATF4、Chop 蛋白相对表达量较模型组显著降低,褪黑素组较模型组降低,说明褪黑素可以抑制内质网应激,减少氧化应激,保护神经。
综上所述,褪黑素对CA/CPR 后小鼠脑缺血再灌注损伤具有保护作用。其机制可能是通过抑制PERK-eIF2α-ATF4 信号通路,从而缓解内质网应激,减轻神经损伤。
